
刘朝阳,硕士研究生,现就读于国家卫生健康委北京老年医学研究所。研究方向:代谢性疾病相关生物学标志物的代谢/脂质组学研究。
【摘要】磷脂酰乙醇是潜在的酒精摄入代谢物,准确测定其含量可以为酒精摄入监测提供客观、量化的重要参考依据。本研究建立了一种能够同时测定人全血样品中7种磷脂酰乙醇的液相色谱串联质谱分析方法。采用甲醇-甲基叔丁基醚-水作为萃取体系,选用Waters XBridge C18色谱柱,以2.5mmol L-1乙酸铵异丙醇溶液/2.5mmol L-1乙酸铵乙腈水溶液(v:v,50:50)为流动相进行梯度洗脱,采用电喷雾离子源负离子多反应选择离子监测。本方法经验证线性良好,相关系数大于0.9999,检测限和定量限分别为0.7~2.8ng mL-1、2.2~9.4ng mL-1,加标回收率在91.0%~102.2%之间,批内精密度和总精密度在0.4%~8.3%之间。使用本方法测定300例饮酒者全血样本,样本中的总磷脂酰乙醇浓度范围为51.1ng mL-1至2.9μg mL-1,平均为354.4ng mL-1。磷脂酰乙醇16:0/18:1、16:0/18:2是两个最主要丰度的同系物,平均浓度分别为74.2和48.7ng mL-1,各约占总量29.2%和19.2%。所建方法可以准确、精密检测人血磷脂酰乙醇含量,能够客观、可靠、量化反映人体酒精摄入状况,并可为临床酒精摄入监测提供有潜在应用价值的分析手段。
【关键词】磷脂酰乙醇;酒精摄入监测;高效液相色谱串联质谱
酒精摄入是全球范围内普遍存在的生活方式之一[1],大规模的流行病学研究认为酒精摄入是多种疾病的重要危险因素[2, 3]。准确客观评价乙醇摄入量是疾病防治与干预、酒精摄入监测的重要依据[4, 5]。近年有部分研究开始尝试使用生物学标志物来评价乙醇摄入水平。磷脂酰乙醇是磷脂酰胆碱在乙醇存在条件下经磷脂酶D酶解的特殊代谢产物[5-7]。由于磷脂酰乙醇只在乙醇存在下才能生成,对乙醇摄入具有极高特异性[5]。因此,磷脂酰乙醇作为酒精摄入标志物已引起人们广泛关注。磷脂酰乙醇由甘油磷脂骨架结构和两条脂肪酸长链组成[8, 9],侧链的不同使磷脂酰乙醇有许多分子种类。
因此,建立以磷脂酰乙醇为生物学标志物的酒精摄入准确评价方法具有重要意义。磷脂酰乙醇的检测技术经历了薄层层析法、气相色谱串联质谱、高效液相色谱法、液相色谱串联质谱法等发展阶段[10-13],分析灵敏度显著提高,但目前检测方法的检测容量仍显不足,能够同时测定的磷脂酰乙醇同系物种类较少。针对上述问题,本研究建立了一种简单、精密的液相色谱串联质谱分析方法,同时测定全血样本中7种磷脂酰乙醇同系物。我们应用所建方法研究了临床饮酒志愿者全血种磷脂酰乙醇含量及分布情况,探索其与肝肾功能相关临床生化指标的关系,为临床酒精摄入相关疾病研究提供客观的参考依据。
材料与方法
1. 检测仪器和试剂:磷脂酰乙醇16:0/18:1(美国Enzo Biochem公司)、磷脂酰乙醇18:0/18:1、磷脂酰乙醇18:0/18:2、磷脂酰乙醇18:1/18:1、磷脂酰乙醇16:0/20:4(美国Echelon Biosicences公司)、磷脂酰乙醇16:0/18:2、磷脂酰乙醇16:0/16:0(美国AvantiPolar Lipid公司),内标物:d5-磷脂酰乙醇16:0/18:1、d5-磷脂酰乙醇16:0/18:2、d5-磷脂酰乙醇18:0/18:1、d5-磷脂酰乙醇18:0/18:2、d5-磷脂酰乙醇16:0/20:4(美国Echelon Biosicences公司)、磷脂酰丙醇(PProP16:0/16:0)、磷脂酰丁醇(Pbut18:1/18:1)(美国Avanti Polar Lipid公司),有机溶剂包括甲醇、异丙醇、乙腈和甲基叔丁基醚(美国Fisher Scientific公司)。乙酸铵购自美国Sigma-Aldrich公司。水为本实验室自制超纯水。LC-MS/MS包括Agilent 1260高效液相色谱仪(美国Agilent公司)和SCIEX QTRAP 5500质谱仪(美国SCIEX公司),WS100-D振荡器(德国Wiggens公司),3-18K离心机(德国Sigma公司)。
2. 检测方法:(1)标准和内标溶液的配制:配制浓度为10、50、100、250、500、1000、2500ng mL-1的7种磷脂酰乙醇混合标准溶液,吸取1ml分装于安瓿瓶中,于-20℃保存。7种内标用异丙醇配制成终浓度为250ng ml-1混合溶液,于-20℃保存。(2)样本制备:吸取25μl标准溶液或全血样品并加入25μl内标,加入600μl甲醇进行蛋白沉淀后,加入1200μL甲基叔丁基醚,随后向混合物中加入600μl水。将混合物震荡10分钟,于4℃离心10分钟。移取800μl上清液,氮气吹干后用300μL流动相进行复溶,随后采用LC-MS/MS进行分析。(3)色谱条件:采用Waters X Bridge C18色谱柱(100×2.1mm,3.5μm)。流动相为A:2.5mmol L-1乙酸铵异丙醇溶液和B:2.5mmol L-1乙酸铵水溶液和乙腈(v:v,50:50),以300μl min-1的流速进行梯度色谱分离,梯度洗脱如下:0-3min,66%A;3-3.4 min,66%A-90%A;3.4-4.8min,90%A;4.8-5min,90%A-66%A;5-6min,66%A。柱温20℃,进样体积5μl。(4)质谱条件:质谱扫描模式采用电喷雾离子源负离子多反应选择离子监测模式,喷雾气、辅助加热气、气帘气和碰撞气均为氮气,分别设置为35psi、80psi、23psi和Medium,喷雾电压为-4500V,离子源温度为600℃。
3.方法学评价和人群样本检测:(1)线性、检测限及定量限:重复测定5次标准溶液,计算各次的线性相关系数。以标准溶液磷脂酰乙醇浓度为X轴,待分析物与内标峰面积的比值为Y轴,分别进行线性回归分析。将待测物与内标峰面积比代入标准曲线方程,计算磷脂酰乙醇浓度。稀释标准品,评估检测限和定量限。(2)加样回收率、准确度与精密度:分别向不饮酒者空白全血样本中加入100和250ng mL-1的标准溶液,测定加入标准溶液前后的全血样本,计算加样回收率及相对标准偏差。加标回收率=(C2-C1)/ C×100%,其中C2为测定加标全血所测浓度,C1为加标前全血样本浓度,C为加标量。每种全血样本处理各制备3个平行管,共测定5批次。(3)基质效应:本实验采取柱后流动灌注法,注射针泵持续注射250ng mL-1标准溶液,色谱进样吸取空白人全血基质样本,观察质谱采集信号变化。(4)实际样本测定:用建立的LC-MS/MS法测定300例饮酒者血样本的磷脂酰乙醇含量,以评价全血磷脂酰乙醇与饮酒量的关系,同时采用不饮酒者全血样本作为空白对照。
结果与讨论
1. 萃取体系的选择:考察了不同溶剂萃取体系提取效果。分别设置纯乙腈、乙腈-异丙醇、异丙醇、甲醇-甲基叔丁基醚-水等不同萃取体系组别,结果如图1所示。与乙腈相比,异丙醇和甲醇-甲基叔丁基醚-水体系均表现出更好的萃取效率。后两者提取效率相当。相比较于异丙醇单相萃取体系,甲醇-甲基叔丁基醚-水体系由于使用两相液液分层萃取原理,可以有效降低基质杂质的干扰,减小基质效应。同时甲基叔丁基醚沸点和粘度远小于异丙醇,便于后续吹干复溶等样本处理操作。
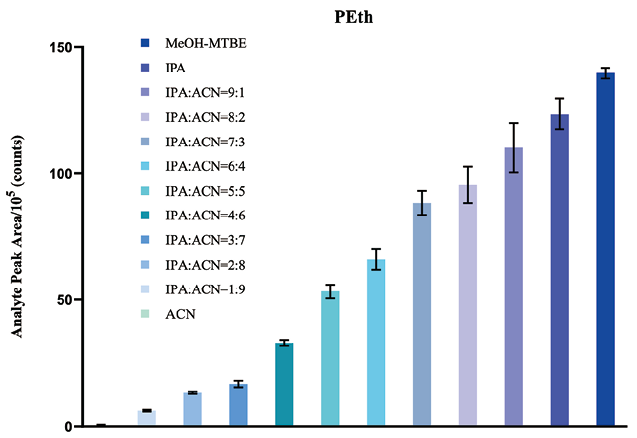
图1. 不同溶剂萃取体系提取效果的比较
2. 色谱条件的考察:向流动相中加入一定浓度的乙酸铵,分别考察了0、2.5、5、7.5、10mmol L-1五个浓度水平对保留时间及峰型的影响。结果如图2显示,以磷脂酰乙醇18:0/18:1、磷脂酰乙醇16:0/20:4、磷脂酰乙醇18:1/18:1为例,对比不同乙酸铵浓度条件下的每种磷脂酰乙醇的信号响应变化情况,当乙酸铵浓度为2.5mmol L-1时,所获得质谱信号响应最佳,故选择流动相中乙酸铵浓度为2.5mmol L-1。本研究选用三根色谱柱进行对比,分别为Thermo HyPURITY C4(150×3mm,5μm),Waters XBridge C8(100×2.1mm,3.5μm),Waters XBridge C18(100×2.1mm,3.5μm)色谱柱。C4和C8色谱柱虽有较短的保留时间,但是各磷脂酰乙醇同系物分离度不足。C18色谱柱与待分析物具有更为充分的相互作用,使峰型更为尖锐,检测信号响应更好,同时采用的流动相条件能够充分保证待分析物洗脱出峰,保留时间相比前两种色谱柱虽略有延长,但在可接受范围内。经对比综合考虑色谱峰型、保留时间、分离度、信号响应等因素,最终选择C18柱。
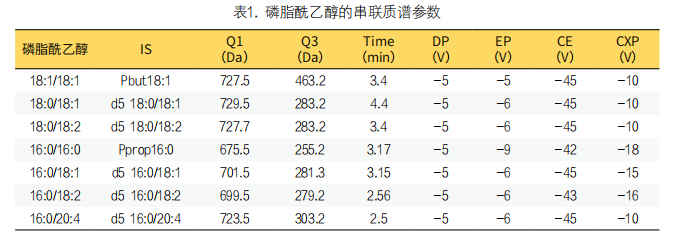
3. 质谱条件优化:质谱条件:采集磷脂酰乙醇和内标的一级及二级扫描质谱图,依据一、二级质谱信息可推断确定磷脂酰乙醇监测母离子为[M-H]-离子,优势碎片离子分别对应为sn-2和sn-1位脂肪酸链残基(如图2所示)。在此基础上,进一步优化各磷脂酰乙醇定量离子通道母离子和子离子、对应内标、去簇电压、入口电压、碰撞电压和出口电压等参数,优化后的质谱条件见表1。
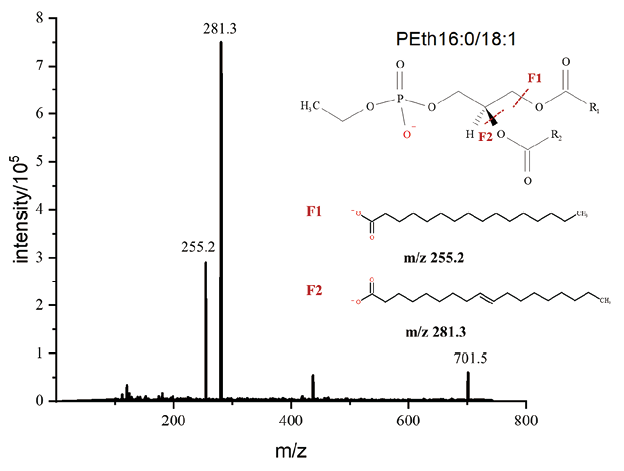
图2. 磷脂酰乙醇16:0/18:1的二级质谱扫描图及结构图
4. 方法学验证:(1) 磷脂酰乙醇的特异性:本实验条件下饮酒者全血样本LC-MS/MS分析结果显示待分析物和内标的保留时间在2.0~5.0min(如图3所示),磷脂酰乙醇出峰时间内没有明显杂质峰出现,基线噪音低,无内源性物质干扰,而空白全血样本在相应位置只出现内标色谱峰,无待测物峰检出,表明不饮酒者体内无磷脂酰乙醇检出,方法特异性较好。
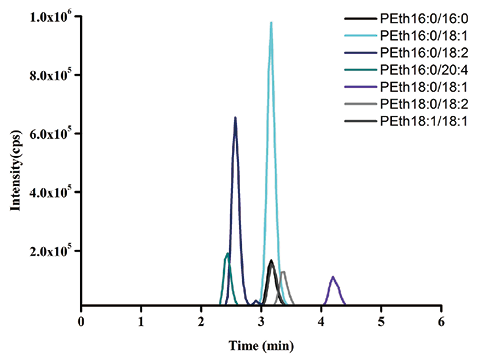
图3. 人血样本7种磷脂酰乙醇的色谱质谱图
(2)线性、检测限和定量限及准确度和精密度:用LC-MS/MS测定浓度为10~5000ng mL-1的标准溶液建立标准曲线,采用内标法定量,5次实验的线性相关系数大于0.9999,线性关系良好。检出限(0.7~2.8ng mL-1)和定量限(2.2~9.4ng mL-1),如下表2所示。通过加标回收试验考察方法的准确度和精密度(n=5),向空白基质血样中分别加入100和250ng mL-1标准品,加标回收率在91.0%~102.2%之间,日内精密度RSD在0.4%~7.4%,日间精密度RSD为1.8%~8.3%之间。结果见表2。
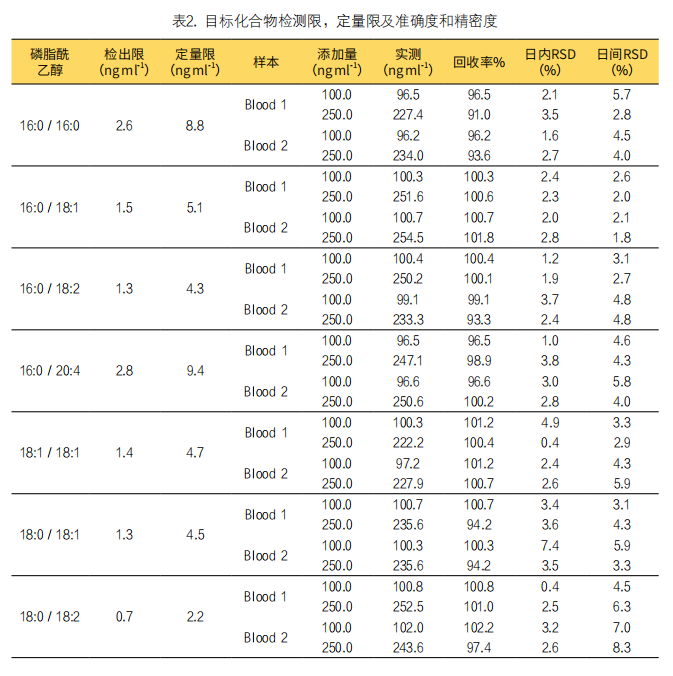
(3)基质效应:本研究还对方法的基质效应进行了考察。分别对经过相同前处理步骤的标准溶液和人血样本中稳定同位素标记内标物的绝对响应进行了比较,未见明显离子抑制或增强。此外,我们还同时采用了柱后流动灌注法进一步对潜在基质效应进行监测,以注射针泵持续注射250ng mL-1标准溶液,色谱进样吸取空白人全血基质样本,观察质谱采集信号变化,结果显示在一针分析运行周期内未观察到质谱信号的明显变化,进一步证明所建方法没有明显基质效应。
5. 检测方法的人群应用:将所建方法应用于实际人群样本酒精摄入状况评估。本研究共测定了300名饮酒者全血样本。结果显示,7种磷脂酰乙醇均在相应工作曲线线性范围内,样品中的总磷脂酰乙醇浓度范围为51.1ng ml-1至2.9μg ml-1,平均为354.4ng ml-1研究发现样本中磷脂酰乙醇16:0/18:1、16:0/18:2是含量占优势地位的两种主要磷脂酰乙醇同系物,平均浓度分别为74.2和48.7ng ml-1,各约占总磷脂酰乙醇29.2%和19.2%(图4)。
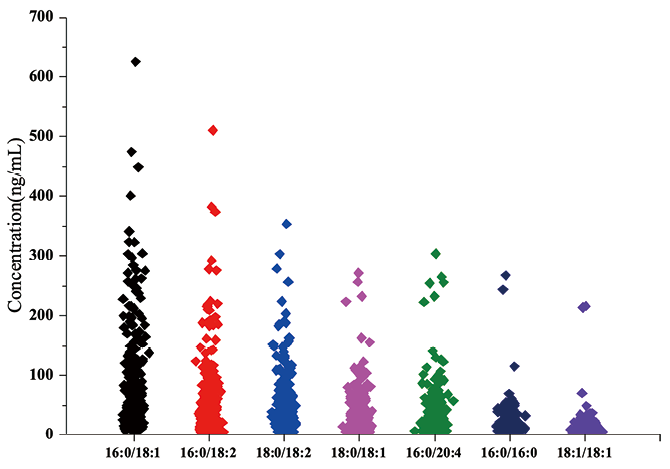
图4. 饮酒者全血样本中7种磷脂酰乙醇水平的分布
结 论
本研究建立了一种基于多反应选择离子监测采集技术的磷脂酰乙醇液相色谱串联质谱分析方法,一次进样可同时实现对7种磷脂酰乙醇同系物的准确测定。该方法样品前处理步骤简单,具有较高的灵敏度、较好的准确性和精密度。所建方法可以用于人群实际样本的测定,能够准确反映磷脂酰乙醇同系物分布和酒精摄入状态,这有望为临床酒精摄入监测及干预效果评估提供新的、更为客观的技术手段。
参考文献
Tasuku O. BMC Public Health, 2021, 21(1).
Johansson K, Johansson L, Pennlert J, et al. Stroke, 2020, 51(7): 2148.
Selim R, Zhou Y, Rupp L B, et al. Clin Transplant, 2022, 36(5): e14595.
Viel G, Boscolo-Berto R, Cecchetto G, et al. Int J Mol Sci, 2012, 13(11): 14788.
Wurst F M, Thon N, Aradottir S, et al. Addict Biol, 2010, 15(1): 88.
Andresen-Streichert H, Muller A, Glahn A, et al. Dtsch Arztebl Int, 2018, 115(18): 309.
Walther L, de Bejczy A, Lof E, et al. Alcohol Clin Exp Res, 2015, 39(11): 2200.
Gnann H, Engelmann C, Skopp G, et al. Anal Bioanal Chem, 2010, 396(7): 2415.
Isaksson A, Walther L, Hansson T, et al. Drug Test Anal, 2011, 3(4): 195.
Alling C, Gustavsson L, Anggård E. FEBS Lett, 1983, 152(1): 24.
Hansson P, Caron M, Johnson G, et al. Alcohol Clin Exp Res, 1997, 21(1): 108.
Yon C, Han J S. Exp Mol Med, 2000, 32(4): 243.
Van Uytfanghe K, Ramirez Fernandez M D M, De Vos A, et al. Talanta, 2021, 223(Pt 1): 121694.