【摘要】感染诊断和抗生素敏感性试验(简称药敏试验)是临床微生物学的重要部分,由于目前在早期检测细菌对抗生素反应方面的标准尚不完善,因此迫切需要改进。日益严重的抗微生物药物耐药性(AMR)在全球范围内严重威胁人类健康,目前的耐药性检测方法是使用表型抗生素敏感性试验(衡量细菌生长受抗生素影响的情况),其分析时间长。因此,需要新的快速检测抗生素耐药性的方法。在这里,我们综述了用于检测细菌抗生素耐药性的方法,包括由生物膜(生物被膜)引起的耐药性以及快速评估AMR方法的发展。
【关键词】微生物;细菌生物膜;抗微生物药物耐药性
目前,全球面临着抗微生物药物耐药性(AMR)的快速蔓延,然而,越来越多的药物对医院和社区获得性感染无效。微生物耐药性的出现是对抗微生物药物在临床实践中广泛使用的自然反应。由多重耐药(MDR)细菌引起的疾病非常严重,通常需要住院治疗。缺乏有效的抗生素治疗既是对所有国家无例外的全球威胁,也是对以某种方式接触病原体的个人的威胁。目前,抵抗细菌抗生素耐药性的方向包括:(1)设计能够有效抑制病原体的新药;(2)寻找减缓耐药性传播的方法,特别是通过减少抗生素的使用;(3)开发“关闭”耐药性的方法。遗憾的是,几乎不可能过渡到合理地使用抗微生物药物,定期向医护人员和患者通报抗生素耐药性及其全球后果可能是遏制其传播的第一步。由于通过阻断细菌耐药性机制来对抗其耐药性的努力是无效的,因此开发新药是当前对抗耐药性的优先事项。抗微生物药物用于预防和治疗人类、动物和植物的感染,通常包括抗生素、抗病毒、抗真菌和抗寄生虫药物。抗生素的过度使用和不当使用导致了MDR菌株的产生。日益增长的抗生素耐药性在世界范围内被视为对国家安全的威胁,世界卫生组织(WHO)将其视为重中之重,WHO《遏制抗微生物药物耐药性全球战略》证明了这一点。联合国的一份报告称抗生素耐药性是对全球健康的“严重威胁”,全球抗生素耐药性的实际程度仍然未知,因此,开发评价细菌对抗菌药物敏感性的方法具有重要意义。本文综述了目前用于检测细菌耐药的方法,包括由生物被膜引起的耐药以及快速评估AMR方法的发展。
一、抗生素和主要耐药途径
抗生素是一大类天然、合成或半合成来源的药物,对细菌或其他单细胞微生物有选择性毒性。主要的抗生素类别有β-内酰胺类(青霉素和头孢菌素类)、氯霉素类、四环素类、大环内酯类、林可酰胺类、壮观霉素、磺胺类、硝基呋喃类、甲氧苄啶类、硝基咪唑类、多粘菌素类、喹诺酮类和大环类药物(安沙霉素、糖肽和氨基糖苷类)。最常用的是氟喹诺酮类和磺胺类药物,它们对革兰阳性和革兰阴性菌的作用具有广谱性。抗生素进入环境的一个主要来源是处理过的废水,因为抗生素不经过代谢转化,它们会通过废水处理系统。土壤受到粪肥、污泥和废水中抗生素的污染,但有些抗生素直接用于农田控制病原体,有时抗生素浓度可能与治疗浓度一样高,甚至更高,这反过来又增加了细菌耐药性。最近抗微生物药物的广泛且往往不受控制地使用导致多重耐药微生物迅速传播。图1显示了抗生素进入环境的主要途径。
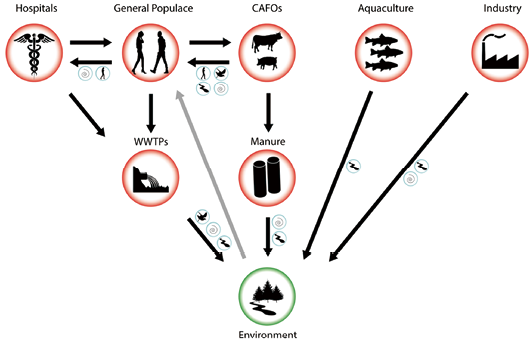
注:CAFOs:集中式动物饲养场;WWTP:污水处理厂
图1. 抗生素进入环境的途径
全世界每年消耗抗生素数十万吨,在美国,抗生素耐药性每年影响200万人,导致至少2.3万人死亡。英国卫生部一个小组发布的一份报告指出,2014-2016年期间,全世界每年约有70万人死于由AMR病原体引起的传染病。根据2019年的数据,美国和欧洲每年累计约有6.8万人死于耐药细菌引起的疾病。如果这一趋势继续下去,并且抗耐药性措施仍然无效,到2050年,这一数字可能会上升到每年1000万人。根据欧洲疾病预防控制中心的数据,欧洲每年约有2.5万人直接死于耐药性感染,然而,坊间证据表明,实际死亡率要高得多,每年可能有50万人。抗生素耐药性也极大地影响了全球经济,仅美国每年就花费约350亿美元用于治疗耐药性感染。重要的是,由于技术和经济问题,抗生素的发现速度在最近几十年有所下降,这导致了所谓的抗生素危机。
二、抗微生物药物耐药性
环境中抗生素浓度的增加可能导致耐药细菌的产生,并可能导致新的耐药决定因素的产生,水生微生物群落是AMR基因水平转移的焦点。此外,环境中持续存在的抗生素耐药基因可能通过水平基因转移被人类细菌病原体募集,给人类健康带来风险。由于公共卫生危机,非医院微生物对AMR日益受到科学界的关注,抗生素耐药基因被认为是新的环境污染物。抗微生物药物会抑制细菌细胞壁的构建、破坏细胞膜的结构和功能、阻断包括RNA和DNA在内的重要生物聚合物的合成。如果抗生素通过破坏细胞壁结构导致细胞死亡,就被称为杀菌药物,抑菌抗生素是那些只抑制细菌生长、干扰蛋白质和核酸合成的抗生素。一些抗菌药对范围较窄的细菌有效,例如糖肽类仅对革兰阳性菌株有活性。其他抗生素,如β-内酰胺类,针对不同细菌种类的共同过程,被归类为广谱抗生素。
进化导致细菌发育出一系列的防御机制来灭活抗生素,这导致了多重耐药(MDR)微生物的出现。细菌对抗生素的耐药性可以是天然的,也可以是后天获得的。天然耐药的特点是细菌体内缺乏适当的抗生素作用靶点、细胞壁渗透性低或抗生素可能被酶灭活,这类具有物种特异性。获得性耐药可能是对暴露于抗生素的细菌进行选择的结果,原因可能是染色体或质粒DNA发生突变,或者是通过质粒或转座子水平转移耐药基因。主要的MDR机制包括:靶向抗微生物药物的修饰、抗微生物药物从细胞中主动消除(外排)和细胞壁通透性受损和抗微生物药物结构和性质的酶降解或修饰。抗生素耐药性可通过不同机制传播,人类细菌病原体也会在人类改变的环境中发生进化变化,从而影响其抗生素耐药性。显然,细菌是通过获得已有的耐药决定基因来抵抗抗生素的作用。新发突变在微生物获得耐药性中发挥了一定作用,但通过转导、转化和结合进行的水平基因转移在抗生素耐药决定因素的传播中起着至关重要的作用。这是通过能够在DNA分子内或之间移动的可移动遗传元件(包括转座子、基因盒/整合子和质粒)的协调作用实现的,这些元素共同构成了耐药基因获得和传播的核心。这一过程不仅包括医院菌株,还包括自然环境中的微生物,非医院抗生素耐药细菌是一种潜在威胁,因为它们可以成为耐药基因的维持和传播的贮藏库。
细菌在抗生素存在的情况下存活的一个机制是位于细菌细胞膜上的专门运输系统。这些外排系统是参与细胞分泌有毒物质的蛋白质复合物,细菌外排系统分为五个家族:ABC转运蛋白家族、主要促进因子超家族(MFS)、多药和有毒化合物排出(MATE)家族、小型多重耐药(SMR)家族和耐药结节分化(RND)家族。临床意义最大的家族是RND家族。这些外排系统在细菌中广泛存在,它们的基因几乎总是存在于染色体上。大肠埃希菌BL21(DE3)的MacA-MacB-TolC外排系统保护细胞免受大环内酯类抗生素的攻击,并参与热稳定肠毒素II的分泌。MacAB外排系统保护鼠伤寒沙门氏菌ATCC 14028细胞免受大环内酯类抗生素的侵害。在肺炎克雷伯菌中,MacAB外排系统保护细胞免受合成四环素--依拉环素(eravacycline)的影响。编码外排系统的基因并不是通过水平转移新获得的,而是核心基因组的一部分。考虑到人类主动使用抗生素的时间还不到一个世纪,可以看出外排系统的功能不仅限于从细胞中清除抗生素。关于外排系统在生物膜形成中的作用的证据来自对鼠伤寒沙门氏菌缺失突变体生物膜形成能力的研究,作者表明,与野生
型菌株相比,外排系统基因acrB、acrD、acrEF、emrAB、macAB、mdf4、mdsABC、mdtABC、mdtK和tolC的缺失会导致生物膜形成减少。几乎每种细菌的基因组都有几种外排系统,参与清除细胞中的同类抗生素。此外,许多外排系统还能清除染料和洗涤剂等非抗生素化合物。例如,鼠伤寒沙门氏菌的基因组中至少有11个功能重叠的外排系统。通过利用其中一个参与大环内酯类抗生素外排的系统—鼠伤寒沙门氏菌MasAb,证明该系统对保护细菌免受氧化应激是必要的。
2017年,WHO公布了一份“优先级病原体”名单,这些病原体的抗生素耐药性要求立即开发新药物。在许多住院患者中,粘质沙雷菌可引起中枢神经系统疾病(脑膜炎)、尿路感染、呼吸系统疾病、心内膜炎和脓毒症。由于抗生素耐药性降低了细菌的药物潜力,因此编制了一份目前最危险的病原体清单,该清单由首字母缩略词ESKAPE命名[屎肠球菌(E)、金黄色葡萄球菌(S)、肺炎克雷伯菌(K)、鲍曼不动杆菌(A)、铜绿假单胞菌(P)和肠杆菌(E)]。重要的是,铜绿假单胞菌是一种机会性人类病原体,也是严重医院感染的病原体,已被列入世卫组织“关键重点”微生物清单,必须使用新的抗微生物药物遏制其传播。此外,最近的研究表明,非致病性假单胞菌菌株尽管毒力低,但可在免疫系统受损的人群中引起菌血症。从感染创面分离出的不同细菌种类显示出对每一类主要抗菌药的一种或多种耐药机制。创面为微生物定植、增殖和感染提供了良好的环境。与伤口感染相关并具有MDR特性的主要细菌病原体包括金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯菌、酿脓链球菌、铜绿假单胞菌、鲍曼不动杆菌、变形杆菌、链球菌和肠球菌。
在此背景下,一个热门领域是开发监测细菌对抗生素敏感性的方法,抗生素耐药监测系统旨在开发短时间内评估细菌敏感性的方法,以便及时为患者提供护理,并预测微生物之间耐药性的传播和新耐药机制的出现。
三、评估细菌AMS的方法
抗生素治疗的主要目的是测定细菌的抗微生物药物敏感性(AMS)。最常用的标准微生物学方法是在牛肉提取物肉汤或固体营养培养基中检测抗生素的最低抑菌浓度(MIC),以评估抗生素对细菌的作用。抗生素抗微生物活性的测定是基于其抑制微生物生长的能力,表现为受试细菌生长抑制区的大小对抗生素浓度的对数依赖性,这种依赖应该是线性的。测定微生物AMS的方法有以下几种,手工操作:在液体营养培养基或营养琼脂中连续稀释、琼脂扩散法(抗生素饱和盘法)和E-试验;自动化系统:VITEK®系统、BD PhoenixTM自动识别和敏感性测试系统、SensititreTM和Micro-scan walk away®;新兴技术:BacterioScanTM FLLS、SmarticlesTM技术、加速PhenoTM系统、LifeScale®系统。MIC的定义是在琼脂或肉汤稀释试验中阻止可见微生物生长的最低抗生素浓度,抗生素敏感结果通过一个特殊的现成表格进行评估,该表格包含耐药、中度耐药和敏感菌株的抑菌圈直径的边界值以及耐药和敏感株的MIC值。
敏感菌株是指在接受一般剂量抗生素治疗的患者血清中检测到的药物浓度可抑制其生长的菌株,中度耐药菌株是指在接受最大剂量药物治疗的患者血清中检测到的药物浓度可抑制其生长的菌株,耐药微生物是指在使用最大剂量时,体内产生的浓度不能抑制其生长的微生物。根据美国临床和实验室标准协会(CLSI)和欧洲药敏试验委员会(EUCAST)的建议,预先确定了每对细菌-抗生素的数据,这些数值为临床医生选择适当的抗菌剂提供了必要的信息。传统的微生物学方法虽然灵敏度高,但非常耗时,传统的AMS检测基本上仅限于观察细胞菌落生长,而这一过程可能持续数天(见图2)。值得注意的是,在等待AMS检测结果期间,患者仍在接受广谱抗生素治疗,这增加了抗生素耐药性的可能性。如果在感染初期就开具抗生素处方,从而减少广谱抗生素的使用,就可以避免这种情况的发生。对于脓毒性休克患者每延迟一小时使用正确的抗生素,其存活几率就会降低7.6%。因此,设计快速分析细菌AMS的方法至关重要。在这个方向上,基于电物理分析的传感系统正在开发中。
1. 基于传感器的细菌AMS检测方法:微生物细胞电物理分析在AMS的快速检测中很有前景,因为它能在短时间内生成代谢活性细胞的信息。例如,Johnson等人使用石英谐振器、非运动大肠杆菌和抗生素(多粘菌素B和氨苄西林)来记录细菌在接触抗生素前后的机械振动,结合抗生素暴露前后的细胞成像以及实验后的菌落形成单位(CFU)计数,结果表明AMS可在7-15 min内检测出来。Guliy等人使用带有横向电场的铌酸锂压电谐振器来评估阿莫西林和多粘菌素对微生物细胞的影响。直接在液相中进行分析。结果表明,当添加抗生素时,负载敏感细胞悬液的谐振器电阻抗的实部和虚部的频率依赖性与负载无抗生素对照细胞悬液的谐振器的频率依赖性有很大不同,分析时间不超过10min。Kaittanis等人的研究表明,氧化铁纳米传感器可用于快速(1)测量多糖(2)评估代谢活性和(3)测定血液中AMS(见图3)。预计这些多糖纳米传感器将用于临床或现场的AMS测定,也可用于药物研发。
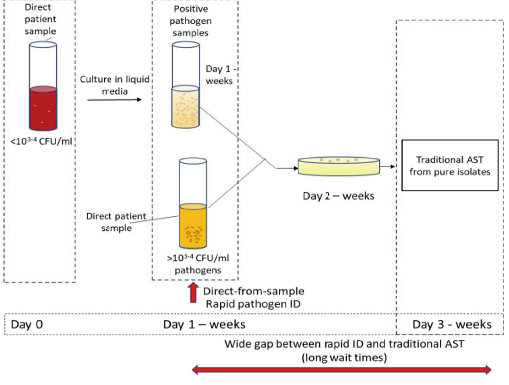
图2. 抗微生物药物敏感性(AMS)试验

图3. 葡聚糖包被的多糖进行AMS测定
纳米机械生物传感器属于微机电系统(MEMSs)的一个分支,可将生物过程转化为可测量的机械运动,例如,纳米机械传感器在检测细菌及其AMS方面具有优势。在传感器表面检测病原体(及其生长和代谢活动),这会导致传感器变形(静态响应)和/或频率共振变化(动态响应,见图4)。将三个组件组合成一个纳米机械装置,可实时检测细菌并测量其AMS(图5 A-E)。含有集成微流体通道的镀金氮化硅微悬臂捕获了细菌,并测量了偏转变化(由于细胞结合引起的表面张力变化,图5 F)和共振频率变化(由于细胞质量,图5 G)。此外,还通过红外辐射激发测量了被捕获细菌的红外光谱,红外辐射引起的悬臂偏转与细胞的红外吸收成正比(图5 H)。通过这种多元分析,可以在原位检测和鉴定细菌菌株,并准确区分受损细胞和未受损细胞。Longo等人发现,通过观察涂有细菌的悬臂在水环境中的静态模式波动,可以测量细菌的新陈代谢。检测依据的是传感器波动(背景噪声)的时间变化,而不是传统的静态偏差或共振频率的变化。Longo等人利用存活的金黄色葡萄球菌研究发现,在氨苄西林和卡那霉素存在的情况下,波动偏差会大大降低,因为抗生素会导致细菌死亡,MIC数据与AMS测定标准方法获得的数据一致。
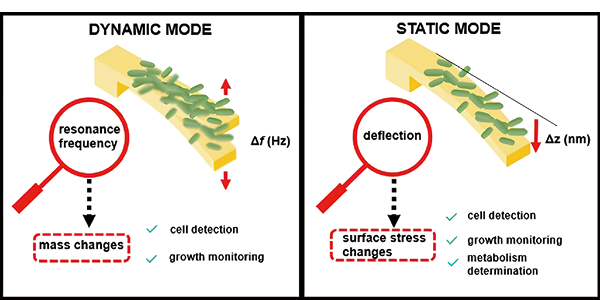
图4. 用于检测细菌并测量其AMS的纳米机械传感器
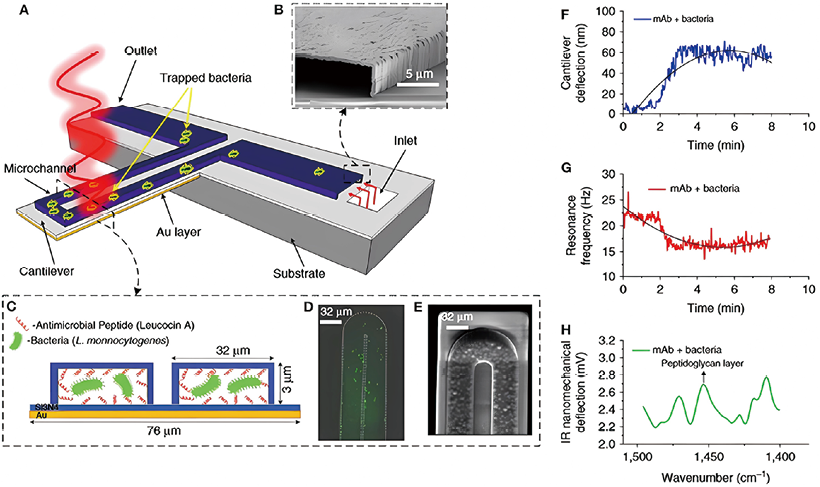
图5. 多模态纳米机械传感器检测细菌
抗生素在许多层面上影响细菌生理,细菌不是简单地补偿直接的细胞缺陷,而是通过改变它们的形态、大分子组成、代谢等来对抗生素做出反应,所有这些过程不可避免地会相互影响,从而产生复杂的反应。细胞表面的损伤伴随着离子和电荷的重新分布,这可以用光电传感器记录下来。一种光学方法被用于测定细菌对氨苄西林和卡那霉素的敏感性,分析时间不超过20min,该方法是通过记录微生物细胞接触抗生素后的光电特性变化来实现的。Jain等提出了一种独特的AMS测定方法,将纸片扩散法与微波辐射相结合,用于非接触、非侵入性的探测和监测。他们的研究描述了使用分裂环微波谐振器来监测不同浓度的红霉素对生长在固体琼脂培养基上的大肠杆菌的影响(图6)。振幅的变化降至低值,表明细菌在高抗生素浓度下生长延迟,该传感器在6h内显示出令人信服的AMS结果,因此,有望在临床环境中推广工作过程自动化。
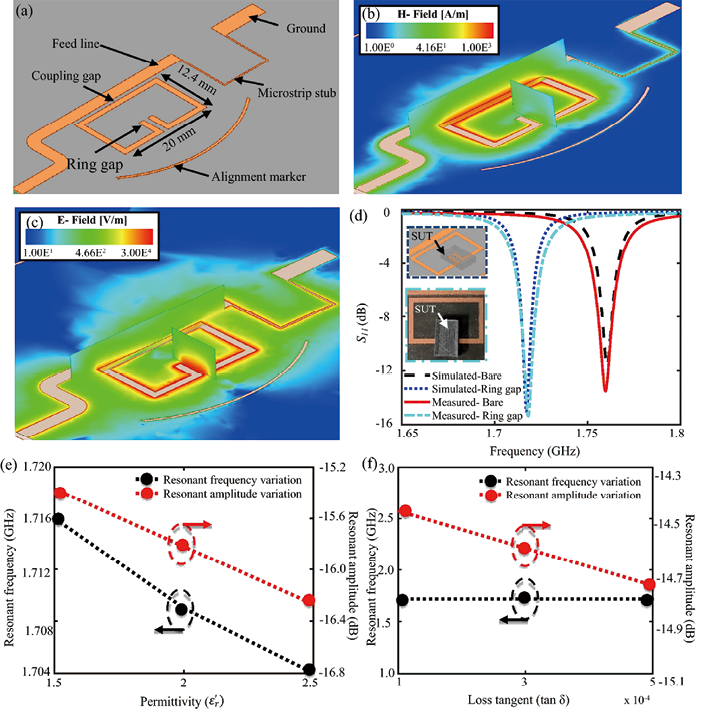
图6. 单端口分裂环谐振器模型
同一作者团队描述了一种微波和微流控生物传感器,用于快速、非接触和无创检测大肠杆菌在不同pH值培养基中的浓度和生长情况,以提高临床微生物学的疗效。微流控通道与微波谐振器之间的薄界面层大大提高了检测灵敏度,通过筛查微波系统共振幅度和频率特性的变化可确定不同pH值溶液中是否存在不同浓度的细菌。与细菌浓度的对数值相比,传感器对细菌浓度的变化几乎立即做出反应,最大灵敏度为3.4 MHz。传感器变量(共振频率和振幅)的变化用来监测抗生素暴露于细菌500min的生长情况(见图7)。
将细菌稀释至所需浓度并引入微波微流体平台,通过矢量网络分析仪(VNA)分析谐振器的电信号,以获得细菌的谐振曲线,Bennett等人描述了一种可在45 min内检测细菌对抗生素的表型耐药性的替代方法,使用激光和检测器系统来检测培养基中穿过激光焦点的单个细菌细胞(图8)。该方法比标准方法更快地检测细菌的生长(耐药)或死亡(敏感),从而提供了简单的AMS读数,该方法已应用于实验室和临床环境,以大肠杆菌为例。
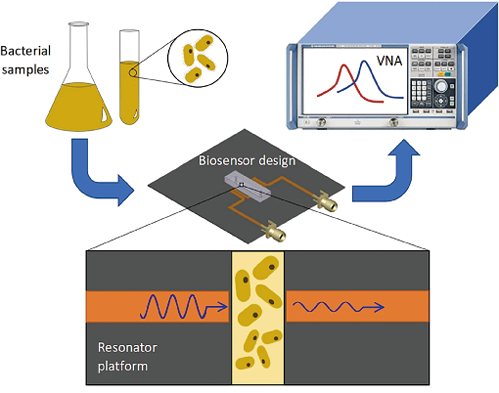
图7. 细菌浓度和增殖的检测
注:(a)将细菌接种到含抗生素的生长培养基中,激光从悬臂表面反射到光电二极管检测器上。溶液中的细菌穿过激光束(在光电二极管信号中观察到峰值),敏感菌株加入抗生素后,从培养基溶液中测量的光电二极管信号会减弱。(b-d)光电二极管信号,(b)无细菌接种物,(c)有细菌溶液,(d)加入抗生素45min后
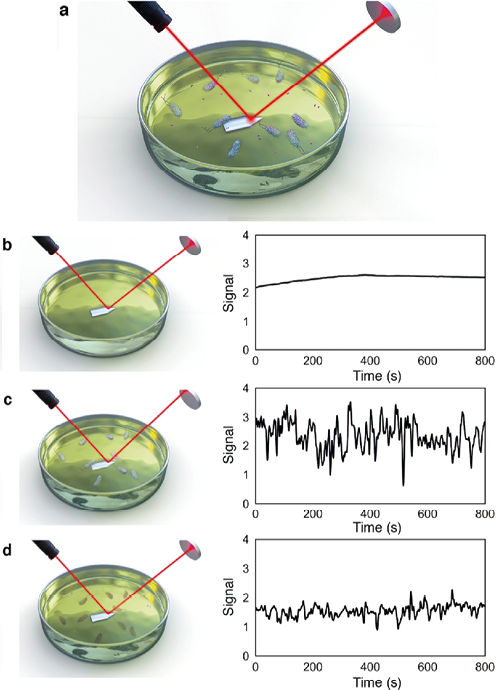
图8. 快速光学AST法的原理
四、细菌生物膜在感染进展中的作用及测定细菌生物膜AMS的方法
微生物细胞对特定抗生素敏感的事实并不能保证其治疗效果。缺乏抗生素疗效通常与细菌生物膜的形成有关,抗生素难以渗透。生物膜相关细菌在许多方面与浮游细菌不同,生物膜的一个典型特性是它们对抗微生物药物的敏感性降低。由于生物膜感染及其治疗问题严重威胁人类健康,因此越来越多的最新研究解决了生物膜的形成和对抗它们的策略。国际疾病控制与预防中心和美国国立卫生研究院(NIH)估计,生物膜与65%的细菌感染和超过80%的慢性感染有关,至少80%的生物膜形成病原体与持续感染有关。最常见的外源性微生物是葡萄球菌和链球菌,据目前了解,地球上大约有40-80%的细菌可以形成生物膜,生物膜可能包含一种或多种细菌。大多数细菌和真菌都能形成生物膜,如铜绿假单胞菌、表皮葡萄球菌、白念珠菌、鲍曼不动杆菌、幽门螺杆菌、金黄色葡萄球菌、李斯特菌、霍乱弧菌和肠球菌。根据欧洲抗微生物耐药监测网络(EARS-Net)协议,受感染控制监测的病原体包括大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、不动杆菌属、金黄色葡萄球菌、肺炎链球菌、粪肠球菌和屎肠球菌。选择这些病原体是因为它们经常引起侵袭性感染,如果产生耐药性,治疗选择可能会受到严重限制,此外,这些病原体还可能在非医院环境和医疗机构中传播。2016年,沙门氏菌属被列为中亚和东欧抗微生物耐药监测(CAESAR)的监测对象。值得注意的是,美国报告的伤口感染中约有80%可能与生物膜有关,在生物膜中生长的细菌对抗生素的耐受性被认为是浮游生物的10-1000倍,生物膜充当物理屏障,降低抗生素、抗体和粒细胞群的渗透率。此外,低剂量抗生素可能会促进生物膜的形成,并可能导致生物膜特异性AMR。
在迄今为止关于AMR全球负担的最大规模、最全面的研究中,一个国际研究团队估计,2019年有120多万人死于耐药感染。在可直接归因于AMR的127万例死亡中[不确定区间(UI),95%;91.1万例-171万例],有92.9万例(73%)是由六种病原体引起的:大肠杆菌、金黄色葡萄球菌、肺炎双球菌、肺炎链球菌、鲍曼不动杆菌和铜绿假单胞菌。在与AMR相关的495万例死亡病例(UI,95%;362万例-657万例)中,有357万例(72%)是由这些病原体造成的。对AMR全球影响的首次全面分析估计,2019年,耐药性本身造成127万人死亡,比艾滋病毒/艾滋病或疟疾的死亡人数还多,其中495万人与AMR感染有关。总之,研究者获得了4.71亿份个人记录,用于通过统计建模估算世界所有地区(包括没有数据的国家)12种主要感染综合征与AMR相关和可归因于AMR的疾病负担。
生物膜研究是现代医学最具挑战性的领域之一,因为传统抗生素敏感性试验的结果不能用于预测生物膜治疗的成功率。
细菌生物膜的AMS
抗生素的MIC通常是用浮游细菌来测定的,所得值与预防、抑制或破坏生物膜所需的浓度不符。治疗生物膜相关感染的一个主要挑战是开发一种合适的标准化方法来测试生物膜AMS。由于现有的抗生素是针对游离(浮游)细菌开发的,因此治疗生物膜相关感染常常会失败。由于浮游细菌和生物膜细菌之间的AMS差异很大,因此引入了其他参数来评估抗生素的疗效,这些参数包括:(a)最低生物膜抑菌浓度(MBIC)、(b)最低生物膜根除浓度(MBEC)、(c)生物膜杀菌浓度(BBC)和(d)生物膜预防浓度(BPC)。一些研究人员将MBEC定义为与对照相比杀死生物膜中99.9%细菌的最低抗菌浓度,其他研究小组认为MBEC与BBC相似,并将其与浮游培养的最低杀菌浓度(MBC)进行比较。抗菌药物对生物膜形成的抑制作用通常用MBIC来评估,即生物膜内活细胞平均数量不随时间增加的最低浓度,相比之下,BPC被定义为初始培养密度下降到生物膜不形成的浓度。有许多实验室方法可用于评估生物膜细菌的AMS,如微量滴定板检测、Calgary生物膜装置(CBD)、底物悬浮反应器和流式细胞系统,这些是体外评价生物膜AMS的常用方法。生物膜MBEC使用试剂盒进行测试,如Assay®(前身为Calgary生物膜装置),在临床应用中使用有几个局限性。尽管如此,不同文献对生物膜MBEC的测定和解读不同,此外,目前尚未有EUCAST、CLSI等官方机构提供生物膜细菌AMS的标准化参数。最后,确定生物膜AMS的方法仅适用于一些临床相关微生物。因此,目前研究工作的重点是设计分析生物膜细菌AMS的测试系统。 基于传感器的方法也正在开发中,例如,Hendolin等人描述了通过测量压电谐振器表面的共振频率来实时监测细菌生物膜状态(包括细胞暴露于抗生素后的状态),然而,这种技术的弱点是检测系统受温度影响,温度的波动也会改变共振频率,从而使分析结果失真。文中描述了一种用于细胞外细菌代谢分析的微流体氧化还原反应纳米场效应晶体管(nanoFET)生物传感器。采用压电石英音叉衰荡系统原位检测环丙沙星对铜绿假单胞菌生物膜的活性。
Yeor-Davidi等人在没有样本预处理的情况下,通过使用纳米传感器和分析高离子强度溶液(如细菌培养基)中的葡萄糖代谢物来监测生物膜的代谢活性(图9),用不同作用机制的抗生素处理生物膜并与未处理的样本进行比较。利用硅纳米线-场效应晶体管器件对抗生素处理过程中的生物膜进行进一步研究,阐明了生物膜中发生的过程。此外,可以使用新的纳米传感器检测消除生物膜的适当治疗方法,以监测使用作用机制不同的抗生素治疗后微生物群落的形成。对于此类抗生素(四环素和氨苄西林),生物膜的反应各不相同。用氨苄西林处理时,初期会减少葡萄糖的吸收,短期处理不会损害生物量到葡萄糖摄取停止的程度,长时间的氨苄西林培养导致生物量部分溶解,因此只消耗了60%的葡萄糖。就四环素而言,短期处理开始时葡萄糖消耗缓慢增加,直到代谢物完全消耗为止;长期培养会破坏生物膜并导致代谢活动发生变化,但不会完全消灭细菌。Blanco-Cabra等人提出了一个微流体平台,该平台带有集成生物膜芯片,用于附着临床来源的细菌,甚至直接来自临床样本。生长的生物膜可通过共聚焦显微镜或电阻抗光谱进行监测,该装置适用于研究混合菌群和测量抗微生物药物对生物膜的影响,不会因操作造成破坏,更好地模拟了临床实际情况。尽管现有的生物膜细菌AMS评估方法种类繁多,但仍需进一步发展。对现代技术的分析表明,这些方法的主要问题在于样本的收集和制备、分析时间以及消除假阳性结果。因此,微生物学和医学需要新的方法来确定细菌的AMS。
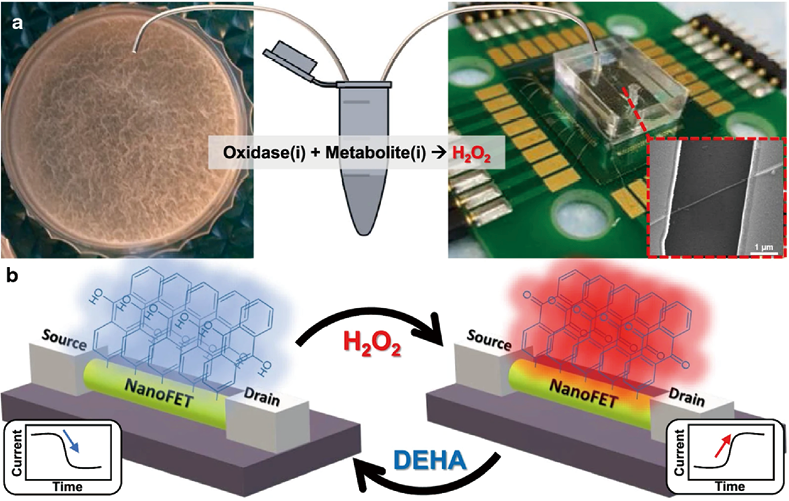
图9. 用于细胞外细菌代谢分析的微流体氧化还原反应纳米FET生物传感器
五、耐药细菌抗争的现状
自2010年以来,世界动物卫生组织、世卫组织和联合国粮食及农业组织通过三方联盟,一直在提高各国对AMR的认识。三方联盟致力于采取措施,确保防治 AMR的国家行动计划包括根据国情和国际承诺,制定和加强对人类和动物抗菌药物的储存、使用和销售的有效监视、监测和监管,这需要采取多部门综合行动,将人类健康、动物健康和环境健康联系起来。为了寻求卫生、农业和动物卫生部门的国家代表的合作并鼓励行为改变,有必要提高对AMR的认识和知识。由于AMR的驱动因素深深植根于人类和动物卫生保健以及粮食和农业系统,因此需要进行改革,要求为国家行动计划中概述的所有活动提供可持续的资金。根据 AMR机构间协调小组的建议,成立了AMR全球指导小组(GSG),以激活全球政治力量,加强抗击AMR的领导力。该小组的任务是在全球范围内与各国政府、机构、民间社会和私营部门合作,以“一个健康”的方式提供指导并倡导优先政策行动,通过确保负责任和可持续地获取和使用抗微生物药物来预防耐药性感染。全球抗微生物药物耐药性行动计划的目标是“尽可能保证长期持续使用安全有效的药物来有效治疗和预防传染病”。
其五大战略目标是:
·通过有效沟通、教育和培训提高对抗微生物药物耐药性的认识和了解;
·通过监测和研究强化知识和证据基础;
·通过有效的环境卫生、卫生和感染预防措施降低感染发病率;
·优化人类和动物卫生工作中抗微生物药物的使用;
·确保在应对AMR方面进行可持续投资。
六、结束语
抗生素被广泛用于预防和治疗细菌感染。在兽医领域,抗生素也常用于促进动物生长。未转化的抗生素残留物被人类和动物排泄到环境中,从而对环境造成不利影响。药物废物对陆地和水生生态系统的污染无处不在,环境中的抗生素浓度有时超过其治疗水平。环境中存在的医用抗生素主要是由于废水处理厂排放的处理废水,因为常规废水处理不能有效地去除这些化合物。抗生素进入水生环境也是其在水产养殖中的使用结果。全世界都观察到用于治疗常见细菌感染(如尿路感染、脓毒症、性传播疾病和某些形式的腹泻)的抗生素具有高度耐药性,这表明目前的有效抗生素库已经耗尽。例如,在向WHO全球抗微生物药物耐药性和使用监测系统(GLASS)报告数据的国家中,对环丙沙星(一种常用于治疗尿路感染的抗生素)的耐药率在8.4%-92.9%之间,对肺炎克雷伯菌的耐药率在4.1%-79.4%之间。目前有三种主要情况威胁着细菌感染的治疗:对抗微生物药物的耐药性不断增加、慢性生物膜相关感染数量的增加和缺乏适当的感染治疗方法。
在人类面临的各种全球性挑战中,最令人担忧的是细菌AMR的不断增长以及设计加速评估方法的必要性。分析细菌AMS的传统测试系统被认为是“金标准”,因为它们相当成熟可靠,而且已经使用了几十年。但这些方法有一些重要的缺点:它们是基于记录细菌代谢的变化,并且需要纯临床分离株。由于这些缺点,它们非常耗时。由于目前使用的抗生素种类繁多,要评估分离菌株对实际使用的所有抗微生物药物的AMS并不合理。选择何种抗生素进行分析取决于分离的微生物、感染的病灶和类型、是否存在并发症等。结果的解读基于最常用的CLSI和EUCAST标准。选择抗生素的一个决定性点是细菌的准确鉴定,尽管许多关于抗菌药物敏感性评价的优秀综述已经发表,但研究仍在继续开发和验证新的方法(包括筛选方法)用于AMS的分析。近几十年来,已开发出几种测定AMS的创新方法,包括MALDI-TOF、流式细胞术和等温微量热法。应单独提及AMS分析的分子遗传学和组学方法,这一领域未来研究的主要焦点将是这些方法的标准化,以及同时检测微生物对各类抗微生物药物的敏感性。
总之,大多数研究正转向设计快速AMS评估系统,这种系统不需要纯临床分离株,这些新系统既可直接使用,也可通过简单的样本预处理直接测定AMS。生物传感器技术是开发快速AMS评估方法的一个前景广阔的领域,遗憾的是,在AMS分析中使用传感器技术仍然没有统一的标准。不过,在许多研究小组的努力下,已经开发出有可能与传统方法竞争的系统。但就传感器在AMS分析中的应用而言,这些系统的验证和对临床分离株的重复测试是一个限制因素。开发快速检测细菌,尤其是细菌生物膜AMS的方法是亟待进一步研究的领域。应特别关注以传感器为基础的分析系统,这种系统无需对样品进行预处理即可进行研究,并能在短时间内获得结果。
编译节选自:《Front. Biosci. (Elite Ed)》2023; 15(3): 19