4月27日,从国家医疗器械技术审评中心获悉,依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。
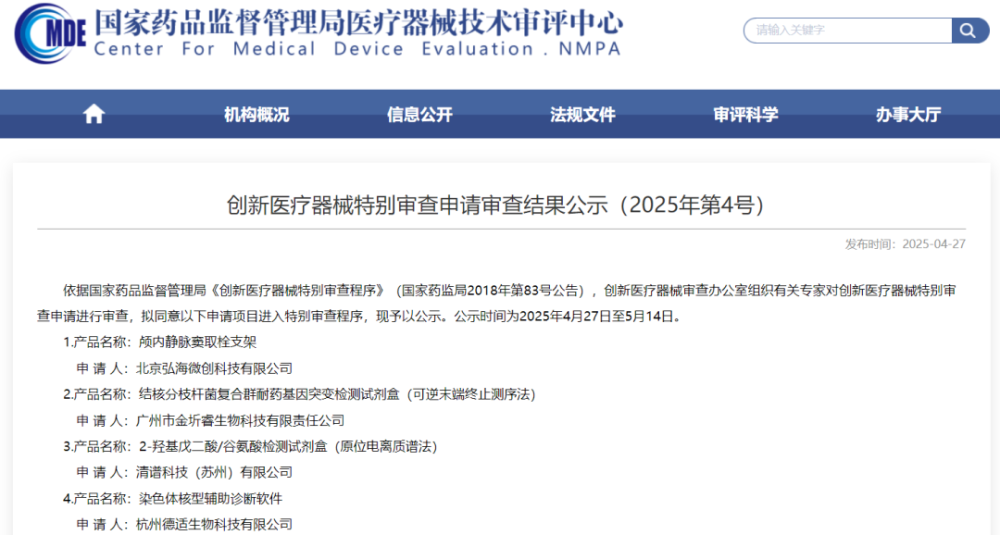
其中3款IVD产品进入创新医疗器械特别审查程序,现予以公示。公示时间为2025年4月27日至5月14日。
详情如下:
1、广州市金圻睿生物科技有限责任公司
产品名称:结核分枝杆菌复合群耐药基因突变检测试剂盒(可逆末端终止测序法)2、清谱科技(苏州)有限公司产品名称:2-羟基戊二酸/谷氨酸检测试剂盒(原位电离质谱法)3、杭州德适生物科技有限公司产品名称:染色体核型辅助诊断软件
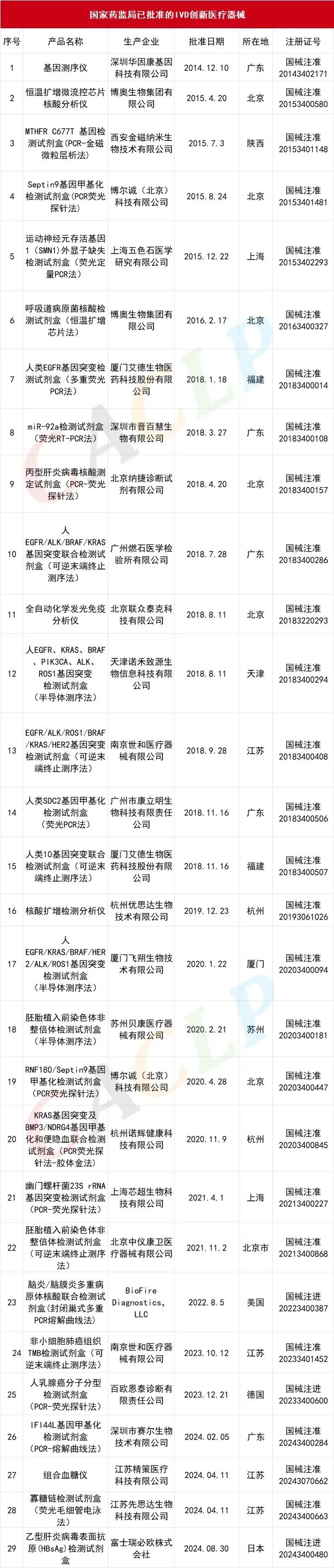
经CACLP统计,截至目前国家药监局共批准293款创新医疗器械上市,其中IVD创新体外诊断产品29个。
声明:本微信号注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
图文来源 | 国家药品监督管理局、CACLP、体外诊断价值圈
排版 | jinbao
审校 | 金宝









