文章刊载于《临床实验室》杂志2023年4月刊“临床微生物检验”专题-「标准与规范」版块 页码p98-p103 (其它全媒体阅览方式请见文末)
作者:苏建荣 胡继红
单位:北京,首都医科大学附属北京友谊医院检验科(苏建荣);北京,国家卫生健康委临床检验中心(胡继红) 注:苏建荣,胡继红为共同通讯作者
2023年CLSI M100于今年3月初发布,新版与CLSI M100 Ed 32 版比较,CLSI M100 Ed 33版部分内容发生了变化,本文就与微生物实验室日常工作相关内容的重要变化,汇总以下5个方面进行解读。

抗菌药物耐药的威胁是全球最大的公共卫生问题之一,许多国际机构都已意识到该问题。抗菌药物耐药也是最主要的死亡原因,在资源有限的环境中抗菌药物耐药负担最重。2019年,全球有127万例死亡和抗菌药物耐药直接相关;495万人因耐药菌感染病逝。因此,抗菌药物耐药性需要全球采取行动:改善抗菌药物的全球监测,推广新的快速诊断方法,以优化抗菌药物的使用。抗菌药物监测是指协调的干预措施通过选择最佳抗菌药物方案,包括剂量,治疗时间和给药途径来改善和衡量抗菌药物的正确使用。实验室支持抗菌药物监测项目包括新的诊断方法的实施,报告评论,药敏试验(AST)报告和策略,AST屏蔽规则,AST分级关联报告。CLSI M100的Table 1是抗菌药物选择性检测和报告的指南,2023 CLSI M100更新后,Table1发生了很多变化:(1)包括了新的抗菌药物 (比如:在肠杆菌目Table1A的Tier3分级中增加了新药普拉左米星Plazomicin);(2)对抗菌素药物在特定“分级(Tiers)”中的排列进行了重新评估,并增加了几个新的脚注,更新后的分级与之前CLSI M100 ED32的药物分组对应的药物有显著不同;(3)Table 1由原来的3个微生物表格变为16个微生物/微生物组;(4)药物分组由3个变为4级(Tiers),新增了一个级别;未改变“尿液“,“其他“和“I“组;(5)扩展了选择性和分级关联报告定义,选择性和分级关联报告应用扩展性建议并增加了案例说明;(6)进一步强调实验室必须与抗菌药物管理部门合作并遵循机构的指南。1.CLSI M100 Table1相关定义及表格分类:CLSI M100 Ed33 将Table 1进行了全面解释,Table 1列举了微生物实验室检测和报告应该考虑的抗菌药物,其中强调选择最合适的抗菌药物进行检测和报告,最好是由每个实验室与抗菌药物管理小组和其他相关部门协商共同做出决定,Table 1表格的建议内容概括如下:包括美国FDA批准的临床使用的药物;适用于美国医学实验室但其他机构也同样适用;这些建议基于任何单个药物的检测和报告都必须考虑患者个体因素(如年龄、身体部位)或微生物特性因素(如抗菌药物敏感性整体情况);这些建议在用于制定实验室的检测和报告方案时,需要与机构指南一起考虑。更新后的Table1覆盖16个微生物,涉及微生物实验室检测和报告应考虑的抗菌药物说明,与CLSI M100 Ed32不同的是,Table 1A的肠杆菌目不包括沙门菌/志贺菌,而在Table 1B有专门针对沙门菌/志贺菌的检测和报告应考虑的药物描述。2.CLSI M100 Ed33更新内容-药物分级:CLSI M100 Ed 33中“分级(Tier)“使用的定义及指南是此次更新的重要内容,新的分级意义在于:①能考虑更多的药物进行检测和报告;②鼓励分级关联报告;③强调实验室应提供做初级和分级关联报告;④相比新的分级关联药物,如新的ß-内酰胺类复方药物,将真正需要的抗菌药物单独分级,如粘菌素。检测/报告分级(Test/Report Tiers)和之前的检测/报告分组在定义描述也有区别,修改前后对应内容变化见表1.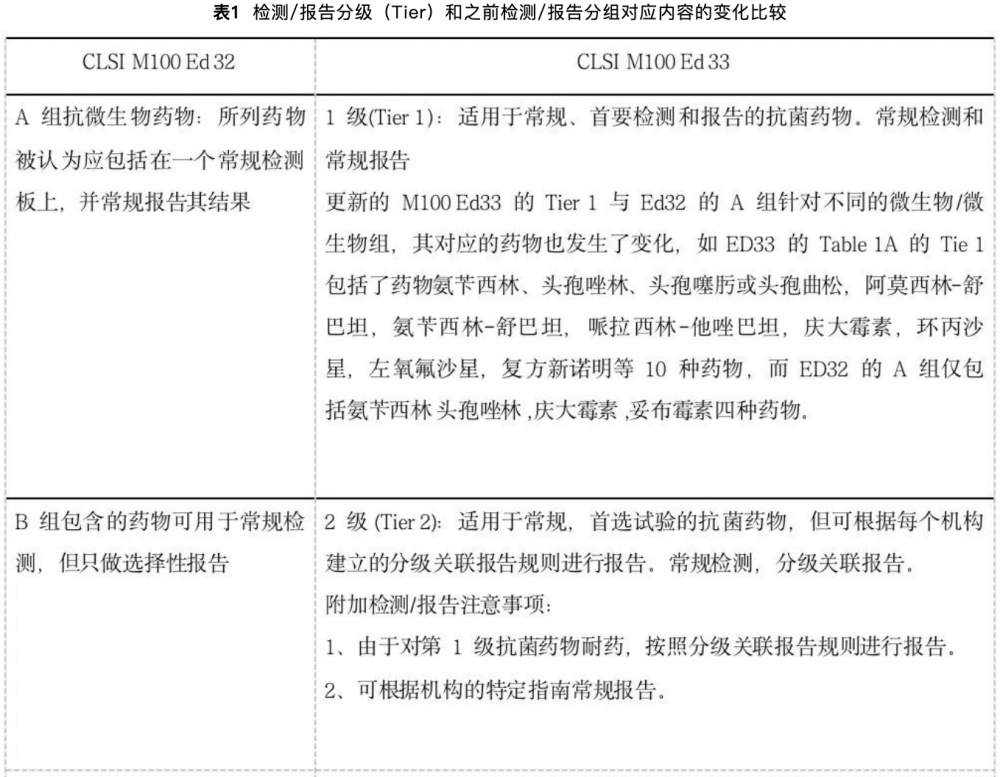


3.Ed 33新增了选择性/分级关联报告相关内容定义及举例:每个实验室应考虑与抗菌药物管理团队和其他相关机构协商制定选择性和/或分级关联报告规则。进行选择性和分级关联报告,以鼓励合理使用抗菌药物。表1A至1P中的药物定位可用于指导选择性和/或分级关联报告规则的制定。
(1)选择性报告:选择性报告基于与抗菌药物敏感性试验(AST)结果无关的定义标准(例如,微生物鉴定、身体部位、临床环境或患者人口统计学) 报告特定抗菌药物的结果。例如,呋喃妥因只针对尿液分离株报告,因为其只对治疗非复杂的尿路感染(UTIs)有效。从呼吸道分离的病原菌不报告达托霉素,因为其与肺表面活性剂相互作用,导致抑菌活性受抑制。第一代和第二代头孢菌素由于对治疗沙门菌感染患者无效,因此不报告。
(2)分级关联报告:分级关联报告包括根据分离菌株的整体药物敏感性情况报告特定药物的结果。仅当分离菌株对初级或窄谱药物(如1级)耐药时,次级或广谱药物(如 2级或3级)的结果才报告。例如A(见图1),如果肺炎克雷伯菌分离株对头孢曲松耐药,可报告头孢吡肟。然而,对头孢曲松敏感肺炎克雷伯菌分离菌株,可能不报告头孢吡肟。对广谱抗菌药物(如2级)的“耐药”结果应始终报告,即使该微生物检测对窄谱抗菌药物(如1级)“敏感”。

抗菌药物分级关联规则可在相同的Tier或者不同的Tier之间创建。抗菌药物列举在Table 1A至1P之间相同一行的不同Tier之间可用作创建分级关联报告规则的指南。
例如B(见图2),如果肺炎克雷伯菌分离菌株对头孢曲松耐药(Tier 1),则可以启动头孢吡肟和/或碳青霉烯类(Tier 2)的分级关联报告。如果肺炎克雷伯菌对头孢曲松,头孢吡肟和碳青霉烯类耐药,则需要考虑头孢地尔,头孢他啶-阿维巴坦,亚胺培南-瑞来巴坦(imipenem-relebactam) 和/或美罗培南-法硼巴坦(meropenem-vaborbactam) (Tier 3)(见图3)。每个实验室应制定一项方案来检测分离菌株的附加药物,这些分离菌株已被确认在他们的常规检测板上对所有药物具有耐药性。该方案应该包括实验室内部的附加药物检测或将分离菌株发送给参考实验室。4.CLSI M100 Ed33 Table 1A-肠杆菌目细菌变更内容:(1)参照M100附录B对特殊菌种的固有耐药分布图。如果检测了固有耐药的特定抗菌药物/微生物组合,则抗菌药物/微生物组合的结果应报告耐药。可考虑增加关于未检测药物的固有耐药的评论。(2)弗氏柠檬酸杆菌复合体、阴沟肠杆菌复合体、蜂房哈夫尼菌、克雷伯菌(原产气肠杆菌)、摩根摩根菌、普罗维登菌、粘质沙雷菌和小肠结肠炎耶尔森菌可能对头孢曲松、头孢噻肟,头孢他啶、头孢洛林敏感,但由于诱导型AmpC β-内酰胺酶的去阻遏表达,这些药物可能在治疗开始后几天内对这些种属无效。治疗期间AmpC解抑制的风险在弗氏枸橼酸杆菌复合体、阴沟肠杆菌复合体和产气克雷伯菌达到中等至高等,而在摩根摩根菌、普罗维登菌和粘质沙雷菌中似乎较低。因此,最初敏感的分离株可能会产生耐药性。如果临床需要,可对随后的分离菌株进行药物敏感性试验。Ed33关于肠杆菌目AmpC的描述与IDSA关于AmpC β-内酰胺酶肠杆菌目细菌治疗推荐一致,传达了在含有AmpC基因菌种中对广谱头孢类药物耐药发展的可能性。3)头孢吡肟应被认为是对弗氏柠檬酸杆菌复合群、阴沟肠杆菌复合群,蜂房哈夫尼菌,产气克雷伯杆菌,摩根摩根菌,普罗维登菌属,粘质沙雷菌和小肠结肠炎耶尔森菌检测和/或报告的1级(Tier1)药物。1.氨基糖苷类药物折点变更:新的PK-PD数据表明现有的折点不合适;氨基糖苷类抗菌药物的常用剂量方案与用于建立原始折点的剂量方案有很大差异。肠杆菌目细菌的庆大霉素,妥布霉素,阿米卡星三个药物的折点发生了变更。铜绿假单胞菌的庆大霉素折点删除,阿米卡星和妥布霉素折点发生了变更。(1)为什么铜绿假单胞菌对庆大霉素“R”? ①PK-PD 数据证实:达到1个log杀菌效果,MIC ≤0.5 µg/ml;达到抑菌效果,MIC ≤ 1.0 µg/ml;(2)庆大霉素流行病学界值 ECV ≤8 µg/ml:绝大多数野生型菌株的MIC高于可达到的安全上限值;(2)为什么阿米卡星对铜绿假单胞菌折点只适用于“尿液”? 原因包括:ECV (8 µg/ml) 高于1-log 杀菌效果PK-PD (2 µg/ml); 阿米卡星可在尿液中浓缩;抑菌终点有可能用于治疗尿路感染;大多数临床数据显示氨基糖苷类抗菌药物单药治疗对UTI(+/-菌血症)有效。(3)铜绿假单胞菌哌拉西林-他唑巴坦发生变更,为什么变更铜绿假单胞菌哌拉西林-他唑巴坦“中介”折点? ① PK-PD&临床数据显示:使用哌拉西林-他唑巴坦治疗MIC为 32-64µg/mL的铜绿假单胞菌引起的感染成功可能性很低。② 2022年 “I”的范围为32-64 µg/mL ,意味着增加暴露(如延长输注策略)可用于治疗MIC值为32-64µg/mL的分离株。③ 头孢地尔。增加了新的评论(适用于肠杆菌目,铜绿假单胞菌,不动杆菌和嗜麦芽窄食单胞菌):用纸片扩散法和肉汤微量稀释法检测头孢地尔结果的准确性和可重复性明显受到铁浓度和接种剂制备的影响,并可能因纸片和培养基制造商而异。根据观察到的变异类型,可能出现假耐药或假敏感的结果。建议检测后续的分离株。建议与处方者和抗菌素管理成员讨论潜在的不准确性。关于ESBL的检测目的更新为其结果可用于指导流行病学监测,治疗管理和感染防控。同时强调在报告ESBL时必须考虑表型和基因型检测方法的局限性。对于肠杆菌目菌和铜绿假单胞菌碳青霉烯酶的检测,检测目的更新与ESBL相同,而且删除了“目前不推荐常规开展此试验”的描述。关于这两个耐药机制的内容更新与IDSA推荐是一致的产AmpC ß-内酰胺酶的肠杆菌目菌:参考Table 1A-肠杆菌目细菌调整内容这部分描述。直接血培养肠杆菌目细菌抑菌圈直径折点和之前的抑菌圈直径折点有所增加,在ED33的基础上增加了以下药物不同孵育时间的折点:增加了美罗培南和环丙沙星分别孵育8-10 h和16-18h后KB法的折点;同时还增加了氨苄西林孵育8-10 h后KB法的折点。直接血培养铜绿假单胞菌增加了美罗培南孵育8-10 h后KB法的折点。1.推荐肺炎克雷伯菌ATCC®700703作为以下药物的QC菌株:头孢他啶-阿维巴坦;头孢洛扎-他唑巴坦。2.Ed33增加了铜绿假单胞菌ATCC27853对头孢曲松(Ceftriaxone),大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、大肠埃希菌NCTC13486和大肠埃希菌ATCC BAA-3170对黏菌素,粪肠球菌ATCCC51299对多种抗菌剂MIC质控结果异常的的问题处理说明。说明粘菌素的结果受到试剂和/或检测材料的制备和处理的显著影响。并修订了铜绿假单胞菌ATCC27853对羧苄西林(Carbenicillin)/肺炎链球菌ATCC49619对多种抗菌剂的MIC质控异常问题处理说明。3.新增评论“每2周从冷冻或冻干的培养液中准备新的传代培养物“,以防止菌株失去活力。受影响的质控菌参考如下:铜绿假单胞菌ATCC®27853 - 羧苄青霉素;铜绿假单胞菌ATCC®27853 - 头孢曲松;肺炎链球菌 ATCC® 49619 - 所有药物(用于制备接种物的平板应孵育18-20小时);粪肠球菌 ATCC® 51299 - 所有药物“C®49226的庆大霉素KB法质控范围有变更”。当前,我国医疗质量安全专项行动中“提高抗菌药物使用前病原学送检率”的目标,旨在遏制耐药、提高抗菌药物使用的科学性和规范性,有利于人民健康。我国绝大多数临床微生物实验室都使用自动或半自动药敏分析仪检测药敏,由专家系统经仪器自动判定后给出药敏结果,通过连接LIS系统发放报告。对于今年CLSI M100 Ed 33重点更新的初级和分级关联报告方式,建议各微生物实验室根据我国抗菌药物管理政策,以及各医疗机构临床、检验和药事委员会等相关管理部门的用药规则,结合CLSI推荐的分级关联报告建议,通过改进LIS系统来实现各级医疗机构自身的用药规则及指南,最终目的是提高对感染性疾病目标治疗的准确性和遏制细菌耐药。








