端粒检测技术在衰老及衰老相关疾病中的应用

副研究员。日本东京大学理学博士,深圳华大生命科学研究院,精准健康研究所衰老研究中心任副研究员。先后从事学习与记忆可塑性,miRNA调控机制,营养健康信号通路,AD及神经退行性疾病等相关研究。先后在国内外期刊发表文章十余篇,其中以第一作者发表5篇。发明专利1项。主持国家自然科学青年基金1项,参与中国科学院学科前沿领域项目1项,国家科技合作计划项目1项。
摘要 关键词
一 端粒的结构与功能介绍
20世纪上半叶,Muller和McClintock分别通过对果蝇[1]和玉米[2]的研究认识到了端粒的存在。Muller H. 指出在染色体的末端需要一个特殊的结构来保证其完整性,并首先创造了“端粒(telomere)”一词。2009年,Blackburn、Greider和 Szostak三人因发现端粒和端粒酶保护染色体的机制而被授予诺贝尔生理学或医学奖。
在大量开创性研究的基础上,目前我们对于端粒已经有了较为深入的认知。端粒是一种在染色体末端存在的核蛋白结构,具有维持基因组稳定性的功能[3]。在哺乳动物中,端粒的核心是由高度保守的DNA重复序列(TTAGGG)构成,这些重复序列组成一种环状结构,称为T环,并与Shelterin复合物(特殊的蛋白复合体)相结合[4-6],从而维持端粒结构稳定(图1)[6-8]。
端粒的主要作用可以归纳为以下两点:
(1)保护染色体的末端免受不适当的DNA修复机制的影响;
(2)阻止了由于DNA复制不完整而导致染色体末端附近基因的降解[3]。
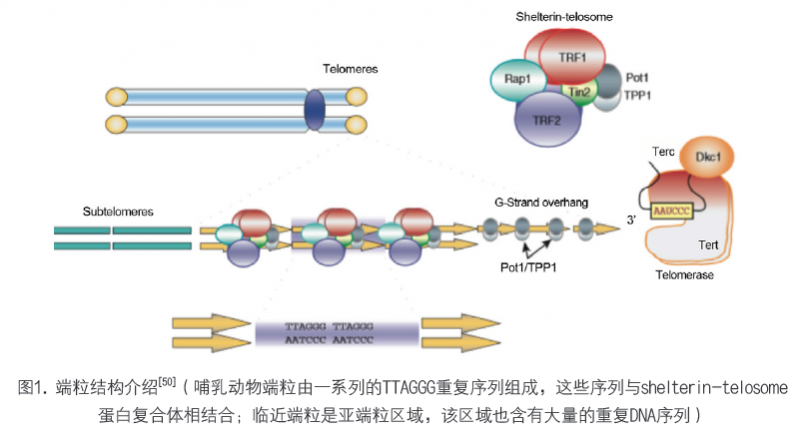
二 端粒与衰老
Hayflick在20世纪60年代认识到了体细胞的自我复制能力是有极限的[9]。然而,端粒缩短与体外传代数和复制能力之间的关联90年代才得到普遍证实[10,11]。现在,众所周知,端粒损耗是与正常细胞衰老相关的细胞内在事件之一[12]。当端粒长度变得非常短时,Shelterin复合物的能力就会丧失,Shelterin复合物失去对DNA损伤反应途径的抑制作用,细胞周期离开正常的细胞周期,从G1期进入G0期[13],之后细胞会进入衰老或者凋亡。值得注意的是,细胞最终会进入无法继续分离的命运,然而决定细胞衰老还是凋亡的确切机制尚不清楚[14]。
衰老细胞积累的结果是双重的:首先,衰老导致特定组织中具有有丝分裂活性的细胞数量减少,限制了组织器官生长和修复的潜力;其次,它们的积累导致蛋白酶、生长因子和炎性细胞因子的释放,并作用于非衰老的邻近细胞。尽管免疫系统会清除衰老的细胞,然而随着免疫系统的老化,其清除衰老细胞的能力也将显著降低[14,15]。因此,研究人员认为端粒损耗导致衰老细胞的积累驱动了组织和生物体衰老的过程。
三 端粒与衰老相关疾病
端粒参与了细胞水平的衰老机制,诸多研究表明,端粒损耗和功能障碍是导致动脉粥样硬化、阿尔兹海默病等衰老相关疾病的重要原因之一。
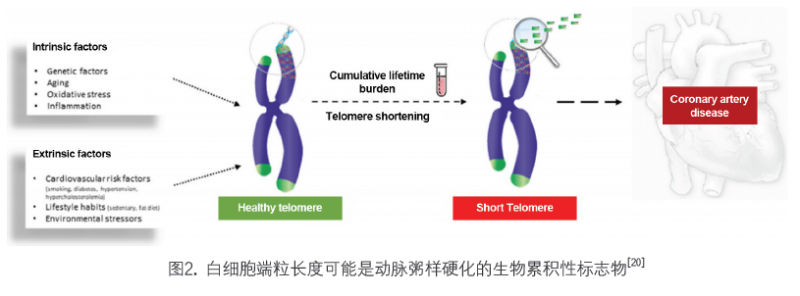
1. 端粒与动脉粥样硬化:端粒缩短是引起动脉粥样硬化的重要因子之一[16]。虽然目前临床研究还没有证据表明端粒缩短与动脉粥样硬化的临床前诊断有直接关联关系,然而近十年来的大量科学研究表明,白细胞端粒缩短与动脉粥样硬化的临床诊断指标相关联,如与颈动脉内中膜厚度相关联[17]。不仅如此,白细胞端粒缩短还与动脉粥样硬化的高致病因子相关联[18]。白细胞端粒缩短很可能在整合了遗传学,氧化应激,环境压力和其他心血管疾病风险因子之后,成为动脉粥样硬化疾病发生发展的生物标志物(图2)[19,20]。
2. 端粒与阿尔兹海默病:在身体的大部分组织中,端粒损耗以恒定的速度发生,然而在大脑细胞中,端粒损耗程度具有多样性的特点。体外实验表明,纤维母细胞,小型胶质细胞,星形胶质细胞中的端粒损耗速度受繁殖率影响[21]。有研究表明,阿尔兹海默病人白细胞端粒长度与海马细胞端粒长度有显著差异[22],虽然阿尔兹海默病人海马细胞也存在一定程度的端粒损耗[23]。阿尔兹海默症血浆中T细胞的端粒较正常人相比有明显变短[24]。然而,端粒动态变化和稳定性在阿尔兹海默病的发生中起的作用还不清楚[25]。
3. 端粒与骨髓衰竭症:骨髓衰竭综合征如再生障碍性贫血,骨髓增生异常综合征反映了造血功能下降,在老年人中比较常见。有研究表明,该类疾病患者体内的端粒有了明显的缩短和端粒酶的失效[26]。DKC1,hTERC或nTERT突变都会导致端粒酶活性缺失,从而不能维持端粒长度或端粒长度不能延长,最终导致端粒缩短[27],同时这些基因突变导致的端粒缩短也会引起肺部纤维化。可见,维持端粒长度功能失效可能会影响一些组织的细胞更新,如骨髓,皮肤,肺部,肠等。
4. 端粒与早衰:端粒在早衰症中或直接或间接的发挥着作用。早衰中因DNA修复缺陷导致细胞死亡增加,从而细胞更新速度加快而间接导致端粒缩短,也有可能是通过直接影响端粒DNA导致端粒变短。研究发现早年衰老症候群(HGPS)是由laminA基因的点突变引起[28,29]。LaminA缺陷导致脱发,颅面骨畸形,憔悴和皱纹,心血管功能缺陷,最终导致脑中风或心脏病发作。有研究表明,该疾病患者表达突变laminA的细胞存在DNA损伤修复缺陷,端粒在其中发挥的作用有待进一步探讨[30]。早衰相关疾病范可尼贫血和共济失调毛细血管扩张是常染色体隐性性状遗传疾病,疾病相关基因影响DNA损伤修复通路,有典型的端粒缩短速度变快的现象[31-34],同时出现端粒复制和修复异常。
5. 端粒与癌症:端粒生物学与肿瘤形成的关系源于Shay等[35]的发现,端粒酶表达可能作为人类癌症的标记:90%的肿瘤样本中都可以检测到端粒酶的活性表达。研究表明李美法尼症候群体内的端粒长度较普通人短,对该症候群的后代进行端粒检测可以监测癌症的发生[36]。肿瘤的发生与c-Myc表达水平上调相关,c-Myc结合到hTERT基因启动子从而调控hTERT的转录,而hTERT的表达与端粒相关[37]。
四 端粒检测相关的技术
1.端粒长度检测技术:端粒已经被证明具有作为生物标志物的潜力,然而潜力变为现实取决于有效和可靠的技术来量化端粒长度。因此,了解端粒长度相关的检测技术对于比较不同研究团队发表的结果以及为未来的研究设计实验很有必要。
(1)TRF技术:TRF(Terminal Restriction Fragmentation)分析是最早用来测量端粒长度的技术。因此,TCR技术的分析结果通常被作为金标准。该技术使用一种频繁切割限制性内切酶的混合物彻底消化基因组DNA,然后利用琼脂糖凝胶电泳,从所有染色体中分离出完整的端粒,通过Southern blot或凝胶内杂交,使用端粒DNA特异性探针来显示端粒片段。最后,端粒的不同长度作为涂片呈现,并进行评估[38-40]。值得注意的是,在这项技术中,提取的基因组DNA的完整性至关重要。DNA降解并被分解成较小的片段,可能导致端粒长度的检测产生误差。DNA降解可能有许多不同的原因,包括但不限于DNA的反复冻融,在室温下长时间保存,以及由于纯化不当而存在残留的核酸酶。因此,在处理和提取基因组DNA时,应采取预防措施,以防止其降解。
(2)基于RCR的技术:2002年,Cawthon等人报道了利用qPCR技术检测端粒长度的方法[41]。端粒长度通过比较端粒扩增产物(T)与单拷贝基因(S)的数量来量化,然后计算T/S比值,得到一个与平均端粒长度相关的值。另一种基于qPCR技术的检测方法是由O‘Callaghan和Fenech[42]开发的,他们将其描述为绝对端粒长度(absolute telomere length,aTL)qPCR法。与TRF技术相同,基于PCR的端粒长度检测技术也需要高质量的DNA。不过与TRF技术不同的是,基于PCR的技术需要的样品量更低,成本也更便宜。
( 3 ) 定量荧光原位杂交:定量荧光原位杂交(Quantitative fluorescence in situ hybridization,Q-FISH)[43]是一种利用荧光探针直接标记端粒的技术。与TRF技术和基于PCR的技术不同,定量荧光原位杂交技术的底物是细胞而不是PCR,可以在显微镜下直接看到端粒并进行长度测量。
2. 端粒酶活性检测技术:端粒酶是一种核糖核蛋白复合物,由端粒酶逆转录酶(TERT)催化亚基组成,通过复制端粒酶RNA组分合成新的端粒重复序列[44-46]。因此,对端粒酶的活性检测对端粒相关的研究具有重大的意义。
( 1 ) 端粒重复扩增法:端粒重复扩增法(telomere repeat amplification protocol,TRAP)是Kim等人在1994年开发出的端粒酶活性检测技术[47],这一方法可从仅含有少数癌细胞的组织中检测端粒酶活性。该技术以合成的非端粒序列为底物,然后用样品中存在的端粒酶拉长底物,然后用PCR扩增延伸产物。在传统TRAP技术的基础上,目前已经发展出了毛细管电泳-TRAP、Q-TRAP、TRAP-酶联免疫吸附法和TRAP-银染法等技术。
(2)化学发光检测技术:尽管实验室层面已然广泛使用TRAP及其衍生技术进行端粒酶检测,不过近年来已经成功地开发出了一些更高通量的发光检测技术。Kha等人采用临床应用的化学发光检测技术对端粒酶活性进行了检测[48]。作者表示在次优条件下他们的系统可以检测到大约37500个端粒酶阳性细胞。
(3)微阵列检测技术:Cristofari等人在2007年开发出了名为Telospot的微阵列检测技术能够测定端粒酶活性并筛选端粒酶活性抑制剂[49]。该技术通过在细胞中过度表达端粒酶组分,产生足够数量的端粒酶,引物和dNTPs被端粒酶扩展,得到的延伸产物被转移到带有斑点阵列的尼龙膜上,并与放射性标记的端粒探针杂交。杂交后,样品膜被荧光粉成像仪扫描,总检测到的放射性与端粒酶活性成正比。
3. 端粒修复(延长)技术:在细胞中,保持端粒长度,确保端粒延长和复制能力的主要机制有以下两种:(1)端粒酶的作用;(2)同源重组介导的端粒替代延长(alternative lengthening of telomeres,ALT)。因此端粒修复(延长)技术具有理论的可行性,然而目前大量的研究都停留在实验室水平。
(1)胚胎干细胞延长端粒:有研究发现小鼠胚胎干细胞在体外增殖时允许它们的端粒进一步延长而超过这个物种的正常端粒长度,从而形成超长端粒的胚胎干细胞[50,51]。这些具有超长端粒的胚胎干细胞可以聚合成桑椹胚,从而获得嵌合体小鼠,这些嵌合体小鼠也由具有比正常情形下更长端粒的细胞组成。嵌合体小鼠表现出较少的代谢老化和较长的寿命,并且未显示出任何病理异常。
(2)端粒酶过表达技术:Li等人证实通过转染外源的端粒酶mRNA,在一系列其他条件的辅助下,可以成功延长细胞的端粒长度,并且逆转细胞的衰老状态[46]。Ramunas等也通过瞬时表达一种修饰后的mRNA,使人类端粒延长多达1000个核苷酸。
(3)生活方式干预技术:生活方式干预技术是目前具有实践价值的端粒延长方法。Diman等研究人员发现耐力训练可以促进端粒的转录,证实了锻炼可以延缓衰老这一观点[52]。Ornish等人也在一项研究中声称,通过积极的生活方式干预,早期前列腺癌男性患者相对端粒长度显著增加[53]。美国护士健康研究(NHS)中心对5000多名33-55岁美国女性的研究发现,良好的饮食和健康的生活方式与较长的白细胞端粒长度正相关[54]。研究者对具体的干预方式进行了研究,结果表明,社会心理压力和财政负担造成的心理压力会导致细胞内端粒缩短,具体的干预方式需要集中到建立强大的社交网络,心理支持资源,保持健康的行为等[55]。总之,保持健康的生活方式,是研究人员目前发现的能够轻微自然延长端粒的方法。
五 展望
从1938年到现在已经有近百年的时间,我们对于端粒的了解逐步深入。现有的研究表明,端粒损耗与细胞衰老、衰老过程和许多疾病的发病机制有关。然而必须注意的是,关联并不意味着因果关系,我们需要更明确的证据,才能推进端粒相关技术在医疗健康领域的应用。此外,端粒的长度具有很高的个体差异,这表明除了时间年龄外还有其他的关键影响因素,需要我们进一步的探索。因此,在未来,研究工作应采用精心设计、稳健和可重复的方法,以进一步了解协调端粒、衰老和疾病过程之间关系的复杂机制是如何相互作用的。
注:本文来源于《临床实验室》2020年第7期“老年医学与检验”专题



