生化大咖和您聊聊K值
聊聊K值(IFCC推荐法ALT的检测)
IFCC推荐法
测定ALT的原理
IFCC推荐法测定ALT活性是采用速率法,其酶偶联反应为:L-丙氨酸与α-酮戊二酸在ALT催化下生成丙酮酸和L-谷氨酸,丙酮酸和还原型辅酶Ⅰ在LDH催化下生成L-乳酸和辅酶Ⅰ。上述偶联反应中,NADH的氧化速率与标本中ALT酶活性呈正比,在340nm波长处监测吸光度下降速率,可计算ALT的活性单位。
水定标?
请问您实验室ALT是水定标么?(YP体系用水定标,是对体系有信心的表现?如何进行K值校准?还是一直就是这么水定标?)
这里定标(或者说校准)这个词改为水空白,是不是更合适?
酶活性浓度的单位
国际单位(IU) :在特定的条件下,每分钟转化1mmol底物的酶量为一个国际单位。以IU表示,1IU=1mmol.min-1。由于没指定温度、各家实验室不是上述的特定条件,所以不建议临床实验室用IU,而应该用:U。
摩尔吸光系数法
用连续监测法进行酶活性测定时,不需做标准管或标准曲线,根据摩尔吸光系数很容易进行酶活性浓度的计算。
摩尔吸光系数的定义:在特定条件下,一定波长的光,光径为1cm时,通过所含吸光物质的浓度为1mol/l时的吸光度。
用连续监测法进行酶活性测定时,根据摩尔吸光系数可以进行酶活性浓度的计算。检测到线性期内的每分钟吸光度变化即△A/min,其酶活性计算公式即为
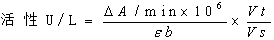
ALT的检测非常简单:线性期、 △A/min;
关键就是K值定准
系数K
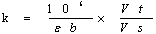
ε:摩尔吸光系数(L·mol⁻¹·cm⁻¹);
b:比色杯光径(cm);
Vt:反应体系体积(ml);
Vs:样品量(ml);
106:将mol换算成umol。
建立了酶的测定方法后,其ε、Vt和Vs均为定值,不同分析仪中b不同,但自动化分析仪一般都自动换算为1cm,因此K值为一个定值。
K值越大越好?
减少了稀释的机会
K值就是一斜率 :酶活性就是K乘以△A啊。
调整K值的办法是什么?
改变K值最方便的途径就是改变标本稀释度,稀释倍数愈大,K值愈大(线性范围越大)。
线性范围越大就一定好么?
牺牲了精密度(稳定性)
所以不建议更改试剂说明书中样本和试剂的比例。
三种K值
指示物的摩尔吸光系数,本实验即εNADH会受很多因素影响,所以有理论K值、实测K值和校准K值之分。
(1)理论K值:根据公式K=1/ε×1/b×Vt/Vs×106,依据理论摩尔吸光系数(如εNADH=6.22×103)计算所得。
(2)实测K值:根据NADH实测摩尔吸光系数计算ALT的K值,即实测K值。
(3)校准K值:通过具有溯源性的酶校准物直接校准得到的K值。
1
理论K值:根据公式K=1/ε×1/b×Vt/Vs×106,依据理论摩尔吸光系数(如εNADH=6.22×103)计算所得。
NADH的理论摩尔吸光系数(340nm)是6.22×103,是用严格校准波长及光径后窄半波宽的高级紫外分光光度计,手工方法测定的。
ε对特定物质而言,在温度、波长及溶剂条件一定的情况下是一个定值,但在一些外界条件(波长、温度、pH值等)影响下也会有所变化。况且理论εNADH是在特定单波长下获得的,我们实际酶检测时为了消除干扰,常使用双波长分析,则不能再用此值。
虽然IFCC已推出血清酶活性测定的推荐方法及试剂配方,但由于分析光学系统和波长、谱带以及测定过程等方面存在差异,以及不同厂家试剂间底物浓度、缓冲液组成、pH、辅酶纯度及浓度等方面也存在差异,导致以理论K值计算出酶活性结果缺乏可比性。
随着时间的推移、仪器老化,同一台仪器、同一套检测系统内的K值也往往会发生变化。所以理论K值只能供用户求实测K值时参考,不能直接用于酶活性浓度的计算。
理论K值:根据理论摩尔吸光系数(NADH=6.22×103),依据下列公式来计算获得。
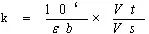
比如建立了以下ALT测定方法:血清量50ul,底物液为1ml,比色杯光径为1cm,则理论K=1.05×106/(6.22×103×0.05×1)=3376。
一般不能直接使用,仅作为计算实测K值或校准K值时参考。
2
实测K值:根据NADH实测摩尔吸光系数计算ALT的K值,即实测K值。
NADH(340nm)的实测ε可用葡萄糖己糖激酶法实测,紫外法测定葡萄糖的反应系统(如HK法)可产生与葡萄糖等摩尔的NADH,用已知浓度的葡萄糖校准液测得相应的吸光度,计算实测ε值。本实验需要有质量可靠的校准品与试剂盒,还要求仪器有良好的精密度。
一般实测εNADH>6600或<6000为不合格。
实测K值:根据NADH的实测ε值计算所得。
可用葡萄糖(HK法)实测NADH的摩尔吸光系数。测已知浓度的葡萄糖校准液,按公式ε=△A×Vt/Vs×1/b×1/C×1000,计算NADH的摩尔吸光系数。
ε:摩尔吸光系数;△A:As-Ab;Vt:反应总体积ml;Vs:样本体积ml;b:比色杯光径cm;C:葡萄糖校准液浓度。为提高加样的准确性,将样品与试剂的比例调整为1:20,样品15ul,试剂300ul,样品稀释液5ul,37℃340nm比色,反应6min,确保反应完全。
3
校准K值:通过具有溯源性的酶校准物直接校准得到的K值。
IFCC提出酶活性的检测必须使用完整的检测系统,依靠定值校准血清实现溯源,使各实验室检测结果具有广泛可比性。
具有溯源性的酶校准品能对试剂、仪器及测定全过程进行校准,可消除不同检测系统和同一检测系统本身固有的系统误差的影响,实现酶测定结果准确性的传递,使检测结果具有较强的可比性。
使用公认的酶校准物对K值进行校准,是国际上目前酶测定标准化的新途径,使用酶校准物的优点:除具有实测ε值换算出K值所具有的一切优点外;还可以促进方法间的一致性和增加常规酶方法的可靠性,可使不同实验室之间的测定结果相对统一。
校准K值:通过校准物直接校准得到的K值,实现溯源,使各实验室检测结果具有可比性。
校准K值=(C2-C1)/(A2-B),其中C2为校准血清浓度;C1为三蒸水浓度,取值为0;A2为校准血清吸光度,B为本地吸光度值。
ALT有两种校准办法
现在可以回答了,ALT有两种校准办法:
1. 根据NADH实测摩尔吸光系数计算ALT的K值,即实测K值。(葡萄糖己糖激酶法实测)
2. 通过具有溯源性的酶校准物直接校准得到的K值。
一般每半年进行一次酶活性的校准,但日常工作中遇到下列情况时,必须进行校准:
①试剂盒改变厂家,或者更换了批号;
②仪器性能改变,如进行一次大的预防性维护或者换了重要部件;
③质控反映出异常的趋势或偏转,或者超出实验室规定的接受限,采取一般纠正措施后,不能识别和纠正问题时。
校准K值与实测K值之间也存在一定的差距,即使指示物和仪器相同,其差异可能由试剂及校准品造成的(溯源性问题)。
下面了解一下NADH
ALT的定量实际上就是检测NADH的减少
下面了解一下NADH
NADH,还原性辅酶I,学名还原型烟酰胺腺嘌呤二核苷酸,是很多生物体内化学反应中的递氢体。NADH呈还原态,其氧化形式为烟酰胺腺嘌呤二核苷酸(NAD+,氧化态),NAD+在脱氢酶的作用下接受氢离子,形成NADH。NADH在260nm和340nm有两处吸收峰,而NAD+在340nm无吸收峰,基于这种340nm的吸收峰的增加(形成NADH)和衰减(形成NAD+)可以在该波长检测多种酶的活性。
NADH会受很多因素影响
比如PH(可以实验观察)
观察NADH 在不同pH环境下的稳定性
(1)调配好的试剂用NaOH或HCl滴定成pH值6.5;7.0;7.5;8;8.5,9.0;9.5的不同pH值环境。
(2)每天分别于分光光度计读取340nm处OD值
(3)计算吸光度变化速率
(4)求出NADH下降最慢的pH值,即NADH稳定性较好的PH值。
一般pH>8,Tris缓冲液有利于NADH的稳定。但酶促反应受环境pH的影响极为显著,每个酶都有最适pH。所以ALT试剂盒除了考虑NADH的稳定性之外还需考虑ALT的最适pH。一般ALT试剂盒的最终pH为7.15±0.05。



