鼻咽癌标志物、环状RNA、癌症新疗法等最新前沿动态
我国首个基于全基因组测序技术的食源性疾病分子溯源网络建成并投入使用
食源性疾病是全球范围内重要的食品安全问题,早期发现和查明病因是防控食源性疾病的重要保证。随着新一代基因组测序技术的发展,基于全基因组测序(WGS)的分子分型技术在食源性疾病聚集性病例识别和暴发溯源调查中已显示出极大的应用价值和发展潜力,逐渐成为国际研究热点,欧美相关国家已相继开展研究和布局。在国家重点研发计划“食品安全关键技术研发”重点专项的支持下,以国家食源性疾病分子溯源网络(TraNet)为基础,首次建成了基于WGS分型技术的新型食源性疾病分子溯源网络,是我国首个实现国家、省、市三级实际应用的分子溯源网络。
WGS技术的推广和使用需要解决庞大基因组数据的传输、储存、快速计算和精准比对,需要成熟易用的生物信息学分析流程和标准化解释系统。针对上述问题,研究团队搭建了我国首个全基因组数据计算云引擎,将标准化的WGS数据分析流程转移到云端,大大降低了WGS数据分析、运算及使用门槛。开发了基于阿里云OSS的WGS三级架构WGS原始测序数据交付中心,实现了原始数据的实时、快速上报及安全传输。在此基础上,建立了基于WGS原始及拼接后数据的全基因组特征基因图谱识别算法,通过以上两种分析方式的相互校正,显著提高了全基因组特征基因分析的准确性,同时建立了分辨力高、重复性好的全基因组多位点序列分型(wgMLST)和核心基因组多位点序列分型(cgMLST)标准化方法,结合流行病学信息,构建了溯源分析知识库,实现了不同实验室间WGS数据的快速分析、比对与共享。研究团队还进一步研究并整合NCBI、CARD、ResFinder、VFDB等公共数据库中的特征基因数据,开发了常见食源性致病菌毒力因子、耐药基因、血清分子分型等自动化分析功能模块,有助于各级实验室开展食源性微生物遗传与变异特征、致病和耐药机制及菌株进化等方面的基础研究。目前网络已经在泰国肠炎沙门氏菌暴发病例的跨省溯源、冷冻饮品中单核细胞增生李斯特氏菌的跨省追踪等事件调查中得到成功应用。网络的建成和运行,为我国食源性疾病暴发的快速调查和精准溯源提供了技术支撑。
我国科学家通过智能大数据平台发现鼻咽癌动态风险评估分子标志物
我国是鼻咽癌第一大国,全球近一半的鼻咽癌发生在中国。由于鼻咽癌发病部位隐蔽,70%以上患者在就诊时已经是中晚期,治疗效果较差,五年生存率不到80%。利用合适的分子标记物指导危险分层,精准提高患者疗效,一直是全世界学者研究的重点。其中,血浆EB病毒(Epstein-Barr virus,EBV)DNA是鼻咽坏死肿瘤细胞释放入血的一种循环DNA,可通过聚合酶链式反应(PCR)技术准确检测,目前广泛应用于鼻咽癌的筛查、危险分层及随访。
2019年9月,中山大学附属肿瘤医院孙颖教授团队在国际知名杂志Nature子刊Nature Communications上发表论文“Liquid Biopsy Tracking During Sequential Chemo-Radiotherapy Identifies Distinct Prognostic Phenotypes in Nasopharyngeal Carcinoma”,首次提出治疗中EBV DNA分子标志物可用于实时评估患者对治疗的敏感性、动态预后风险预测,并提出四个EBV DNA反应亚型,为指导临床医生治疗决策提供了重要依据,也为患者实时了解抗肿瘤治疗的反应性和失败风险提供了经济、无创、便捷的液体活检手段。
该研究利用国际上数据规模最大、数据维度最广、数据组织有序的鼻咽癌真实世界大数据平台和数据库,在实时更新的医疗大数据云平台上,使用经过自然语言处理和机器学习算法提取的真实世界证据,运用了关键诊疗事件时间轴、监督学习等数据挖掘方法,获得了鼻咽癌预后风险评估研究的重要进展。借助智能医疗大数据平台,医学模式逐步从循证医学驱动转为数据驱动,克服临床试验有适应症限制的缺陷,从而推动高质量“真实世界”科学研究。
我国科学家揭示环状RNA在预测II/III期结肠癌患者复发风险预测中的重要作用
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤,发病率占胃肠道肿瘤的第3位。约60%患者初次诊断时已发展为局部晚期(II/III期),即使手术顺利切除后仍有20-30%的复发风险。因此,对II/III期结肠癌患者的精确风险分层是术后治疗策略的关键所在。目前的分期方法在预测II/III期结肠癌患者的复发风险方面有一定的局限。环状RNA(circRNA)是一种新型的非编码RNA,伴随高通量测序技术的发展和进步,越来越多的环状RNA被证实参与多种生物学功能,影响肿瘤的发生发展。同时,由于其特殊的封闭环状结构,不易被核酸外切酶降解,具有成为肿瘤患者生存相关标记物的潜能。
2019年9月2日,中山大学附属肿瘤医院徐瑞华团队在EMBO Molecular Medicine杂志上发表了题为“A Circrna Signature Predicts Postoperative Recurrence in Stage II/III Colon Cancer”的研究工作,该研究揭示了环状RNA在预测II/III期结肠癌患者复发风险预测中的重要作用,为结肠癌术后的精准治疗提供了更好的治疗策略。
该研究团队采用高通量转录组测序技术与LASSO筛选框架的机器学习方法相结合。通过比较20例(复发和未复发各10例)II/III期结肠癌组织标本,分析并鉴定出差异表达的100个环状RNA,并应用qRT-PCR方法在96例(复发和未复发各48例)验证出22个显著高表达的环状RNA。该团队进一步结合列线图(Nomogram)数据挖掘方法,利用大样本的II/III期结肠癌患者队列(训练集,249例;内部验证集,122例;外部验证集,180例),最终构建出一组基于4个环状RNA(hsa_circ_0122319、hsa_circ_0008039、hsa_circ_0079480和hsa_circ_0087391)的分子指标模型(cirScore)。该分子指标模型预测II/III期结肠癌复发风险的准确性显著高于传统的临床病理分期。研究首次揭示了一组由环状RNA组成的分子指标在中期结肠癌复发风险预测中的重要作用,同时开创了基于机器学习的结肠癌分子标记物筛选新方法,为结肠癌的精准诊疗提供了新的思路和新的方法。
我国科学家发现肝纤维化检测和治疗靶标
2019年8月29日,南方医科大学丁彦青及周伟杰共同在 Cell 在线发表题为:LECT2, a Ligand for Tie1, Plays a Crucial Role in Liver Fibrogenesis 的研究论文,该研究将LECT2鉴定为孤儿受体Tie1的功能性配体,并为LECT2 / Tie1信号在血管生成/血窦毛细血管化和肝纤维化中的潜在作用提供了有价值的见解。临床相关性,血清LECT2水平可以作为肝纤维化的潜在诊断标志物,并且靶向LECT2/Tie1信号传导途径可以为治疗这种肝脏疾病提供新的途径。
慢性肝病(CLD)患者最常出现反复肝损伤、肝纤维化等生理变化。肝纤维化最常见的致病条件包括慢性病毒性肝炎、酒精性肝病、非酒精性脂肪性肝炎(NASH)和自身免疫性肝炎。如果没有有效的干预,肝纤维化会导致肝硬化,这是全球最常见的死亡原因之一。
具有免疫球蛋白样和表皮生长因子同源性(Tie)家族的受体酪氨酸激酶,包括Tie1和Tie2,于1992年首次报道。以前的研究表明,Tie1和Tie2及其相互作用通过调节血管生成在人类疾病的发病机制中发挥重要作用。Tie1本身主要是血管生成的孤儿受体,但已被证明可以结合并调节Tie2的活性,因此在正常血管的发育和功能中发挥重要作用。Tie1缺乏导致由于严重的水肿,出血和微血管完整性丧失所致的脉管系统发育受损,进而出现中晚期妊娠胚胎致死率。
白细胞衍生的趋化因子2(LECT2)是一种16kDa的分泌蛋白,最初被鉴定为中性粒细胞的趋化因子,可刺激软骨细胞和成骨细胞的生长。最近,越来越多的证据表明LECT2参与许多病理状况,如败血症,糖尿病,系统性淀粉样变性,肝癌发生,非酒精性脂肪肝病(NAFLD)等。然而,LECT2在肝纤维化发展中的作用及其潜在机制仍然很不清楚。
体内研究表明,LECT2过表达抑制门静脉血管生成,促进血窦毛细血管化,并促进纤维化,而这些变化在Lect2敲出小鼠中被逆转。腺相关病毒载体血清型9(AAV9)-LECT2小发夹RNA(shRNA)处理显著减弱纤维化。LECT2的上调与晚期人肝纤维化分期相关。
本研究提出靶向LECT2/Tie1信号传导可能代表肝纤维化的潜在治疗靶标,并且血清LECT2水平可能是筛选和诊断肝纤维化的潜在生物标志物。
我国科学家发表晚期黏膜黑色素瘤一线治疗新方案
8月12日,北京大学肿瘤医院郭军教授团队在国际知名医学期刊J Clin Oncol 上发表了题为“Axitinib in Combination With Toripalimab, a Humanized Immunoglobulin G4 Monoclonal Antibody Against Programmed Cell Death-1, in Patients With Metastatic Mucosal Melanoma: AnOpen-Label Phase IB Trial”的文章,发表了一项免疫疗法联合抗血管生成靶向药物的晚期黏膜黑色素瘤一线治疗新方案。
恶性黑色素瘤是一种来源于上皮组织的恶性肿瘤,其中,恶性黏膜黑色素瘤(Mucosal melanoma,MM)的预后较差,且东方人群的发病率明显高于西方人群,具有显著的地区差异性。在我国,黏膜黑色素瘤占所有恶性黑色素瘤的22.6%,且近年来发病率有逐年增加的趋势,年增长率约为5.8%。
由于黏膜黑色素瘤西方发病率低,因此目前该病的基础研究、临床分期、治疗均没有标准。北京大学肿瘤医院郭军教授团队围绕黏膜黑色素瘤基因组学、耐药机制和临床转化开展了一系列开创性研究工作,并于J Clin Oncol、Nat Commun、Clin Cancer Res等国际高水平期刊上发表了相应研究成果。同时,郭军教授还以黏膜黑色素瘤章节主编的身份,参与编写了国际权威教科书《皮肤黑色素瘤》(Cutaneous Melanoma),彰显了我国学者在黏膜黑色素瘤领域的国际影响力。
在本研究中,科研人员对特瑞普利(重组人源化抗PD-1单克隆抗体注射液)联合阿昔替尼(VEGFR-TKI,抗血管生成的酪氨酸激酶抑制剂)在亚洲人群晚期黏膜黑色素瘤一线治疗中的安全性、耐受性、药代动力学等进行了研究,证实了特瑞普利联合阿昔替尼的客观缓解率可以达到60.6%,出现肿瘤退缩的患者达到75.8%,而以往报道的黏膜黑色素瘤一线治疗的客观缓解率从未超过20%。
该研究提供了迄今为止国内外已报道的晚期黏膜黑色素瘤中效率最高的一线治疗方案,有望成为国际黏膜黑色素瘤一线治疗的新标准。
科学家发现阻断炎症通路是预防黑色素瘤脑转移的关键
脑转移瘤是最致命的恶性肿瘤之一,患者的平均生存期不到一年,而且脑转移的发生率正在上升。
近日,以色列特拉维夫大学(TAU)的一项新研究发现,当肿瘤细胞“劫持”大脑中的炎症通路时,就会发生黑色素瘤脑转移。研究表明,阻断这一途径可以防止这些转移的发生。该研究近日已发表在Cell Reports上。

该研究通讯作者、TAUSackler医学院病理学系的Neta Erez教授解释说:“脑转移患者的预后非常糟糕。过去,在临床发现脑转移之前,病人往往死于其他转移。随着治疗方法的改进和患者寿命的延长,确诊的脑转移发生率也在增加。了解脑转移的发生方式和原因是当今癌症研究人员面临的紧迫挑战。”
这项新研究由TAU的研究生Hila Doron博士和Malak Amer与TAUSackler医学院的Ronit Satchi-Fainaro教授合作完成。
Erez教授说:“这项研究主要集中在黑色素瘤脑转移,因为黑色素瘤是最致命的皮肤癌,它的转移率很高,且经常发生在脑部。”
在这项研究中,研究人员利用小鼠自发黑色素瘤脑转移模型研究了黑色素瘤在脑微环境中的相互作用。他们发现星形胶质细胞接管生理炎症通路可促进黑色素瘤脑转移。此外,星形胶质细胞对大脑组织损伤的反应是通过激发炎症和组织修复反应来抑制损伤,分泌炎症因子来招募免疫细胞。
Erez教授说:“肿瘤细胞会招募这些炎症因子,劫持它们进入大脑。我们确定了一种特定的因子介导了它们对大脑的吸引力,并表明脑转移性黑色素瘤细胞表达炎症因子的受体,就是它们对这种信号的反应。”
值得注意的是,当研究人员使用遗传工具抑制黑素瘤细胞上受体的表达时,他们成功地阻断了肿瘤细胞对星形胶质细胞信号反应的能力,并且脑转移的发展受到显着抑制。
在临床前小鼠模型中进行了初步研究后,研究人员在接受脑部手术的患者脑转移中验证了研究结果,发现星形胶质细胞表达与小鼠模型相同的炎症因子(CXCL10),并且肿瘤细胞表达与小鼠模型相同的受体(CXCR3)。这表明同样的机制在人体中也起作用。
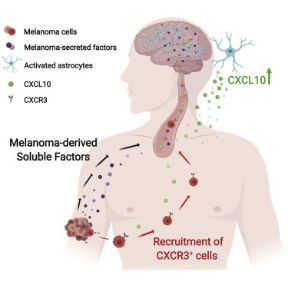
Erez教授总结道:“我们的研究结果表明,阻断这种信号通路可能会阻止脑转移。CXCL10-CXCR3可能是预防黑色素瘤脑转移的潜在治疗靶点。”
目前,研究人员正在调查引发大脑炎症的触发因素,而炎症会促进转移。
以色列希伯来大学成像技术可以帮助预测癌症
耶路撒冷希伯来大学正在开展一项新的研究,对同一患者进行不同时间的脑部扫描,在不进行侵入性或危险程序的情况下区分健康和患病的脑组织。
希伯来大学研究人员将这种阅读MRI的新方法与进行血液检测相比较。当我们进行血液检查时,它向我们展示了我们身体中白细胞的确切数量以及这个数字是否因疾病而高于正常水平。这项磁共振图像新分析为大脑提供了类似的信息。当对大脑进行扫描分析时,不同疾病中造成的大脑大分子存在巨大差异,通过这些差异可检测和分析判断神经退行性疾病的发作。这种新的磁共振图像可以帮助医生更快地确定疾病的发病并开始有效治疗,已被用作分析大脑的一种方法。
新的磁共振图像技术将使人们进一步理解大脑如何衰老的。当扫描年轻和年老患者的大脑时,发现一些大脑区域在不同年龄有很大差异。例如,在一些白质区域中,脑组织体积减少,而在灰质中组织体积保持不变,然而分子构成发生了重大变化。希伯来大学研究人员认为,通过非侵入性技术可使患者更早接受正确的诊断,有助于人们更长时间地维持和改善生活质量。
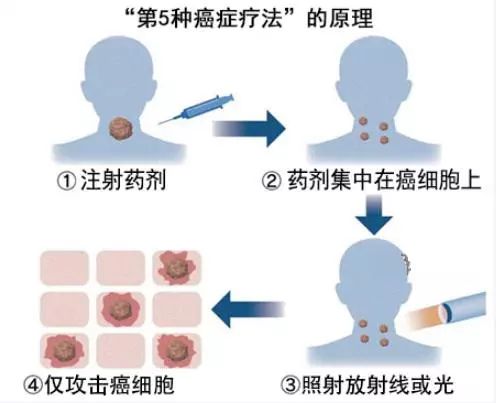
日本癌症的“第五疗法”将在2020年使用
据报道,在日本,用药物给癌细胞做上标记、通过放射线和光将其杀死的新型癌症疗法BNCT(硼中子俘获疗法)最早将在2020年开始使用,在癌症治疗方面,被称为继手术、传统放疗、抗癌药物、免疫疗法之后的“第五疗法”。把放射线和药物结合起来的方法对人体损害较小,有望产生较好的疗效。
硼中子俘获疗法不同于传统的放疗,对正常细胞几乎没有任何损伤,只需照射一次即可。这种疗法很可能可以用于和正常组织没有明显界限的病灶,与PET(正电子发射型计算机断层显像)检查共同使用,可在治疗前预测治疗效果。
治疗时,给患者服用的含有硼化合物的药物将被癌细胞吸收,以此为标记,使中子与其撞击发生核反应,破坏癌细胞的DNA。每次治疗40分钟左右。正常细胞基本上不会吸收硼化合物。在先期进行的临床试验中,以头颈部的癌症患者为对象,约70%患者的病灶有所缩小。
围绕硼中子俘获疗法,日本国内目前正在建设多处设施。中子以前主要通过核反应堆来生成,而现在已经利用加速器成功制造出中子。设备实现了可以安装到医院里的小尺寸,成为这一疗法的推动因素。在治疗所用设备和药物的研发方面,除住友重机械工业外,还包括半导体企业罗姆和电商乐天等意想不到的面孔。
日立制作所和三菱重工业也紧随住友重工进行设备的研发。日立的美国子公司研发的加速器已经向日本国立癌症研究中心中央医院供货。建设硼中子俘获疗法设施需要50-70亿日元(约合3-5亿人民币),费用与使用质子束的癌症治疗设施相当,成本是当前面临的问题。