国内第二款PD-L1检测试剂盒获批
2019年12月13日,NMPA发布最新进口批件通知,Dako North America(代理人:安捷伦科技(中国)有限公司)的“PD-L1检测试剂盒(免疫组织化学法)”获批上市。此次成功获批的PD-L1试剂盒(28-8),是继Dako 22C3 PD-L1检测试剂盒之后,中国境内获批的第二款PD-L1检测试剂盒。
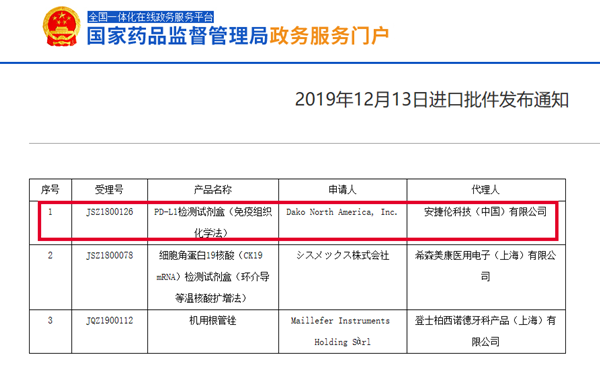
该产品于在2019年1月入围医疗器械优先审批申请审核。

2019年8月30日,NMPA批准DAKO公司生产的PD-L1检测试剂盒(免疫组织化学法)PD-L1 IHC 22C3 pharmDx上市,该产品为在中国批准上市的首个PD-L1检测试剂盒。 图:NMPA正式批准丹麦DAKO公司生产的PD-L1检测试剂盒(免疫组织化学法)PD-L1 IHC 22C3 pharmDx上市 该试剂盒的预期用途为“用于定性检测中性福尔马林固定石蜡包埋(FFPE)的非小细胞肺癌(NSCLC)组织中的PD-L1蛋白,辅助鉴别可使用 KEYTRUDA®(帕博利珠单抗)治疗的NSCLC患者。” 该试剂盒的获批在国内创造了两个记录:第一,DAKO 22C3是国内首个正式获批应用于临床诊疗的PD-L1检测试剂盒;其二,DAKO 22C3是国内首次批准PD-1免疫检查点抑制剂类药物伴随诊断的检测试剂盒。
点赞 0 反对 0 收藏 0
评论 0



