新型原材料纳米酶试纸条层析技术在即时检验中的应用与亟待解决的问题

高利增,中国科学院生物物理研究所研究员,课题组长,中科院纳米酶工程实验室副主任,中国生物物理学会理事和纳米酶分会副会长,生物化学与生物物理学进展和微生物学通报编委。主要从事纳米酶等生物活性材料的开发和应用研究,包括纳米酶理性设计和合成,以及其在诊断检测、抗耐药菌、抗病毒、抗肿瘤等方面的应用和转化,主要工作发表在Nature Nanotechnology, Nature Communications, Nature Protocols, Nano Today, Biosenors and Bioelectronics等杂志,获得2015国际牙医协会口腔护理创新奖(IADR Innovation in Oral Care Award)。
【摘要】纳米酶试纸条层析技术是一种新型的固相免疫检测技术,是将传统试纸条中的胶体金替换成纳米酶。纳米酶具有低成本、高稳定性、生物相容性等特性,使其在疾病诊断、食品安全、药物残留等方面被广泛应用。近年来,国内外研究人员对纳米酶试纸条层析技术的研究越来越多,本文对纳米酶试纸条层析技术的原理、分类、检测类型和应用前景进行了综述。
【关键词】纳米酶;免疫层析;诊断;应用
纳米酶试纸条层析技术(Nanozyme strip)是以纳米酶作为标记物检测特定抗原或抗体的固相免疫标记技术。它不同于传统的胶体金试纸条检测技术,除了具有操作简便、快捷的特点,纳米酶因其类酶活性,可使底物显色信号放大,增强灵敏度。纳米酶具有与天然酶一样的催化效力,并且比酶更稳定,阎锡蕴院士团队在2015年研制出一种有效检测埃博拉病毒的纳米酶试纸条新技术,该技术解决了传统试纸条法因灵敏度低而长期应用受限的瓶颈问题,有望成为控制埃博拉传播的利器[1]。目前,纳米酶试纸条技术在医学、化工、食品、农业和环境等领域被广泛研究,并在2018年获得转铁蛋白和便潜血检测相关的两项医疗器械注册证。本文主要介绍了纳米酶试纸条层析技术原理、分类、检测类型以及在各个领域中的应用前景。
一、纳米酶试纸条层析技术及原理
1. 纳米酶:纳米酶(Nanozyme)是一类本身蕴含类酶特性的纳米材料,是新一代人工酶,具有多种酶模拟活性、高稳定性、独特的表面化学性质、易于表面调节和生物相容性等诸多优点,它克服了天然酶制备困难、成本高、易失活等问题。自2007年被首次报道以来[2],已有近千种不同组成的纳米材料被发现具有类酶活性,以金属、金属氧化物、金属有机骨架为基础的纳米酶已被用于生物传感系统的开发,利用纳米材料的物理化学性质为即时检验(point-of-care testing,POCT)技术的发展提供了新思路。
2. 纳米酶试纸条层析技术原理:纳米酶试纸条层析技术是以纳米酶作为检测探针,利用其类酶活性、磁性等特性应用于抗原抗体反应的一种新型检测技术。其原理是将己知的特异性抗体(抗原)固定在硝酸纤维素膜上作为检测带,将与之配对的另一个抗体(抗原)与纳米酶进行偶联,形成纳米酶-抗体(抗原)复合物作为检测探针,当加入待检样品后,若样品中含有待检物,首先会被探针捕捉,形成抗原抗体纳米酶复合物,随着层析液继续向前泳动,到达检测线与包被抗体(抗原)发生高特异性和高亲和力的免疫反应,产生一条明显的检测带,多余的探针则继续向前到达质控线被捕捉。若样品中不含目标分析物,则与纳米酶探针一起到达质控线。最后经酶信号放大进行定性或半定量分析的检测过程(图1)。
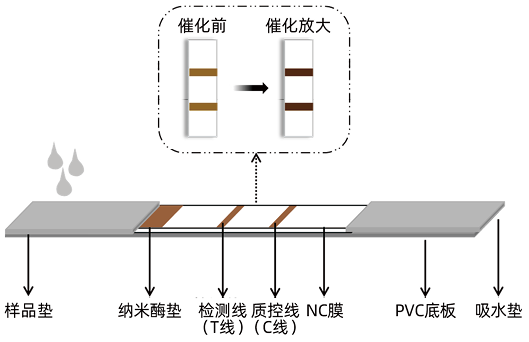
图1. 纳米酶试纸条原理图
二、纳米酶及其显色/发光类型
近年来,越来越多的纳米酶被发现具有多种类酶活性如氧化酶(Oxidase, OXD)[3]、过氧化物酶(Peroxidase, POD)[4]、过氧化氢酶(Catalase, CAT)[5]、超氧化物酶(Superoxide Dismutase, SOD)[6]等。纳米酶在不同条件下可以表现出不同的类酶活性,并且不同纳米酶对不同底物的亲和力也不相同。因此,为了让纳米酶试纸条检测灵敏度提高,常常需要针对不同纳米酶选择其最适底物以达到最佳催化效果,应用到即时检验中。不同纳米酶表现出来的不同类酶活性及其在体外检测中的应用见表1。由表1可见,纳米酶能选择性的检测多种标志物,以类过氧化物酶应用最广泛。常用比色法进行酶信号放大提高试纸条检测灵敏度,除此以外,化学发光、荧光法也有涉及。
表1. 不同纳米酶在即时检验中催化类型总结
纳米酶 | 目标检测物 | 活性 | 催化底物 | 检测方法 | 最低检测限 | 文献 |
Fe3O4 NPs | 埃博拉病毒 | POD | DAB H2O2 | 比色法 | 1ng/ml | [1] |
VS2NS | 17β-雌二醇 | POD | TMB H2O2 | 比色法 | 0.065ng/ml | [7] |
FeS2 NPs | 新冠病毒 | POD | TMB H2O2 | 比色法 | 200 copies/ml | [8] |
Fe-N-C SAzyme | 黄曲霉毒B1 伏马菌素B1 | POD | TMB H2O2 | 比色法 | 2.8pg/ml 13.9pg/ml | [9] |
NiCO2O4(NCO)NPs | 17β-雌二醇 | POD | TMB H2O2 | 比色法 | 0.9541-8ng/ml | [10] |
Au@Pt NPs | 妥布霉素 | POD | TMB H2O2 | 比色法 | 0.02nm | [11] |
Fe3O4@PDA@Pd/Pt NPs | 大肠杆菌 | POD | DAB H2O2 | 比色法 | 90 CFU/ml | [12] |
Co-Fe NPs | 新冠病毒 | POD | 鲁米诺 | 化学发光 | 0.1ng/ml | [13] |
CeO2 NPs | 过氧化氢 | CAT | — | 荧光法 | 130 nmol/l | [14] |
MoS2 | 人附睾特异性蛋白4 | POD | — | 电化学法 | 3×10-7ng/ml | [15] |
三、纳米酶试纸条层析技术的检测类型
纳米酶试纸条既可以检测蛋白质(抗原抗体)又可以检测核酸。抗原抗体检测方法主要有竞争法、间接法和夹心法,目前研究最广泛的是夹心法和竞争法。
1. 蛋白质检测:(1)夹心法:夹心法包括双抗体夹心法和双抗原夹心法。纳米酶上标记待测物的单克隆抗体(抗原),检测线(T线)包被针对待测物另一位点的单克隆抗体(抗原),质控线(C线)包被纳米酶标记抗体的二抗。当待测物为阳性样本时,待测物同时与纳米酶标记抗体和T线处包被受体(抗原或抗体)结合形成一个夹心结构,在T线处聚集显色,多余的纳米酶标记抗体继续层析至C线与包被二抗结合而显色。T线和C线均显色为阳性结果;T线不显色,C线显色为阴性结果;T线和C线均不显色为无效结果。阎锡蕴院士团队[1]研制出了快速检测埃博拉病毒的四氧化三铁过氧化物纳米酶试纸条,其灵敏度低至1ng/ml。经二氨基联苯胺(Diaminobenzidine,DAB)显色信号放大后,比传统胶体金法灵敏度提高10-100倍,30min内即可检测出结果。(2)竞争法:竞争法常用来检测抗原分子,纳米酶垫上包被的纳米酶标记抗体或抗原和待测物与T线处包被的抗原或抗体进行竞争性结合。当待测物为阳性样本时,待测物中的抗体与T线包被的抗体可竞争性结合纳米酶标记抗原,导致T线上包被的抗体无法和纳米酶标记抗原结合,则T线无法显色。T线和C线均显色为阴性,T线不显色C线显色为阳性,T线和C线均不显色为无效结果。张道宏团队[7]研制了检测17β-雌二醇的二硫化钒过氧化物纳米酶试纸条,经3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-Tetramethylbenzidine,TMB)显色信号放大后,最低检测限为0.065ng/mL。而胶体金试纸条检测灵敏度为0.406ng/ml,灵敏度比纳米酶试纸条检测结果高6倍。
2. 核酸检测:核酸试纸条是近年来试纸条层析技术中的新热点,目前研究最广泛的是将核酸扩增与试纸条相结合进行检测。与传统的聚合酶链反应(Polymerase Chain Reaction,PCR)技术相比,具有操作简单、检测时间短、检测范围广等优点。阎锡蕴院士团队[8]结合了重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)和二硫化亚铁过氧化物纳米酶试纸条,实现了简便的核酸扩增和比色信号增强。该方法对新冠病毒的最低检测限为200 copies/mL,接近于临床RT-PCR检测。此外,对人乳头状瘤病毒16型临床样本的检测与RT-PCR结果100%一致。
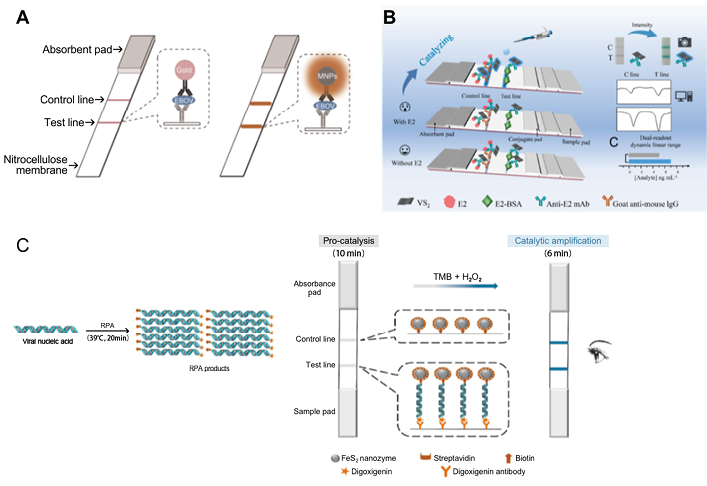
图2. 纳米酶试纸条应用
A. 四氧化三铁过氧化物纳米酶试纸条双抗体夹心法检测埃博拉病毒[1];B. 二硫化钒过氧化物纳米酶试纸条竞争法检测17β-雌二醇[7];C. 二硫化亚铁过氧化物纳米酶试纸条核酸检测新冠病毒和人乳头瘤病毒(human papilloma virus,HPV)[8](网络版彩图)
四、纳米酶试纸条层析技术的应用
1. 医学诊断:金黄色葡萄球菌是人类的一种重要病原菌,存在于约30-50%的人群中。可引起许多严重感染,导致各种疾病,如肺炎、败血症等。陈建甫教授团队[16]研制了检测金黄色葡萄球菌的钯铂过氧化物纳米酶试纸条,可以在30分钟内检测到金黄色葡萄球菌的生物标志物蛋白A,检测限为9.56ng/ml,灵敏度高、快速便捷。当下,SARS-CoV-2已演变为全球性的大流行病,早期和快速的检测SARS-CoV-2对控制其传播至关重要。阎锡蕴院士课题组[13]将Co-Fehemin过氧化物纳米酶和化学发光免疫检测与侧流条带相结合,开发了一种基于Co-Fehemin过氧化物纳米酶的新型化学发光试纸条检测方法,用于快速、灵敏地检测SARS-CoV-2抗原。这种方法对SARS-CoV-2重组加标抗原的检出限为0.1ng/ml,线性范围为0.2-100ng/ml。其研究结果表明,假病毒试验的灵敏度可达360 TCID50/ml,这与ELISA法相当,特异性好,无交叉反应,可以在16分钟内完成。刘键等[17]建立了检测诺如病毒的纳米酶试纸条,最低检测浓度为10ng/ml,比胶体金试纸条灵敏度高10倍,它与轮状病毒、腺病毒和幽门螺旋杆菌均无交叉反应。
2. 食品安全:真菌毒素是真菌在食品或饲料里生长所产生的代谢产物,对人类和动物都有害。喻理研究员和李培武院士团队[9]制备了一种具有高效催化性能的Fe-N-C单原子过氧化物纳米酶试纸条,对黄曲霉毒素B1和伏马菌素B1的检测限分别为2.8pg/mL和13.9pg/ml,分别比欧盟规定的最大检测限低700和71000倍以上。17β-雌二醇普遍存在于各类环境,对健康和生殖影响大,可出现性器官变异,癌症发生等危害。张道宏教授课题组[10]提出一种基于多功能NiCO2O4(NCO)的更新的用于17β-雌二醇检测的试纸免疫测定法。检测过程在10分钟以内可以完成。在比色和催化信号下的检测范围分别为0.9541-8ng/ml和0-30ng/ml,相关系数分别为0.9541和0.9962,且该检测具有良好的特异性和满意的回收率(86.2-107.6%)。动物源性食品中的抗生素残留已成为食品安全的主要威胁之一。妥布霉素是兽医中最常用的抗生素之一,过度使用妥布霉素会导致动物源性食物中的积累,这将导致严重危害人体健康。周楠迪团队[11]建立了一种用于妥布霉素现场快速检测的铂修饰金过氧化物纳米酶试纸条。该条带可在10min内完成妥布霉素的视觉检测过程。经酶信号放大后,最低检测限为0.02nm。该试纸条已成功地应用于不同食品样品中妥布霉素的检测。Han[18]等人设计了一种检测牛奶中大肠杆菌的钯-铂过氧化物纳米酶试纸条,灵敏度为9.0×102CFU/ml,比传统胶体法灵敏度高111倍。赖卫华教授课题组[12]研制了检测大肠杆菌的Fe3O4PDAPd/Pt过氧化物纳米酶试纸条。对奶样品中的大肠杆菌O157:H7含量检测限达9×101CFU/ml。
3. 农业:在相关研究中,Cai等[19]构建了一种检测黄曲霉毒素B1的MnO2过氧化物纳米酶试纸条。该检测方法的检测限为15pg/ml,比欧盟(EU)规定的食品中黄曲霉毒素B1的最高检测限低100倍以上。此外,该试纸条可提供7个动态检测范围,跨越4个数量级,可满足不同国家对食品和饲料中黄曲霉毒素B1残留限量的要求。估计回收率在85.67%-106.38%的范围内,变异系数(Coefficient of Variation,CV)小于9.68%。符娜等[20]建立了莴苣花叶病毒纳米酶免疫层析试纸条法,灵敏度为100ng/ml。该方法成本低、检测快速和灵敏度高,为口岸病毒检测提供了一种新的检测技术。玉米极易受到检疫性病毒玉米褪绿斑驳病毒的侵染,致使玉米产量损失。张祥林等[21]建立了检测玉米褪绿斑驳病毒的纳米酶试纸条,检测灵敏度比RT-PCR高100倍,特异性好,检测结果准确。
五、纳米酶试纸条层析技术需要解决的问题
纳米酶试纸条层析技术是近年来纳米酶应用领域的一个研究方向,该技术具有生产成本低、操作简单、对检测分析物敏感、特异性好等优点。国内外研究人员一直在进行着纳米酶试纸条层析技术用于疾病诊断、环境监测、农业发展等领域的研究,使其成为在任何时候、任何人都可利用的一种可靠技术手段。通过上述最近的例子,有力的证明了将纳米酶应用到即时检验中有着光明的前景。但是由于纳米酶试纸条层析技术存在诸多的不足,仍有许多问题需要解决。
1. 类酶活性及灵敏度:尽管许多纳米材料被报道有多种类酶活性,但是仅有类过氧化物酶占主导地位用于即时检验应用,鉴于天然酶的多样性应致力于制定更多新的战略。同时,纳米酶试纸条层析技术的灵敏度主要取决于纳米酶的催化效率。而很少有例子证明纳米酶的催化活性在即时检验中增强灵敏度发挥巨大作用。
2. 定量检测:目前大多数纳米酶试纸条用于定性检测,主要通过肉眼观察颜色变化进行结果判读。但是在临床上,定量检测能够给疾病的诊断带来更多的帮助,因此,在未来定量检测的研究也很重要。
3. 多样本检测:目前大多数纳米酶试纸条是针对单一检测物进行分析的,很少有文献报道能对两种或以上检测物同时检测。在大环境下,更多需要的是对复杂条件进行快速分析的检测方式。研究纳米酶试纸条对多种检测物同时检测也是一个重要方向。
参考文献
Duan D M, Fan K L, Zhang D D, et al. Nanozyme-strip for rapid local diagnosis of Ebola. Biosens Bioelectron, 2015,74 :134-41.
Gao L Z, Zhuang J, Nie L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles. Nat Nanotechnol, 2007, 2(9) :577-83.
Asati A, Santra S, Kaittanis C, et al. Oxidase-like activity of polymer-coated cerium oxide nanoparticles. Angew Chem Int Ed Engl, 2009, 48(13):2308-12.
Sun Z Y, Liu Q Q, Wang X Y, et al. Bioorthogonal catalytic nanozyme-mediated lysosomal membrane leakage for targeted drug delivery. Theranostics, 2022, 12(3): 1132-1147.
Chen Z W, Yin JJ, Zhou YT, et al. Dual enzyme-like activities of iron oxide nanoparticles and their implication for diminishing cytotoxicity. ACS nano, 2012, 6(5), 4001–4012.
Zhao H Q, Zhang RF, Yan XY, et al. Superoxide dismutase nanozymes: an emerging star for anti-oxidation. J Mater Chem B, 2021, 9(35) : 6939-6957.
Chen Y Q, Ren J, Yin X C, et al. Vanadium disulfide nanosheet boosts optical signal brightness as a superior enzyme label to improve the sensitivity of lateral flow immunoassay. Anal Chem, 2022, 94(24): 8693-8703.
Meng X Q, Zou S J, Li D D, et al. Nanozyme-strip for rapid and ultrasensitive nucleic acid detection of SARS-CoV-2. Biosens Bioelectron, 2022, 217 :114739.
Cai X F, Ma F, Jiang J, et al. Fe-N-C single-atom nanozyme for ultrasensitive, on-site and multiplex detection of mycotoxins using lateral flow immunoassay. J Hazard Mater, 2023, 441: 129853.
Ren J, Yin X C, Hu HL, et al. A multi-scenario dip-stick immunoassay of 17β-estradiol based on multifunctional and non-composite nanoparticles with colorimetric-nanozyme-magnetic properties. Sensors and Actuators B: Chemical, 2022, 367 .
Jin X, Chen L, Zhang YT, et al. A lateral flow strip for on-site detection of tobramycin based on dual-functional platinum-decorated gold nanoparticles. Analyst,2021, 146(11): 3608-3616.
Lai XC, Zhang GG, Zeng L F, et al. Synthesis of PDA-mediated magnetic bimetallic nanozyme and its application in immunochromatographic assay. ACS Appl Mater Interfaces,2021, 13(1): 1413-1423.
Liu D, Ju C H, Han C, et al. Nanozyme chemiluminescence paper test for rapid and sensitive detection of SARS-CoV-2 antigen. Biosens Bioelectron,2020, 173: 112817.
Liu B W, Sun Z Y, Huang P J, et al. Hydrogen peroxide displacing DNA from nanoceria: mechanism and detection of glucose in serum. J Am Chem Soc,2015, 137(3): 1290-5.
Zhang SP, Chen YJ, Huang Y T, et al. Design and application of proximity hybridization-based multiple stimuli-responsive immunosensing platform for ovarian cancer biomarker detection. Biosens Bioelectron,2020, 159: 112201.
Wu SC, Tsai TT, Li TH, et al. Palladium-platinum bimetallic nanomaterials and their application in staphylococcus aureus detection on paper-based devices. Biosens Bioelectron, 2022, 216: 114669.
刘键, 张永江, 李小盼, 等. 诺如病毒纳米酶试纸条检测方法的建立[J]. 中国国境卫生检疫杂志, 2020, 43(02): 88-90.
Han JJ, Zhang L, Hu LM, et al. Nanozyme-based lateral flow assay for the sensitive detection of Escherichia coli O157: H7 in milk. J Dairy Sci 101, 2018, (7): 5770-5779.
Cai XF, Liang MJ, Ma F, et al. Nanozyme-strip based on MnO2 nanosheets as a catalytic label for multi-scale detection of aflatoxin B1 with an ultrabroad working range. Food Chem, 2022, 377: 131965.
符娜, 向均, 欧林君, 等. 莴苣花叶病毒纳米酶免疫层析试纸条的研制[J]. 植物检疫, 2020, 34(02): 33-37.
符娜, 向均, 张永江, 等. 纳米酶免疫层析试纸条法检测玉米褪绿斑驳病毒[J]. 新疆农业科学, 2021, 58(06): 1154-1159.




