ISO17511文件对于体外诊断产品参考物质有哪些新规定

杨涛,2008年于四川大学分析化学专业硕士研究生毕业。现任迈克生物股份有限公司参考系统部质量主管,主要负责参考方法的管理、ISO17025+ISO15195质量体系管理、参考测量实验室认可管理以及其他标准化研究工作的管理,负责完成CNAS研究课题1次和国家课题1次。以第一作者身份发表SCI论文1篇,参与作者发表SCI论文1篇,参与作者发表核心期刊2篇,参与编写书籍1次。

卿露遥,2019年于成都医学院毕业,现就职于迈克生物参考系统部。从事参考方法研究及产品量值溯源工作,主要负责紫外分光光度、离子色谱、ICP-MS、ID-LC/MS/MS类参考方法研究。
目前为止,ISO17511标准文件发布过两版,第1版于2003年发布,第2版于2020年发布,两版相隔17年,ISO17511新版的发布,积累了这17年间临床检验量值溯源实践的经验,全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)为此标准做出了很大的努力。
本文作者作为体外诊断制造商参考测量实验室研究产品量值溯源中的一员,有幸经历了我们公司产品在量值溯源方面的发展变化过程,在这里,结合自己对临床检验领域计量溯源的理解和体会,就ISO17511新旧版本对于参考物质的规定主要变化向大家做个介绍。
一、参考物质在溯源链中的名称和位置
ISO17511:2003(旧版)[1]和ISO17511:2020[2](新版)溯源链中,参考物质根据其预期用途不同,名称上有一些变化,比如一级参考物质、一级校准品、国际约定校准品、一致化参考物质、任意参考物质、二级参考物质/二级校准品等,从名称上可以预见参考物质后续的用途,另外校准等级有细微变化,完整溯源链见图1,因校准等级变化,那么参考物质的规定就会有变化。对于物质序列,两个版本对物质的名称和级别规定有不同,对应关系和变化见表1。
新版文件中有证一级参考物质对应旧版的一级校准品,从名称上定义更清晰,另外校准等级多了一层“m.2,一级校准品(用一级参考物质配制)”,旧版没考虑这一步,新版标准文件对此规定更清晰,也是结合了实际情况。
表1. 旧版和新版溯源链中物质序列比较
ISO17511:2003 | ISO17500:2020 | ||
等级 | 参考物质名称 | 等级 | 参考物质名称 |
c | 一级校准品 | m.1 | 有证一级参考物质 |
/ | m.2 | 一级校准品(用一级参考物质配制) | |
e | 二级校准品 | m.3 | 二级校准品/二级参考物质/其他有互换性的参考样品,例如人类样品盘或混合样品 |
g | 制造商工作校准品 | m.4 | 制造商工作校准品(主校准品) |
i | 制造商产品校准品 | m.5 | 终端用户校准品(多批) |
常规样品 | m.6 | 人类样品 | |
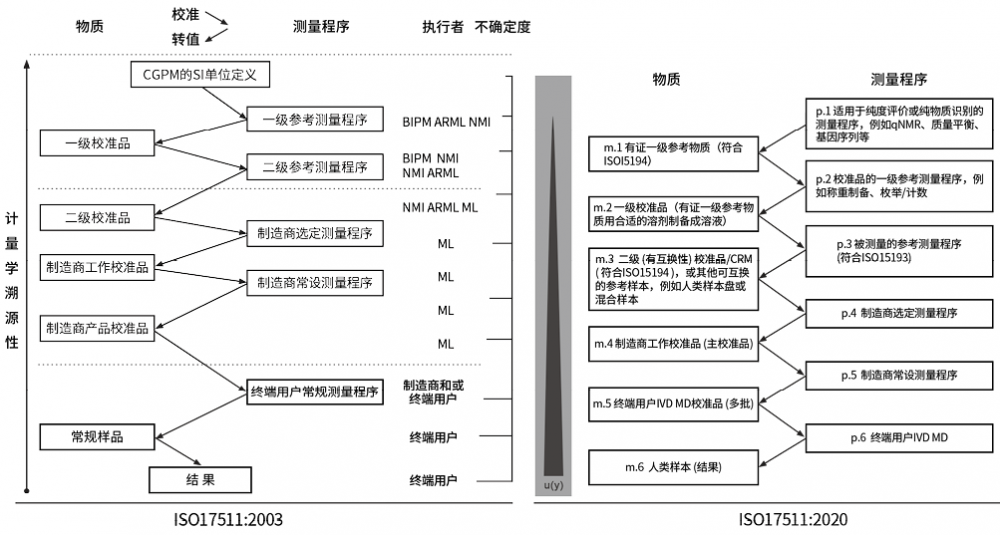
图1. ISO17511:2003和ISO17511:2020溯源链比较
二、参考物质和校准品的选择和要求
新版ISO17511关于“参考物质和校准品的选择和要求”的规定在4.5条款呈现,旧版在4.4进行了“参考物质的功能”描述,没有明确的针对参考物质和校准品的选择和要求,整体比较,新版对参考物质的规定,内容更多更集中更详细,条理更清晰,更好理解。对应的内容比较见表2。
新版对“参考物质和校准品的选择和要求”方面,基于个人的经验,有如下理解:
1. 新版在4.5.2条款参考物质特性方面增加了5条:g)赋值和溯源性;h)参考物质赋值的扩展测量不确定度;i)稳定性;j)批内均匀性和k)互换性,这些内容充分结合了这些年来各实验室的需求,更加完善了对参考物质的要求。
2. 明确了ISO15194标准文件的要求,对于符合和不符合ISO15194的参考物质都做了解释,在参考物质应用方面,要求更明确,只要证明合适,就可以使用。
表2. 旧版和新版关于“参考物质和校准品的选择和要求”的规定比较
ISO17511:2003 | ISO17511:2020 | ||
条款 | 内容 | 条款 | 内容 |
4.4 | 参考物质的功能 | 4.5.1 | 通用要求 |
4.2.5 | 除了在4.2.2c)、e)、g)、i)中的校准品要求外,对给定的校准品,还应进一步依据下列的信息明确特性:a)~j) | 4.5.2 | 要记录的特性:a)~n) |
/ | 4.5.3 | 符合ISO15194的参考物质 | |
/ | 4.5.4 | 不符合ISO15194的参考物质 | |
7.1c) | 参考物质互换性 | 4.5.5 | 参考物质的互换性 |
7.2、7.3 | 校准品互换性 | 4.5.6 | 互换性评价的其他要求 |
/ | 4.5.7 | 无互换性参考物质的应用 | |
/ | 4.5.8 | 可替代参考物质 | |
/ | 4.5.9 | 可替代参考物质的扩增 | |
/ | 4.5.10 | 无互换性的终端用户校准品 | |
3. 互换性要求,对于一级参考物质(图1,m.1)和一级校准品(图1,m.2)不要求做互换性评价。但对于二级参考物质/二级校准品(图1,m.3,有基质)和工作校准品(图1,m.4),应评价其互换性,在制造商环节,如选择二级参考物质/二级校准品作为校准品校准,那么二级参考物质/二级校准品的可互换性决定了量值传递的准确性,这在量值溯源过程中非常重要,那么对于互换性的评价,大多数情况下,还是需要使用者根据自己的检测系统进行评价,参考物质制备方可能会小范围进行测试,但不会涵盖所有的检测系统,查阅了多个参考物质的说明书或报告,只在ERM类参考物质报告中查到互换性方面的描述[3]。如测试结果与人类样品不可互换,应使用可互换的样品来确定校正因子或函数用于二级参考物质/二级校准品(图1,m.3,有基质)的指定值,以补偿因不可互换引起的任何偏差,这些信息需要在文件中进行描述。
4. 对没有可使用的参考物质情况,可以使用替代的参考物质来做校准,但需要说明理由,并给出其指定值、不确定度和互换性评价结果,包括需要扩增等情况,也是同等处理。
三、参考物质赋值的规定
新版本对于参考物质的赋值规定在“5计量溯源校准等级模式”章节进行描述,结合溯源链,按每一等级的顺序进行解释,整个过程很清晰,旧版本在“4.2结构和命名”中有解释,按照完整溯源链内容(见图1),根据新旧版本对应的级别,将涉及参考物质的内容列出来比较,具体内容见表3。
表3. 旧版和新版关于“参考物质赋值”的规定比较
ISO17511:2003 | ISO17511:2020 |
4.2.2c)一级校准品应直接用一级参考测量程序定值,或用适当的分析方法确定测定物质杂质后间接定值。 | 5.2.4一级参考测量程序:一级参考物质应由一级参考测量程序或纯度评估的测量程序直接赋值,例如定量核磁共振、质量平衡等。 |
/ | 5.2.5一级校准品:应由一级参考物质制备,由一级参考测量程序赋值 |
4.2.2e)二级校准品应由一个或多个二级参考测量程序为之定值。 | 5.2.6二级参考物质/二级校准品的赋值:由一个合适的参考测量程序给有复杂基质的二级参考物质/校准品赋值 |
/ | 5.2.7二级参考物质的互换性:应进行互换性评价研究 |
4.2.2g)制造商工作校准品应由一个或多个制造商选定测量程序为之定值。应证明其在制造商选定测量程序和被校准测量程序间有互换性。 | 5.2.9工作校准品:由制造商选定的测量程序/参考测量程序赋值。应证明其在制造商选定测量程序和被校准测量程序间有互换性。 |
4.2.2i)制造商产品校准品应由制造商常设测量程序为之定值。 | 5.2.11制造商终端用户校准品:由制造商常设测量程序/制造商选定的测量程序赋值 |
/ | 5.2.12终端用户校准品赋值的测量不确定度:需合成溯源链中高阶的其他所有来源,包括物质和程序的贡献 |
从表中内容可见,新版标准对参考物质的赋值规定多了几个内容:
1. 对一级参考物质的赋值程序要求,明确除了一级参考测量程序外,还可以用其他纯度鉴别的测量程序直接定值,比如定量核磁共振等。
2. 一级校准品的赋值要求。
3. 二级参考物质互换性的要求。
4. 制造商终端用户校准品可以用制造商选定的测量程序赋值。
5. 终端用户校准品赋值的测量不确定度要求。整体的要求和实验室实际操作是一致的。
四、参考物质和校准品测量不确定度规定
新版标准对测量不确定度的要求增加了新的内容,比如最大允许扩展不确定度,且在旧版基础上,将测量不确定度的要求进行了细化,更加浅显易懂。
表4. 旧版和新版关于“参考物质和校准品测量不确定度”的规定比较
ISO17511:2003 | ISO17511:2020 |
6测量不确定度表达和参考物质有关的每个可测量的量的定值,应用适当的术语表达测量不确定度。 | 4.3 最大允许扩展测量不确定度的规范 4.3.1 通用要求 4.3.2 范围 |
4.7 终端用户校准品赋值的测量不确定度估算 4.7.1 一般要求 4.7.2 估算测量不确定度的方法文件 4.7.3 测量不确定度估算的统计和范围 4.7.4 测量不确定度的表达 4.7.5 产品修改 4.7.6 提供给终端用户的信息 | |
在5.2~5.7条款的制造商终端用户校准品里面还有对测量不确定度的要求。 |
在新版标准文件里面,测量不确定度评估时,应该包括哪些来源,具体评估方法,都有详细的内容介绍,在给制造商评估校准品不确定度时有一定的方向指导,再结合GUM[4]、QUAM[5]、YY/T1709[6]等标准文件的要求,校准品不确定度的评估方法就比较清晰了。
五、总结与分析
关于个人理解部分,是仁者见仁,智者见智,每个人关注的内容和经历不一样,那么理解也会不同,文章中个人理解和体会部分是我以前理解不够深和期待的新内容,而通过学习新版收获比较大的地方:
第一次听闻ISO17511标准文件要修订是在2014年,对此非常期待,当时针对临床检验的量值溯源文件主要为ISO17511:2003和ISO18153:2003[7],虽然这两个文件对量值溯源的规定比较全面,但当时在产品溯源实施过程中,或多或少还是有一些不清晰和衔接不当的地方,也希望标准文件能将当前发展中出现的新需求增加进去。
2019年学习即将发布的ISO17511标准文件,浏览新版文件目录和结构时,发现和旧版有很大的改变,比较契合实际,特别是5.3章节、5.6章节、m.2一级校准品和校准品互换性描述这些方面,是把这十几年的经验和需求全部纳入标准文件中,为量值溯源标准研究和制造商产品量值溯源都提供了很大的帮助。
参考文献
ISO17511:2003 In vitro diagnostic medical devices-Measurement of quantities in biological samples-Metrological traceability of values assigned to calibrators and control materials.
ISO17511:2020 In vitro diagnostic medical devices-Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples
CERTIFICATION REPORT: The certification of the catalytic activity concentration of alanine aminotransferase in ERM®-AD454k/IFCC
GUM:2008 evaluation of measurement data — Guide to the expression of uncertainty in measurement
QUAM:2011 Quantifying Uncertainty in Analytical Measurement
YY/T1719: 2020 体外诊断试剂用校准物测量不确定度评定
ISO18153: 2003 In vitro diagnostic medical devices —Measurement of quantities in biological samples-Metrological traceability of values for catalytic concentration of enzymes assigned to calibrators and control materials.




