AIE荧光染色在体液细胞学检验中的临床应用价值

闫立志,副主任检验技师、执业医师,医学硕士。主要从事细胞形态学十余年,擅长胸腹水细胞学、支气管肺泡灌洗液细胞学、尿液有形成分分析及尿液脱落细胞学检查。学术兼职:现任内蒙古医师协会检验分会青年委员,中西医结合检验医学学会委员,中国医学装备协会检验分会委员,白求恩精神研究会检验分会委员,国家卫生健康委能力建设和继续教育中心检验医学专业2021年第一期受聘教师。出版专著《尿液有形成分图谱新解及病例分析》,在编专著《呼吸系统细胞学检验诊断图谱》(人民卫生出版社),主编《体液细胞学图谱》、《尿液有形成分图谱精选》,参编10余部形态学著作。执笔2020版《浆膜腔积液、脑脊液及肺泡灌洗液细胞形态学检验专家共识》。
聚集诱导发光(aggregation-induced emission,AIE)是由我国科学家唐本忠院士团队发现并引领的研究方向,具有AIE的特性的荧光探针在细胞成像中具有高分辨率、高荧光强度、免洗、易于设计等优点。经多年研究与探索,我们发现使用具有AIE特性的染料,并由此开发出的新型细胞荧光染色技术,具有灵敏度高、染色快速等特点,在体液细胞学检验中具有重要的应用价值。
一、什么是荧光技术?
发光(luminescence)是指由各种非温度导致的光释放过程[1]。根据引起发光原因的不同,可分为光致发光、生物发光、声致发光、辐射发光、电致发光、化学发光、摩擦发光等[2]。荧光就是一种光致发光,是原子、离子或分子通过一次或多次自发跃迁而产生的光发射现象。早在1852年,英国科学家Stokes就阐明了荧光产生的机制,发现利用短波长光照射在叶绿素以及奎宁的溶液时,会发出不同颜色波长的光,他把此现象命名为荧光[3]。
荧光在医学及生命科学中应用广泛,如荧光显微镜、荧光定量PCR、流式细胞仪、荧光抗体标记、荧光原位杂交、基因测序以及荧光免疫检测的技术基础等。荧光材料是荧光技术核心的要素之一,在医学领域中,最常用的荧光材料包括荧光蛋白、荧光量子点、金属有机化合物与有机分子[4]。其中,小分子有机荧光探针是最为常用的荧光材料。通过分子设计、化学合成与修饰,小分子有机物可容易地构建为具有特定光学性质的可视化探针,具有应用简便、生物相容性好、化学性质稳定等优点,是标记蛋白、核酸等生物大分子的最常用荧光物质。
尽管有机荧光探针有许多优点,用途广泛,但仍存在不足,其中一个重要的缺陷是在高浓度或者聚集的状态之下,发光物质常呈现显著的荧光降低甚至完全淬灭的现象,称为聚集荧光淬灭现象(aggregation-caused quenching,ACQ)。ACQ现象在许多传统有机荧光物质中常见[5-6],并会对实际应用带来负面影响,这在生命科学领域尤为常见。由于ACQ的原因,生物大分子的标记过程需要严格限制标记荧光分子的数量,否则荧光强度反而会因标记荧光分子的增多而减弱[7],这在一定程度上会影响标记的荧光强度和荧光标记效果。而有机小分子探针作为生物成像中最常用的工具,在应用中为避免分子探针的ACQ效应,工作浓度常控制在纳摩尔级别使得分子处于分散状态。然而,在如此低的工作浓度下,荧光强度非常容易受影响,而且易在强光的连续照射下分解或者发生光氧化,导致光漂白(bleaching),影响荧光成像的灵敏度同时给长时间荧光观察带来困难。
二、什么是聚集诱导发光技术(AIE)?
2001年,香港科技大学化学系唐本忠院士团队发现了一种与传统ACQ截然相反的发光现象,并把该现象命名为聚集诱导发光(aggregation-induced emission,AIE)[8-9]。AIE与传统ACQ恰恰相反,某些荧光分子在聚集的状态下荧光不发生淬灭,反而呈现明显的荧光增强。具有AIE特性的荧光分子在良溶剂中几乎不发光,但在加入不良溶剂后会生成聚集体并呈现显著的荧光增强效应。AIE现象分子机理目前被广泛接受的是分子运动受限(Restriction of molecular motion,RMM),主 要 包 括 分 子 内 旋 转 受 限(restriction of intramolecular rotation,RIR)和分子内振动受限(restriction of intramolecular vibration,RIV)等[10]。
AIE荧光探针具有天然的优势并展现出强大的应用潜力:(1)AIE分子在分散状态下不发光,但其与靶物质结合或聚集时荧光显著增强,可以实现荧光“点亮”的转变过程,具有超高的检测信噪比;(2)AIE分子的应用不易受到浓度的限制,从而可以达到更高的荧光强度;(3)AIE分子在聚集态时较游离单分子形式的光稳定性更强,有助于实现在连续强光照射下的长时间动态观察[10]。
三、AIE荧光染色技术的特点
AIE荧光探针具有光稳定性强、低毒性、使用简便等显著优势。基于AIE的检测体系,设计原理主要包括静电作用自组装、溶解性改变、特异性识别、疏水作用和电子/能量转移中断等来诱导运动受限的解除[10]。在细胞成像中,可通过设计靶向细胞器(如线粒体、溶酶体、脂滴、细胞核、细胞膜等)或细胞内生物标志物(如溶酶体蛋白、细胞膜上整合素及EGFR等)等策略实现细胞的荧光染色。
Cytosee就是一种具有AIE特性的小分子荧光探针[10],在水溶液中为橙红色透明溶液,最大吸收峰在480nm,最大发射峰在600nm左右该探针在水溶液中无光,一旦进入细胞内会发出不同颜色、不同强度的荧光(图1),依据此特性可以实现细胞的快速染色。
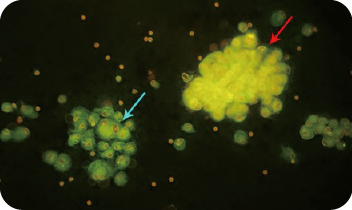
图1. 间皮细胞(蓝箭所指),细胞体积偏小,散在或成片分布,胞质成绿色荧光,荧光强度低,胞核呈橘红色荧光,核仁较小,荧光强度稍强;肿瘤细胞(红箭所指),细胞成团分布,结构不清,胞质呈亮黄色荧光,它与间皮细胞形成鲜明的对比(胸腔积液,AIE荧光染色,×200)
四、AIE荧光染色技术在体液细胞学检验中的应用价值
体液细胞形态分析是重要的实验诊断技术,通过制片、染色及显微镜观察,可以准确识别各类细胞及有形成分,为临床疾病诊断、病情监测、药物疗效和预后判断提供准确、可靠的依据。染色是体液细胞形态学分析的关键步骤和必要前提,传统的体液细胞染色方法有瑞-吉染色、HE染色及巴氏染色等。我们尝试使用Cytosee荧光染料鉴别体液细胞,发现其在浆膜腔积液、尿液、肺泡灌洗液、脑脊液等多种体液标本中可以鉴别很多类型的肿瘤细胞,观察细胞特殊的形态学变化。与良性上皮细胞相比,肿瘤细胞会呈现不同的荧光强度及颜色分布(图2、图3)。在尿液标本中,除了可以区别良、恶性细胞外,各种尿液管型的荧光强度略有不同,也可以使用AIE荧光染色进行区别;除此之外,染色后的涂片还可以发现细菌或真菌(图4)。
虽然AIE荧光染色在体液细胞鉴别中有一定的优势,但该种染色方法会受染液浓度、标本类型、涂片质量等因素的影响。所以使用AIE荧光染色应规范操作,考虑到各种干扰因素。
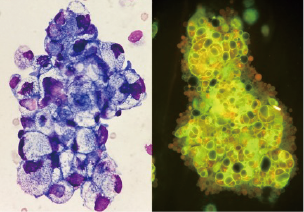
图2. 肿瘤细胞:左图中的细胞使用瑞-吉染色,细胞成团分布,边界不清,结构紊乱,胞质中有大量的脂质空泡,胞核不规则;右图使用AIE荧光染色,细胞成团分布,荧光强度较强,结合瑞-吉染色有助于肿瘤细胞的鉴别(胸腔积液,×400)
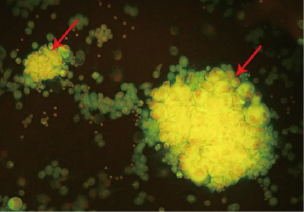
图3. 腺癌细胞(红箭所指),细胞成团分布,结构立体,细胞排列紊乱,胞质呈亮黄色荧光,荧光强度极强,背景中可见大量荧光强度较低的间皮细胞,胞质呈绿色荧光,两类细胞对比鲜明,可以从细胞形态特征及荧光强度进行鉴别(腹水,AIE荧光染色,×200)
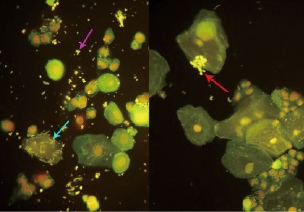
图4. 细菌粘附在鳞状上皮细胞表面(蓝箭所指),背景可见大量球菌(紫箭所指);真菌孢子(红箭所指)(尿液,AIE荧光染色,×400)
五、AIE荧光染色技术在细胞学检验中的应用前景
它与传统的染色方法比较,AIE荧光探针有高亮度、光稳定性强、生物相容性好等优势,在细胞学领域将大有可为。以外,结合共聚焦显微成像、双光子荧光成像及超分辨荧光显微成像等先进技术,设计线粒体、溶酶体、细胞核、细胞膜等细胞器成像探针,可揭示细胞微观结构。此外,基于AIE荧光探针易于设计的特性,设计具有特定功能的可视化荧光探针,用于探索细胞的各种功能。
由唐本忠院士、王前教授主审,南方医科大学南方医院司徒博教授、闫立志教授和郑磊教授主编,国内10家单位24位专家联合编著的《临床体液细胞AIE荧光染色图谱》一书,已由科学出版社出版。全书共六个章节,第一章主要介绍体液细胞形态学检验概论,第二章主要介绍细胞荧光染色原理与染色技术,第三章至第六章分别介绍了AIE荧光染色在不同种类标本中的应用。书中收录了数千张高清细胞荧光染色图片,结合典型的临床案例,与传统染色方法对比分析,总结出此种荧光染色方法的适用范围、染色效果、细胞形态特征以及荧光染色的影响因素及注意事项等。
参考文献
Reyes-Reyes A, Hou Z, van Mastrigt E, et al. Multicomponent gas analysis using broadband quantum cascade laser spectroscopy [J]. Optics Express, 2014, 22(15): 18299-309.
Valeur B, Berberan-Santos MN. Molecular fluorescence: principles and applications [M], 2nd ed; Wiley-VCH: Weinheim, 2012.
Stokes GG. Composition and resolution of streams of polarized light from multiple sources [J]. Trans Cambridge Philos Soc. 1852, 9: 399.
Yan Y, Wang S, Liu Z, et al. CdSe-ZnS quantum dots for selective and sensitive detection and quantification of hypochlorite [J]. Anal Chem, 2010, 82(23): 9775-81.
v. Bünau GJ, Birks B. Photophysics of aromatic molecules [M]. Wiley: London, 1970.
Zhelev Z, Ohba H, Bakalova R. Single quantum dot-micelles coated with silica shell as potentially non-cytotoxic fluorescent cell tracers [J]. J Am Chem Soc, 2006, 128(19): 6324-25.
Wang Z, Chen S, Lam JWY, et al. Long-term fluorescent cellular tracing by the aggregates of AIE bioconjugates [J]. J Am Chem Soc, 2013, 135(22): 8238-45.
Luo J, Xie Z, Lam JWY, et al. Aggregation-induced emission of 1-methyl-1,2,3,4,5-pentaphenylsilole [J]. Chem Commmun, 2001, (18): 1740-41.
Tang BZ, Zhan X, Yu G, et al. Efficient blue emission from siloles [J]. J Mater Chem, 2001, 11(12): 2974-78
司徒博, 闫立志, 郑磊.《临床体液细胞AIE荧光染色图谱》[M]. 北京: 科学出版社, 2022.




