高同型半胱氨酸及其相关代谢物检测在心脑血管疾病诊疗中的应用价值

郑芳,武汉大学中南医院检验科副主任,武汉大学医学检验系副主任,武汉大学中南医院临床基因诊断中心主任。研究方向:冠心病易感基因表观遗传学机制的研究,遗传病的分子诊断。主要学术兼职:中国老年检验分会常委、代谢性疾病组副主任委员、中国生物化学与分子生物学脂质与脂蛋白专业委员会副秘书长等。学术成就:牵头教育部新世纪人才、国家自然科学基金资助项目、湖北省杰出青年基金等20余项;发表SCI论著百余篇,主编学术著作10余部,专利近10余项。
【摘要】高同型半胱氨酸是心脑血管疾病的一大危险因素,其相关代谢物如叶酸、维生素B6、B12和甜菜碱的补充可以通过多种机制来降低心脑血管疾病的发病率。本篇综述对同型半胱氨酸及其相关代谢物的检测方法及作用机制提供了新的见解和思路。
【关键词】高同型半胱氨酸血症;叶酸;甜菜碱;心脑血管疾病
同型半胱氨酸(Homocysteine,Hcy)是蛋白质在代谢过程中产生的一种氨基酸,体内的Hcy是由甲硫氨酸,也就是蛋氨酸在ATP及甲基转移酶的作用下转化为S-腺苷同型半胱氨酸,最终生成的Hcy;它的代谢一部分是通过再甲基化途径在蛋氨酸合成酶(Methionine synthase,MTR)的作用下,以维生素B12作为辅酶因子、5-甲基四氢叶酸为甲基供体,发生再甲基化,重新合成蛋氨酸;再甲基化的另一途径是局限肝细胞内,以甜菜碱为甲基供体,在甜菜碱同型半胱氨酸甲基转移酶(Betaine-homocysteine methyltransferase,BHMT)的作用下完成蛋氨酸合成。还有一部分Hcy是通过转硫途径在胱硫醚β合成酶(Cystathionine βsynthase,CBS)和胱硫醚γ裂解酶(Cystathionine gamma-lyase,CL)的作用下,生成α-酮丁酸和半胱氨酸,后者再转变为谷胱甘肽或进一步代谢为硫酸盐经尿排出,此反应过程需要维生素B6的存在。也有一部分Hcy由细胞直接释放到细胞外基质中(血浆),这与细胞内甲硫氨酸浓度有关[1](图1)。有研究表明,在甲硫氨酸浓度低时,细胞释放受到甲硫氨酸合成酶的影响;而甲硫氨酸浓度高时,细胞释放则受到CBS的影响。在正常情况下,细胞内Hcy来源和去路保持动态平衡,但当因遗传因素如关键代谢酶缺陷或者由于营养因素如叶酸等维生素缺乏时,其动态平衡便被打破,致人体内Hcy增加,引起高同型半胱氨酸血症(Hyperhomocysteinemia,HHcy)[2]。2018年修订的《中国高血压防治指南》将空腹血浆Hcy≥15µmol/L作为HHcy的诊断标准。根据Hcy升高程度分为轻度HHcy(Hcy15~30µmol/L)、中度HHcy(Hcy 31~100µmol/L)和重度HHcy(Hcy>100µmol/L)[3]。
注:MTHFR,亚甲基四氢叶酸还原酶;MTRR,蛋氨酸合成酶还原酶,MTR,蛋氨酸合成酶;BHMT,甜菜碱同型半胱氨酸甲基转移酶;CBS,胱硫醚β合成酶;CL,胱硫醚γ裂解酶;SAM,S-腺苷甲硫氨酸;SAH,S-腺苷同型半胱氨酸;DMG,二甲基甘氨酸。
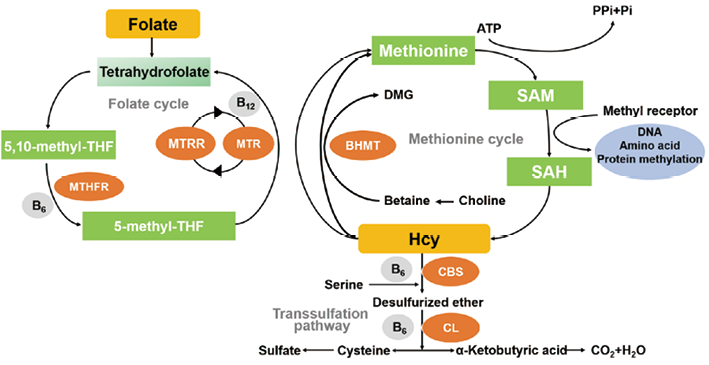
图1. 蛋氨酸循环示意图
心脑血管疾病是心脏血管和脑血管疾病的统称,泛指由于高脂血症、血液黏稠、动脉粥样硬化、高血压等所导致的心脏、大脑及全身组织发生的缺血性或出血性疾病。心脑血管疾病是一种严重威胁人类,特别是50岁以上中老年人健康的常见病,具有高患病率、高致残率和高死亡率的特点[4, 5]。近10年来,国内外对于同型半胱氨酸的研究不断,多个基础实验研究和临床观察表明,Hcy水平与心脑血管疾病密切相关,HHcy可以加速心脑血管疾病的发生和发展,尤其是与冠心病动脉粥样硬化和中风等相关性受到了广泛的重视[6, 7]。本文论述了Hcy与冠心病和脑卒中的发病机制与检测方法。
一、同型半胱氨酸及其代谢物的检测方法
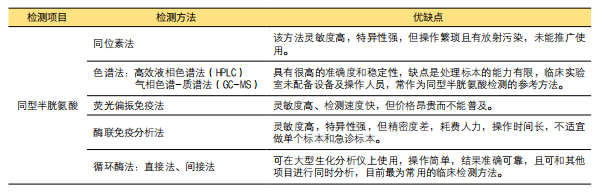
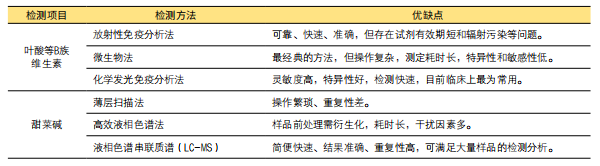
目前对于同型半胱氨酸及其代谢物如叶酸等B族维生素和甜菜碱的检测方法以及各种方法的优缺点总结如下表所示:
表1. 同型半胱氨酸及其代谢物的检测方法
二、同型半胱氨酸在心脑血管疾病中的研究及致病机制
冠心病(coronary artery disease,CAD)是一类以动脉粥样硬化(Atherosclerosis,AS)为病理基础的心血管疾病(cardiovascular diseases,CVD),是影响全球人口的主要心血管疾病之一,也是发达国家和发展中国家人员死亡的主要原因。冠心病严重危害人类健康,其病死率已超过肿瘤性疾病[8]。Hcy与冠心病患病率的关系已引起人们的关注,大量研究表明Hcy升高可能是冠心病的独立危险因素[9-11]。一项纳入10项研究,共10,103名受试者的荟萃分析显示,Hcy水平每升高5µmol/L,冠状动脉事件的OR值为1.22(95% CI:1.11,1.34)[6]。血浆Hcy水平也与冠状动脉病变程度及预后有关。Li等人对667例冠心病患者进行的前瞻性研究发现,与对照组相比,HHcy组患者冠状动脉狭窄程度明显升高,病变更多(p<0.001),SYNTAX评分更高(p<0.001);随访1年后,HHcy组主要心脑血管不良事件发生率也明显高于对照组(9.5% vs 15.1%;p=0.042)[12]。这些结果表明,当血浆Hcy水平升高时,冠心病的风险会增加。
脑卒中又称“中风”、“脑血管意外”(cerebral vascular accident,CVA)。是一种急性脑血管疾病,是由于脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起脑组织损伤的一组疾病,包括缺血性和出血性卒中[13]。据统计,全世界每4个人中就有1个人会发生卒中,每6秒钟就有1个人死于卒中,每6秒钟就有1个人因卒中而残疾,脑卒中也是我国居民第一位死亡原因[14]。目前,高水平Hcy也被认为是脑卒中的一个危险因子。大量的研究已经证实Hcy在脑卒中,尤其是缺血性卒中和小血管疾病中的有害作用[7, 15]。一项使用MEGASTROKE联盟中卒中的数据(包括16,952缺血性卒中病例和404,630例非病例)进行的孟德尔随机化分析显示,遗传预测的Hcy每增加1个标准差(SD),与脑小血管中风的OR比值比为1.34(95% CI,1.13-1.58;p=6.7×10-4)[7]。来自30项前瞻性或回顾性研究的数据共纳入1113例卒中参与者的荟萃分析,通过条件logistic回归获得卒中与血液同型半胱氨酸浓度相关的ORs,在对已知的心血管危险因素和前瞻性研究中的回归稀释偏倚进行校正后,同型半胱氨酸水平降低25%可以降低19%的卒中风险(OR,0.81;95% CI,0.69-0.95)[16]。
Hcy诱发心脑血管疾病的发病机制尚未完全阐明,可能存在多种机制。(1)高水平的Hcy可通过多种方式促进血管内皮功能障碍,这包括氧化应激增加,一氧化氮(NO)的生物利用度降低等。Hcy可自发氧化生成超氧阴离子和过氧化氢(H2O2),产生的氧化应激毒性损伤内皮细胞[17]。一氧化氮是内皮细胞分泌的一种重要的血管舒张剂,Hcy升高生成的H2O2可抑制NO裂解酶的活性,进而减少NO的产生并损害舒张功能,从而导致内皮细胞功能损伤[18]。内皮祖细胞是血管内皮细胞的前体细胞,参与血管新生和血管损伤后的修复过程。Hcy通过促进细胞周期蛋白A(cyclin A)的低甲基化和抑制cyclin A的表达来抑制内皮祖细胞的增殖,从而导致内皮功能障碍,促进动脉粥样硬化的形成[19]。(2)过量的Hcy可引起凝血及抗凝血功能的紊乱。Hcy使血管和血小板中血栓素A2(thromboxane A2,TXA2)活性增加,促进血小板的黏附,加速血栓形成[11]。Hcy氧化过程中产生的同型半胱氨酸硫内酯(homocysteine thiolactone,HTL)还可与反式视黄醇一起引起血小板凝集,导致血栓的产生[20, 21]。(3)可能机制涉及平滑肌细胞(smooth muscle cells,SMCs)的增殖。平滑肌细胞是构成血管壁组织结构并维持血管张力的主要细胞。Hcy可诱导SMCs的mRNA合成,促进SMCs增殖,从而导致血管壁增厚、结构破坏、舒张功能减弱,构成动脉粥样硬化的病理基础[22]。(4)可能机制涉及脂质代谢紊乱。Hcy氧化过程中产生的HTL还可与LDL中的载脂蛋白(Apo-B)的游离氨基酸形成肽键,使LDL的蛋白结构改变,导致细胞摄取、凝集,从而促进动脉粥样硬化的发生[23]。此外,过量的同型半胱氨酸还可通过促进蛋白质同型半胱氨酸化和Ca2+失调等方式直接损害神经元细胞和血脑屏障功能;还可诱导DNA低甲基化,加重细胞凋亡、神经元死亡和血脑屏障失调[24]。这些作用可促进脑实质组织的损伤和对缺血性卒中损伤的易感性,这可能是导致高同型半胱氨酸水平患者发生脑卒中风险增加的另一重要机制。
三、叶酸等B族维生素在心脑血管疾病中的研究及作用机制
体内的叶酸、维生素B6、B12等维生素在甲硫氨酸循环中起着非常重要的作用。研究显示,补充叶酸或者维生素B12等能降低心脑血管疾病的风险[25-27]。一项纳入82,334例参与者的随机对照试验结果表明,与对照组相比,补充叶酸对卒中的合并相对危险度为0.90(95% CI,0.84-0.96;p=0.002),可降低10%的中风风险[28]。同样的,一项纳入了14项随机对照试验,共有54,913名参与者的荟萃分析观察到,补充B族维生素后,使得同型半胱氨酸水平的降低,进而导致总体中风事件的减少(RR,0.93;95% CI,0.86-1.00;p=0.04)[29]。
叶酸等B族维生素在心脑血管疾病中的作用机制可能如下:(1)改善血管内皮功能:叶酸及其活性代谢物5-甲基四氢叶酸通过增加内皮一氧化氮合酶偶联和NO生成来提高NO的生物利用度,通过提高NO的生物利用度,叶酸可能改善内皮功能[30];此外,叶酸可以直接清除羟自由基和超氧阴离子自由基,发挥抗氧化应激作用,多项研究表明叶酸及其活性代谢物5-甲基四氢叶酸能显著改善氧化应激状态[31, 32],尤其5-甲基四氢叶酸具有更明显的抗氧化效应[33]。(2)DNA甲基化:叶酸可上调SAM/SAH、提高DNA甲基转移酶活性和表达、改变单核细胞趋化蛋白-1(MCP1)和血管内皮生长因子(VEGF)启动子甲基化以及抑制MCP1和VEGF表达来发挥抗动脉粥样硬化作用[34]。(3)降低Hcy水平:Hcy再甲基化的一条途径即以活性叶酸为甲基供体,维生素B12为辅助因子,叶酸等维生素缺乏时Hcy代谢受阻,可导致Hcy在体内蓄积,引发HHcy,服用叶酸等B族维生素可通过降低Hcy水平而预防心脑血管疾病的发生[35, 36]。(4)改善脂质代谢紊乱:血脂代谢失调是心脑血管疾病的一大危险因素,叶酸缺乏可诱导参与肝脏脂质合成的基因表达增加,包括乙酰辅酶a合成酶长链家族成员1(Acyl-CoA synthetase long-chain family member 1,ACSL1)、磷脂酸磷酸水解酶1(Lipin 1)、二酰基甘油O-酰基转移酶2(Diacylglycerol O-Acyltransferase 2,DGAT2)和ATP-柠檬酸裂解酶(ATP-citrate lyase,ACLY)[37]。动物实验表明,当给Apoe-/-小鼠喂食高脂肪叶酸缺乏的饮食时,血浆Hcy增加,导致斑块病变形成增加,并且促进动脉粥样硬化脂蛋白在主动脉内蓄积[38]。有研究表明,叶酸能通过恢复小鼠肝内腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)活性而改善胆固醇和血糖的代谢[39]。
四、甜菜碱在心脑血管疾病中的研究及作用机制
甜菜碱是甘氨酸甜菜碱的简称,是广泛存在于动物、植物、微生物体内的季胺型生物碱[40]。甜菜碱作为重要的甲基供体参与代谢,一分子甜菜碱可以提供三个甲基,在同型半胱氨酸再甲基化生成蛋氨酸的反应中提供一个甲基,生成二甲基甘氨酸(Dimethylglycine,DMG)。在线粒体中其余的两个甲基参与叶酸的代谢,用于生成N5,N10-二甲基四氢叶酸,甜菜碱的代谢终产物为氨基乙酸[41]。补充甜菜碱对心脑血管疾病的影响主要是通过降低Hcy的浓度来调节的[42]。目前普遍认为补充甜菜碱后甜菜碱依赖酶(BHMT)活性增加,可以有效的将同型半胱氨酸转化为蛋氨酸[43]。Damoon Ashtary-Larky等人通过检索截至2021年2月发表的“关于补充甜菜碱对心血管疾病的影响的研究”进行meta分析发现,无论高剂量(>4g/d)的或者低剂量(<4g/d)的甜菜碱补充均能显著降低Hcy浓度,但低剂量的甜菜碱补充(<4g/d)不会增加血脂含量[44]。临床研究显示,甜菜碱在遗传性因素(如酶缺陷)所致的高同型半胱氨酸血症的治疗中安全而有效[45],补充甜菜碱的长期治疗,可以有效的降低因胱硫醚β合成酶缺乏而致的高同型半胱氨酸血症,从而降低心血管疾病对生命的危险性[46]。
五、高同型半胱氨酸血症的预防与临床治疗前景
HHcy与心脑血管疾病的发生密切相关,日常生活中主要通过避免暴露于过量的半胱氨酸,适当减少肉类、鱼类和蛋类饮食来控制。而对于因营养因素缺乏导致的HHcy患者,采用叶酸治疗被认为是最经济有效的办法,但需注意的是叶酸缺乏及过量都可能引发疾病,故增补叶酸应根据个体差异如体重、合并症、基因型、年龄、性别、生活方式(膳食叶酸摄入和饮酒)等选择合适剂量和疗程,保证体内叶酸水平足量且不过量。《中国临床合理补充叶酸多学科专家共识》指出,一般人群叶酸补充的有效且安全剂量为0.4-1.0mg/d[47]。另有研究显示,每日服用0.8mg叶酸可以达到最佳的降低Hcy水平的作用,叶酸联合维生素B12可进一步降低Hcy水平[48]。而对于遗传因素,尤其是因酶缺陷所致的HHcy,补充叶酸等B族维生素的治疗效果尚存争议,而且如长期大量服用有可能导致神经变性等严重后果[49],但甜菜碱在遗传性因素所致的高同型半胱氨酸血症的治疗中发挥着安全而有效的作用。总的来说,采取补充叶酸等B族维生素和甜菜碱来降低Hcy水平对冠心病和脑卒中等心脑血管疾病的预防具有重要的意义,但应制定个体化方案以保证增补剂量安全合理。
参考文献
Ables G P, Hens J R, Nichenametla S N. Methionine restriction beyond life-span extension[J]. Ann N Y Acad Sci, 2016, 1363:68-79.
Pizzolo F, Blom H J, Choi S W, et al. Folic acid effects on s-adenosylmethionine, s-adenosylhomocysteine, and DNA methylation in patients with intermediate hyperhomocysteinemia[J]. J Am Coll Nutr, 2011, 30(1):11-18.
中国高血压防治指南修订委员会, 中国高血压联盟, 中华医学会心血管病学分会中国医师协会高血压专业委员会,等. 中国高血压防治指南(2018年修订版) [J]. 中国心血管杂志, 2019, 24(1): 24-56.
Tapeinos C, Gao H, Bauleth-Ramos T, et al. Progress in stimuli-responsive biomaterials for treating cardiovascular and cerebrovascular diseases[J]. Small, 2022, 18(36): e2200291.
Li N, Zhou H, Tang Q. Red Blood Cell Distribution Width: A Novel Predictive Indicator for Cardiovascular and Cerebrovascular Diseases[J]. Dis Markers, 2017, 2017:7089493.
Wang B, Mo X, Wu Z, et al. Systematic review and meta-analysis of the correlation between plasma homocysteine levels and coronary heart disease[J]. J Thorac Dis, 2022, 14(3):646-653.
Larsson S C, Traylor M, Markus H S. Homocysteine and small vessel stroke: A mendelian randomization analysis[J]. Ann Neurol, 2019, 85(4):495-501.
Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 385(9963):117-171.
Chan S H, Hung C H, Shih J Y, et al. Exercise intervention attenuates hyperhomocysteinemia-induced aortic endothelial oxidative injury by regulating SIRT1 through mitigating NADPH oxidase/LOX-1 signaling[J]. Redox Biol, 2018, 14:116-125.
Humphrey L L, Fu R, Rogers K, et al. Homocysteine level and coronary heart disease incidence: a systematic review and meta-analysis[J]. Mayo Clin Proc, 2008, 83(11):1203-1212.
Masoudkabir F, Sarrafzadegan N, Gotay C, et al. cardiovascular disease and cancer: Evidence for shared disease pathways and pharmacologic prevention[J]. Atherosclerosis, 2017, 263:343-351.
Li S, Sun L, Qi L, et al. Effect of High Homocysteine Level on the Severity of Coronary Heart Disease and Prognosis After Stent Implantation[J]. J Cardiovasc Pharmacol, 2020, 76(1):101-105.
Graeser M, Thieben F, Szwargulski P, et al. Human-sized magnetic particle imaging for brain applications[J]. Nat Commun, 2019, 10(1):1936.
Hankey G J. Secondary stroke prevention[J]. Lancet Neurol, 2014, 13(2):178-194.
Cao Y, Su N, Zhang D, et al. Correlation between total homocysteine and cerebral small vessel disease: A Mendelian randomization study[J]. Eur J Neurol, 2021, 28(6):1931-1938.
Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis[J]. JAMA, 2002, 288(16): 2015-2022.
Zhao J, Chen H, Liu N, et al. Role of Hyperhomocysteinemia and Hyperuricemia in Pathogenesis of Atherosclerosis[J]. J Stroke Cerebrovasc Dis, 2017, 26(12): 2695-2699.
Esse R, Barroso M, Tavares D A I, et al. The Contribution of Homocysteine metabolism Disruption to Endothelial Dysfunction: State-of-the-Art[J]. Int J Mol Sci, 2019, 20(4).
Zhang H P, Wang Y H, Ma S C, et al. Homocysteine inhibits endothelial progenitor cells proliferation via DNMT1-mediated hypomethylation of Cyclin A[J]. Exp Cell Res, 2018, 362(1):217-226.
Homme R P, Singh M, Majumder A, et al. Remodeling of Retinal Architecture in Diabetic Retinopathy: Disruption of Ocular Physiology and Visual Functions by Inflammatory Gene Products and Pyroptosis[J]. Front Physiol, 2018, 9:1268.
Gurda D, Handschuh L, Kotkowiak W, et al. Homocysteine thiolactone and N-homocysteinylated protein induce pro-atherogenic changes in gene expression in human vascular endothelial cells[J]. Amino Acids, 2015, 47(7):1319-1339.
Rong D, Liu J, Jia X, et al. Hyperhomocysteinaemia is an independent risk factor for peripheral arterial disease in a Chinese Han population[J]. Atherosclerosis, 2017, 263:205-210.
Weber G J, Pushpakumar S, Tyagi S C, et al. Homocysteine and hydrogen sulfide in epigenetic, metabolic and microbiota related renovascular hypertension[J]. Pharmacol Res, 2016, 113(Pt A):300-312.
[24] Lehotský J, Tothová B, Kovalská M, et al. Role of Homocysteine in the Ischemic Stroke and Development of Ischemic Tolerance[J]. Front Neurosci, 2016, 10:538.
Wang W W, Wang X S, Zhang Z R, et al. A meta-Analysis of Folic Acid in Combination with Anti-Hypertension Drugs in Patients with Hypertension and Hyperhomocysteinemia[J]. Front Pharmacol, 2017, 8:585.
Chernyavskiy I, Veeranki S, Sen U, et al. Atherogenesis: hyperhomocysteinemia interactions with LDL, macrophage function, paraoxonase 1, and exercise[J]. Ann N Y Acad Sci, 2016, 1363(1): 138-154.
Pan S, Lin H, Luo H, et al. Folic acid inhibits dedifferentiation of PDGF-BB-induced vascular smooth muscle cells by suppressing mTOR/P70S6K signaling[J]. Am J Transl Res, 2017, 9(3): 1307-1316.
Li Y, Huang T, Zheng Y, et al. Folic Acid Supplementation and the Risk of Cardiovascular Diseases: A meta-Analysis of Randomized Controlled Trials[J]. J Am Heart Assoc, 2016, 5(8).
Ji Y, Tan S, Xu Y, et al. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: a meta-analysis[J]. Neurology, 2013, 81(15): 1298-1307.
Stanhewicz A E, Kenney W L. Role of folic acid in nitric oxide bioavailability and vascular endothelial function[J]. Nutr Rev, 2017, 75(1): 61-70.
Ibrahim W, Tousson E, Ali E M, et al. Folic acid alleviates oxidative stress and hyperhomocysteinemia involved in testicular dysfunction of hypothyroid rats[J]. Gen Comp Endocrinol, 2011, 174(2):143-149.
Ebaid H, Bashandy S A, Alhazza I M, et al. Folic acid and melatonin ameliorate carbon tetrachloride-induced hepatic injury, oxidative stress and inflammation in rats[J]. Nutr metab (Lond), 2013, 10(1):20.
Pathikkal A, Puthusseri B, Divya P, et al. Folate derivatives, 5-methyltetrahydrofolate and 10-formyltetrahydrofolate, protect BEAS-2B cells from high glucose-induced oxidative stress and inflammation[J]. In Vitro Cell Dev Biol Anim, 2022, 58(5):419-428.
Cui S, Li W, Lv X, et al. Folic Acid Supplementation Delays Atherosclerotic Lesion Development by Modulating MCP1 and VEGF DNA Methylation Levels In Vivo and In Vitro[J]. Int J Mol Sci, 2017, 18(5).
Debreceni B, Debreceni L. The role of homocysteine-lowering B-vitamins in the primary prevention of cardiovascular disease[J]. Cardiovasc Ther, 2014, 32(3):130-138.
Essouma M, Noubiap J J. Therapeutic potential of folic acid supplementation for cardiovascular disease prevention through homocysteine lowering and blockade in rheumatoid arthritis patients[J]. Biomark Res, 2015, 3:24.
Champier J, Claustrat F, Nazaret N, et al. Folate depletion changes gene expression of fatty acid metabolism, DNA synthesis, and circadian cycle in male mice[J]. Nutr Res, 2012, 32(2):124-132.
Da S R, Kelly K B, Al R A, et al. Novel insights on interactions between folate and lipid metabolism[J]. Biofactors,2014,40(3):277-283.
Sid V, Wu N, Sarna L K, et al. Folic acid supplementation during high-fat diet feeding restores AMPK activation via an AMP-LKB1-dependent mechanism[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 309(10): R1215-R1225.
Chen A, An Y, Huang W, et al. Highly Water-Preserving Zwitterionic Betaine-Incorporated Collagen Sponges With Anti-oxidation and Anti-inflammation for Wound Regeneration[J]. Front Cell Dev Biol, 2020, 8:491.
Hartiala J A, Tang W H, Wang Z, et al. Genome-wide association study and targeted metabolomics identifies sex-specific association of CPS1 with coronary artery disease[J]. Nat Commun, 2016, 7:10558.
Johnson A R, Craciunescu C N, Guo Z, et al. Deletion of murine choline dehydrogenase results in diminished sperm motility[J]. FASEB J, 2010, 24(8):2752-2761.
Kempson S A, Zhou Y, Danbolt N C. The betaine/GABA transporter and betaine: roles in brain, kidney, and liver[J]. Front Physiol, 2014, 5:159.
Ashtary-Larky D, Bagheri R, Ghanavati M, et al. Effects of betaine supplementation on cardiovascular markers: A systematic review and meta-analysis[J]. Crit Rev Food Sci Nutr, 2022, 62(23):6516-6533.
Ilyas A, Wijayasinghe Y S, Khan I, et al. Implications of trimethylamine N-oxide (TMAO) and Betaine in Human Health: Beyond Being Osmoprotective Compounds[J]. Front Mol Biosci, 2022, 9:964624.
中国医药教育协会临床合理用药专业委员会, 中国医疗保健国际交流促进会高血压分会, 中国妇幼保健协会围产营养与代谢专业委员会, 等. 中国临床合理补充叶酸多学科专家共识[J]. 医药导报, 2021, 40(1):1-19.
Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials[J]. Am J Clin Nutr, 2005, 82(4):806-812.
Kabagambe E K, Lipworth L, Labadie R F, et al. Erythrocyte folate, serum vitamin B12, and hearing loss in the 2003-2004 National Health And Nutrition Examination Survey (NHANES)[J]. Eur J Clin Nutr, 2018, 72(5):720-727.




