精密度和正确度与可报告范围验证自动化系统的建立及临床应用评价

张秀明,主任技师。现任深圳市罗湖医院集团副院长、检验医学中心主任,中国合格评定国家认可委员会ISO15189医学实验室认可主任评审员,广东省医疗安全协会检验医学分会主任委员,广东省医学会检验医学分会副主任委员,广东省健康管理协会检验专业委员会副主任委员,广东省肝病学会检验医学专业委员会副主任委员,《中华检验医学杂志》等专业杂志编委或常务编委。长期从事临床检验和实验室管理工作,曾任新乡医学院第二附属医院检验科主任,广东省中医院检验科主任,中山大学附属中山医院检验医学中心主任。以第一作者或通讯作者发表学术论文130余篇,其中SCI收录11篇,CA收录2篇。主编《现代临床生化检验学》、《临床生化检验诊断学》、《临床检验方法学评价》等专著9部。主持和参与国家、省、市级科研课题12项,获省部级科技进步奖6项。
【摘要】目的 通过建立和应用自动化系统实现临床实验室精密度、正确度和可报告范围的验证,为验证前期实验方案选择和验证后期数据处理等提供便利。方法 系统采用B/S架构,基于JAVA+R语言开发,采用Spring+Shiro+Snakerflow技术框架,以Redis为缓存数据库,MySQL5.7为业务数据库,参考美国CLSI中EP5-A3、EP15-A3、EP9-A3、EP6-A2和国内WS/T492-2016《临床检验定量检测项目精密度与正确度性能验证》及WS/T 420-2013《临床实验室对商品定量试剂盒分析性能的验证》等性能验证标准,将计算公式内置于系统,建立临床实验室自动化的定量检验项目的精密度、正确度和可报告范围验证性能评价系统。结果 临床实验室自动化性能评价系统包括精密度、正确度和准确度验证模块,每个模块下包括多个性能评价方案。结论 将数据采用多种方式导入系统,通过系统计算得出性能评价结论。
按照CNAS-CL02:2012《医学实验室质量和能力认可准则》[1]中“5.5.1.2 检验程序验证”要求:在常规应用前,应由实验室对未加修改而使用的已确认的检验程序进行独立验证。因此,实验室应作为性能验证的主要实施方,验证只适用于未加修改的已经过检测系统厂家确认过的程序。按照CNAS-CL02-A001:2021《医学实验室质量和能力认可准则的应用要求》[2]中“5.5.1.2 检验程序验证”要求:定量检验程序的分析性能验证内容至少应包括正确度、精密度和可报告范围。因此,在申报ISO 15189认可的实验室中,所申报的项目必须是包含以上三种检验程序的性能验证。
一、临床实验室自动化性能评价系统概述
深圳市罗湖医院集团医学检验实验室在2017年开始建立ISO 15189体系,2019年10月顺利通过ISO 15189初次评审,随后又通过了监督评审和复评审,截止2022年3月,总认可项目达到203项,居国内前列。在体系建立初期,实验室开展的性能验证的实验数据通过Excel、SPSS等软件进行计算得出数据,再带入性能评价报告中判断是否符合性能要求,操作过程复杂,实施不方便。自2018年上线临床实验室自动化性能评价系统后,实验数据一键导入,结果一键计算,为实验室提供了便利,该系统共有8个模块,共30个实验方案,涵盖了临床实验室精密度、正确度、准确度及可报告范围等性能验证和确认方案,以及测量不确定度评定功能,主界面如下图:

二、精密度验证方案的建立与临床应用
精密度(Precision)[3]是指在规定条件下,分析方法对同一样本进行重复测量,相互独立的检测结果间的一致程度,也被称为随机分析误差,精密度验证应包括重复性和中间精密度,精密度验证常用有Westgard精密度实验方案和EP15-A3[4]精密度实验方案[5]。Westgard精密度实验方案:最好选择2-3个代表研究项目医学决定水平浓度的低值和高值实验样本,分别做批内和天间重复测定。批内评价,将样品随机插入到病人样品中检测,连续做20次,计算批内精密度;在批内精密度符合要求的情况下,进行天间精密度实验,天间是每天做1次评价样品,连续做20次,确定天间精密度是否可以接受。EP15-A精密度实验方案:每天分析一批,每批重复测定3次(EP15-A2方案)或5次(EP15-A3方案),每天两个浓度水平,连续测定5天,每个浓度分别获得15条数据或25条数据,将数据导入性能评价系统中。下面以葡萄糖Westgard精密度验证实验为例,将实验数据导入后,通过试剂管理系统、设备管理系统及人员管理系统将实验基本信息导入,支持性能标准选择可基于实验室指定、基于允许总误差(Tea)、基于厂商声明参数和基于生物学变异来设定,原始数据通过附件上传到数据界面(如图1)。
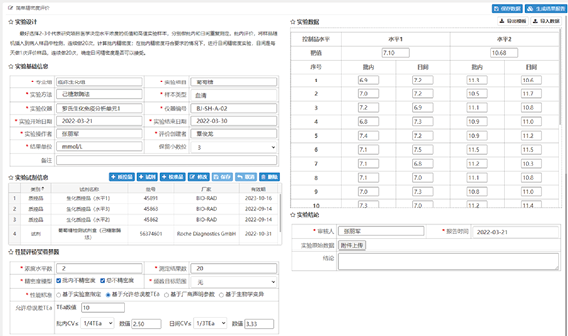
图1. 原始数据上传界面
实验人员点击“生成结果报告”即可形成性能验证报告,报告中给出验证结论及数据统计散点图和频数分布图等(如图2)。
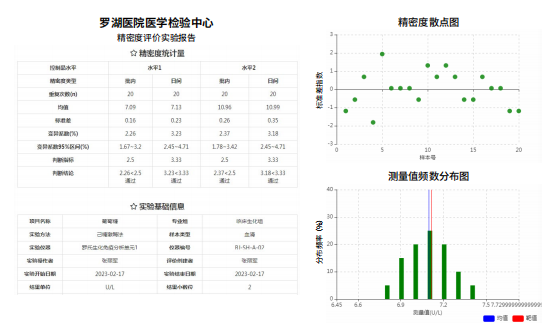
图2. 报告中给出验证结论与数据统计散点图及频数分布图
三、正确度验证方案建立与临床应用
正确度(Trueness)[3]:完整的表述应是测量正确度,是大批量检测结果的均值与真值的一致程度。正确度是定性概念,通常用与正确度相反的统计量“偏倚”来表示。正确度验证常用EP15-A3[4]正确度实验方案,该方案提供两种程序来核实正确度:一是用病人样本进行方法学比对;二是通过检测定值的参考物质来计算回收率。前者收集20份病人样本,其浓度应分布整个线性范围,在3至4天内,用实验方法和比较方法分别检测,每天测定5至7个,共得到实验方法和参考方法各20个数据,通过判断偏倚或百分偏倚小于厂商声明的标准,则验证通过。后者所谓的参考物质的来源有:1、新鲜冰冻人血清或者其他一些未掺入成分的材料(有证参考物质);2、能力验证实验(PT)中获得的参考物;3、厂商提供的正确度确认物或质控物;4、室间质量评价计划中使用的质控物;5、第三方提供的已用不同方法定值的物质。通过参考物质来源进行回收率实验,每天进行1个批次实验,每批重复测2次,连续测5天,共得到10个数据,通过计算得出验证区间的上下限,最终判定能力验证区间是否包含同组实验室均值,如包含则验证通过。
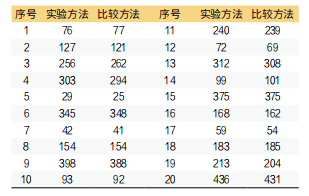
下面通过葡萄糖项目利用病人样本进行方法学比对的正确度验证为例,实验方法和参考方法各检测20次数据如表1。
表1. 实验方法和参考方法各检测20次数据
将实验数据导入后,输入厂商声明的偏倚为3%,点击计算结果即可生成性能验证报告,包含评价结论和线性回归图,如图3所示。
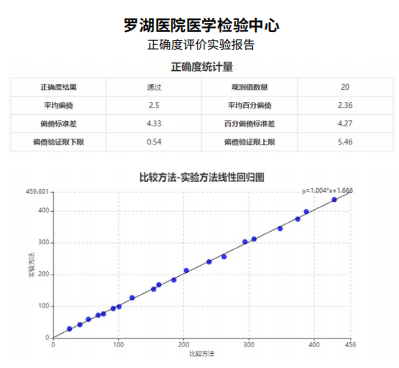
图3. 评价结论与线性回归图
四、可报告范围验证方案的建立与临床应用
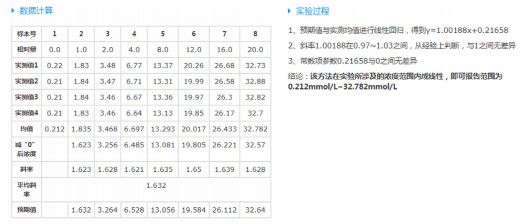
临床可报告范围[6](Clinical reportable range,CRR)指定量检测项目向临床能报告的检测范围,患者样本可经稀释、浓缩或其他预处理。常用验证方案包括平均斜率法、线性稀释回收法、最大稀释度评价等,下面以葡萄糖可报告范围评价的平均斜率法举例,操作方法:收集含低浓度分析物的病人样本血清,离心后一分为二。在一份混合样本中加入高浓度被测分析物储存液,加入体积不超过混合样本体积的1/10,但又可使样本中分析物浓度达到高限,充分混匀后为高值(H)样本。在另一份混合样本中加入配置分析物储存液的溶剂,加入量为前一份样本中加入的储存液体积,充分混匀后为低值(L)样本。按1L、0.95L+0.05H、0.9L+0.1H、0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、1H配置方法,制成8个不同浓度的系列评价样本。在生化分析仪上重复测定4次,在1天内完成,共生成32个数据。将预期值为X,测量均值为Y,通过系统作散点图并形成回归线。计算回归结果斜率与1之间有无差异,截距与0之间有无差异,从而判断可报告范围,如表2为葡萄糖可报告范围案例。
表2. 葡萄糖可报告范围实例
五、不足与展望
精密度、正确度和可报告范围的验证作为实验室定量检验项目性能评价中最基本的要求,临床实验室自动化性能评价系统做为一款辅助工具,员工不需要太多的计算机应用技能,简易上手完成性能评价,能帮助实验室在质量上得到有效提升,助力实验室更快速通过ISO 15189认可。
但实验数据录入方式比较耗费时间,需要通过Excel模板导入完成,如能与LIS系统或仪器对接,通过条码号或者标本号获取实验数据,一来可以减少手工录入数据的繁杂过程,二来对数据的真实性提供了很好的保证,无需再提供原始材料来作为实验真实性的佐证。
参考文献
CANS-CL02: 2012医学实验室质量和能力认可准则[S], 北京: 中国合格评定国家认可委员会, 2012.
CNAS-CL02-A001: 2021医学实验室质量和能力认可准则的应用要求[S], 北京: 中国合格评定国家认可委员会, 2021.
WS/T 492-2016临床检验定量测定项目精密度与正确度性能验证[S], 中华人民共和国国家卫生和计划生育委员会, 2016.
CLSI.User Verification of Precision and Estimation of Bias; Approved Guideline Third Edition(EP15-A3)[S]. 2014.
张秀明, 黄宪章, 刘忠民等. 临床生化检验诊断学[M]. 北京: 人民卫生出版社, 2012: 504.
张秀明, 黄宪章, 刘忠民等. 临床生化检验诊断学[M]. 北京: 人民卫生出版社, 2012: 540.




