血清淀粉样蛋白A在雅培C16000全自动生化分析仪上检测的性能评价

毛小欢,毕业于广西医科大学,获临床检验诊断学硕士学位,现任河南省人民医院检验科副主任检验师;主要从事实验室质量管理和生化、免疫检验工作。
【摘要】目的 评价安图生物工程有限公司血清淀粉样蛋白A(serum amyloid A protein,SAA)试剂在雅培C16000全自动生化分析仪上检测的分析性能是否符合厂家声明并满足临床需求。方法 参考CNAS-GL037:2019文件、WS/T 420-2013文件以及NCCLS EP6-A文件,对SAA试剂测量结果的正确度、重复性不精密度、中间不精密度、线性范围、可报告范围、参考区间等性能进行验证,并将其验证结果与厂商声明的性能和中华人民共和国卫生行业标准进行比较。结果 正确度验证:5份PT样本的偏倚均<1/2 TEa;精密度验证:两个水平的重复性不精密度分别为1.85%,0.81%,两个水平的质控品的中间不精密度分别为2.00%、0.89%,均<1/3 TEa;线性范围验证:浓度在5.1mg/L至301.5mg/L之间为线性区间;可报告范围上限为6030mg/L,且厂家提供的生物参考区间可以接受。结论 血清淀粉样蛋白A试剂在雅培C16000全自动生化分析仪上检测的正确度、精密度、线性范围、可报告范围、参考区间等性能均符合要求,主要分析性能达到了厂商声明的性能和有关的质量要求,可满足临床需要。
【关键词】质量管理; 性能评价; 血清淀粉样蛋白A
血清淀粉样蛋白A(serum amyloid A protein,SAA)是组织淀粉样蛋白A的前体物质,当受到细菌、病毒、支原体等刺激后,水平迅速升高[1, 2]。细菌感染导致SAA水平升高速度较CRP升高更早,且上升幅度更大,具有更高的敏感性和特异性[3]。本文研究评价安图生物工程有限公司SAA试剂在雅培C16000全自动生化分析仪上检测的正确度、精密度、线性区间、可报告范围及参考区间等性能是否符合厂家声明并满足临床需求[4]。
一、材料与方法
1. 材料:(1)样本:正确度验证选用国家卫健委临检中心室间质评样本,血清样品取自门诊和住院送检样本。(2)仪器设备:美国雅培C16000全自动生化分析仪,状态正常。(3)试剂和标准品:试剂、标准品以及稀释剂由安图生物提供;质控品由英国朗道实验诊断有限公司提供。
2. 方法:(1)正确度验证:参考《临床化学定量检验程序性能验证指南(CNAS-GL037)》,选用国家卫健委临检中心室间质评(PT)样本5份,每个质控品测定3次,将均值与室间质评报告中回馈的相应可接受限进行比较,如果5份PT样本中有4份及以上的实验结果在总允许误差范围(TEa)的1/2之内,则判断正确度验证通过。(2)精密度验证:精密度用不精密度来表达,本实验同时验证了重复性不精密度和中间不精密度。(3)重复性不精密度:参考《临床化学定量检测程序性能验证指南(CNAS-GLO37)》,选择正常和异常值2个水平的质控品,在同一批次内重复测定10次,计算均值,标准差和变异系数,批内不精密度<1/4 TEa为通过验证。(4)中间不精密度:参考《临床实验室对商品定量试剂盒分析性能的验证(WS/T 420-2013)》,选择包含医学决定值水平的两个浓度水平的质控品,一个工作日测量一个批次,每一批次对各浓度样本分别重复测量3次,连续测定5天,每一批次测量前均应检测质控品保证室内质控在控,离群值的剔除以不超出总均值±4SD为准,总剔除量要小于数据量的5%,中间不精密度<1/3 TEa为通过验证。(5)线性区间验证:参考CNAS-GLO37文件来进行样本的检测和数据的收集计算。选择无溶血、脂血或黄疸的高浓度和低浓度样本各一份,按照L、4L+1H、3L+2H、2L+3H、L+4H、H的稀释方式配置浓度梯度检测样本。每个样本重复测定3次,计算均值进行多项回归分析,如果实验结果为一阶方程式,则最低值与最高值之间为线性区间,此区间覆盖厂家声明的线性范围则线性区间验证通过。(6)可报告范围验证:参考CNAS-GLO37文件,选取接近项目线性范围上限的样本3个,用生理盐水对所选取样本分别以不同稀释度进行稀释(5倍、10倍、20倍、50倍)后,每个样本重复测定3次,计算样本检测浓度平均值和理论值,并计算相对偏差,以偏差<1/2 TEa的最大稀释倍数为本实验的最大可稀释倍数,将最大稀释倍数与线性范围上限相乘,得到可报告范围上限。(7)生物参考区间验证:参考WS-T 402-2012文件,验证厂家说明书提供的参考区间。随机抽取体检健康人样本男、女各20份,排除已知疾病,体重在健康范围内,有适当的年龄和性别分布。若≥90%实验对象的测定结果在参考区间内视为参考区间验证通过。
3. 统计分析:统计学用Excel 2007或SPSS 16.0软件进行变异系数、正确度、线性范围的相关分析和回归分析。
二、研究结果
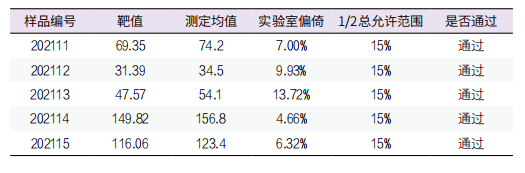
1. 正确度验证:选用国家卫健委临检中心室间质评(PT)样本5份,每个质控品测定3次,将均值与室间质评报告中回馈的相应可接受限进行比较,SAA总允许范围为30%,5份PT样本的偏倚均小于15%(即1/2 TEa),正确度验证通过,见表1。
表1. SAA正确度验证表
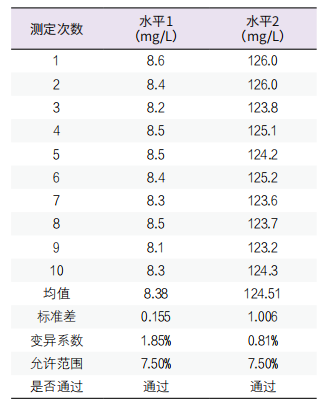
2. 重复性不精密度验证:选择正常和异常值2个水平的质控品,在同一批次内重复测定10次,计算均值,标准差和变异系数,以重复性不精密度<7.50%(即1/4 TEa)为标准,两个水平的重复性不精密度分别为1.85%,0.81%,重复性不精密度通过验证,见表2。
表2. 重复性不精密度验证表
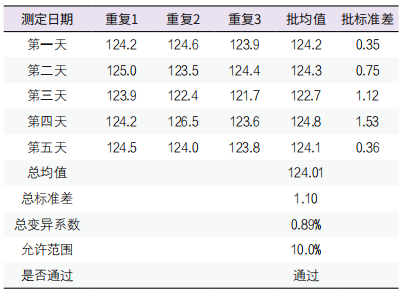
3. 中间不精密度验证:选择包含医学决定值水平的两个浓度水平的质控品,一个工作日测量一个批次,每一批次对各浓度样本分别重复测量3次,连续测定5天,两个水平的质控品的中间不精密度分别为2.00%、0.89%,均<10%(即:1/3 TEa),中间不精密度通过验证。见表3、表4。
表3. 水平1质控品中间不精密度验证表
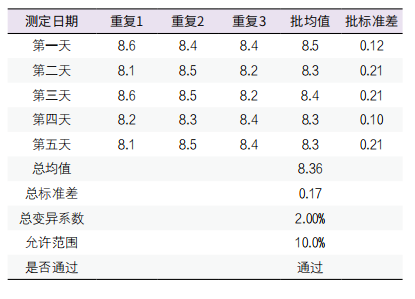
表4. 水平2质控品中间不精密度验证表
4. 线性区间验证:按照L、4L+1H、3L+2H、2L+3H、L+4H、H的稀释方式配置浓度梯度检测样本。每个样本重复测定3次,见表5。计算均值进行多项回归分析,结果为一阶方程式,SAA浓度在5.1mg/L至301.5mg/L之间为线性区间,此区间覆盖厂家声明的线性范围,回归曲线相关度较高(R²=0.9991)。线性区间验证通过,见图1。
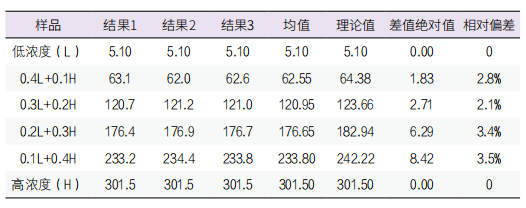
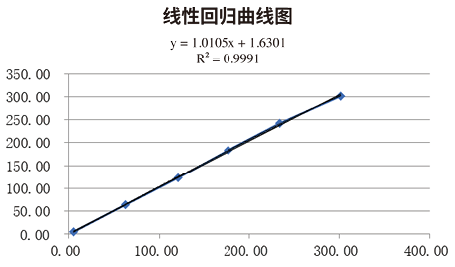
图1. 线性回归曲线图
5. 可报告范围验证:选取接近项目线性范围上限的样本3个,用生理盐水对所选取样本分别以不同稀释度进行稀释(5倍、10倍、20倍、50倍),最大稀释倍数为50倍,可报告范围上限为6030mg/L,见表5。
表5. 最大可稀释倍数验证表
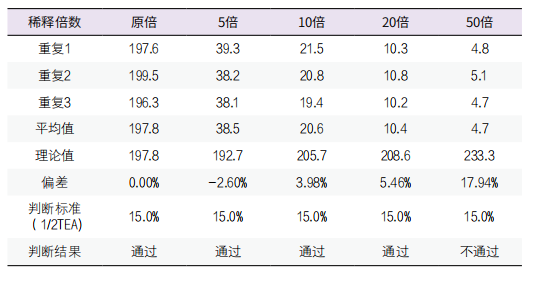
6. 生物参考区间的评价:实验室的生物参考区间参考厂家试剂说明书提供的参考区间设置为0-10mg/L,生物参考区间的评价时,随机抽取体检健康人样本男、女各20份,检测结果表明40份健康个体样本检测结果均在本实验室设定的生物参考区间内,证明厂家提供的生物参考区间可以接受。
三、讨论与分析
性能评价是中国合格评定国家认可委员会(CNAS)-CL02《医学实验室质量和能力认可准则》即ISO15189:2012中重要的技术要求[5],也是临床实验室管理的重点。性能评价是该检测系统能否可以应用到临床工作的前提和依据,在临床检验中,实验室应通过一系列验证程序,对检测系统的性能进行评价,判断该检测系统能否达到使用预期,满足临床检验工作相关要求[6]。
正确度是指在一定实验条件下多次测定的平均值与真实值相符合的程度,正确度验证的方法,包括:偏倚评估、回收实验、与参考方法比对;本实验属可比性验证,选用国家卫健委临检中心室间质评(PT)样本5份,每个质控品测定3次,将均值与室间质评报告中回馈的相应可接受限进行比较,具有获取方便、操作简单的特点,是实验室常见的验证方案[7]。精密度是反映检测系统的稳定性和一致性,是整体性能的首要指标,也是进行其他方法学评价实验的前提[8, 9],精密度一般用不精密度来表示,重复性不精密度,反映的是检测系统在同一条件下的变异情况;中间不精密度,反映的是实验室在一段时期内,该检测系统的稳定性[10]。本实验重复性不精密度参考CNAS-GLO37文件,中间精密度的验证,参考WS/T 420-2013文件,采用每个水平标本重复测量3次连续测定5天(即,3×5方案)。该方案具有周期短、所需检测数目少的优点,是目前常用的评价精密度的方法之一[11]。
本研究结果表明,安图生物工程有限公司SAA试剂在雅培C16000全自动生化分析仪上检测的精密度符合厂商的声明,且符合卫生行业标准相关的要求,稳定性良好。分析性能评价结果与厂商规定的分析性能基本相符,符合质量目标要求。
参考文献
ZHONG P, ZHANG H, CHEN X, et al. Clinical characteristics of the lower respiratory tract infection caused by a single infection or coinfection of the human parainfluenza virus in children[J]. J Med Virol, 2019, 91(9): 1625-1632.
吴艳云. 超敏C反应蛋白与血常规联合检测在小儿细菌性肺炎、病毒性肺炎和支原体肺炎诊断中的临床应用价值[J]. 临床检验杂志(电子版), 2019,8(2): 83-84.
血清淀粉样蛋白A检测在肺炎支原体肺炎中的诊断价值[J]. 冼肖英; 丁燕玲. 中国医药导报, 2020 (07).
WS/T 403-2012. 临床生物化学检验常规项目分析质量指标. 中华人民共和国卫生部[S]. 2012-12-25.
中国合格评定国家认可委员会. CNAS-C02医学实验室质量和能力认可准则 (ISO15189: 02) [S]. 北京: 中国标准出版社, 2012.
张秀明. 浅析定量检验程序分析性能验证实验方案设计[J]. 中华检验医学杂志, 2015, 38 (6): 428-430.
郭绪晓, 柏淑美, 凌欣, 高洁, 李金星. 能力验证/室间质量评价标本在电化学发光检验程序正确度验证中的应用[J]. 检验医学, 2019(09).
王治国. 临床检验方法确认与性能验证 [M]. 北京: 人民卫生出版社, 2009:164.
毛小欢, 吕毅, 董海波. 贝克曼全自动生化分析仪15项生化检测项目的性能评价[J]. 实验与检验医学, 2019(06).
WS/T 492-2016. 临床检验定量测定项目精密度与正确度性能验证.中华人民共和国国家卫生和计划生育委员会[S]. 2016-07-07.
欧元祝, 陈宝荣, 居漪. 临床化学检测的标准化现状[J]. 检验医学, 2021(03).




