人类致病性病毒的污水监测方法与传染性疾病的爆发预警和流行趋势预测

庞晓莉,博士、教授/研究员。中国南京东南大学医学学士学位、芬兰坦佩雷大学医学病毒学博士、美国疾病控制和预防中心(CDC)和美国国立卫生研究院(NIH)的访问学者。现任阿尔伯塔大学检验医学和病理学系的教授,阿尔伯塔省精密实验室分子病毒学家和项目负责人;阿尔伯塔大学李嘉诚病毒学研究所的首席研究员,阿尔伯塔省废水监测和阿尔伯塔省儿童肠道感染项目(APPETITE)的联合负责人。其专业研究重点是病毒病因学、临床诊断学、分子流行病学、水传播病毒性疾病和环境病毒学。研究兴趣涵盖具有高流行潜力的各种重要的人类和环境病毒。在COVID-19大流行期间,为省和全国 SARS-CoV-2 的废水流行病学监测(WBS)做出了重大贡献。发表论著160多篇和书籍章节。

汤一苇,复旦大学上海医学院医学学士、流行病学硕士、美国范德堡大学微生物学和免疫学博士、美国微生物学院院士、美国传染病协会会士、美国微生物学会新冠病料馆馆员。《Journal of Clinical Microbiology》共同主编、《Journal of Molecular Diagnostics》和《Emerging Microbes and Infection》副主编。现任丹纳赫集团/赛沛中国首席医学官、美国临床和实验室标准研究所分子诊断专家组委员。曾是美国疾病控制中心访问学者、梅约医学中心住院医师、范德堡大学医学院教授、美国纪念斯隆凯特琳肿瘤医院主任医师和临床微生物科主任、康奈尔大学医学院教授、海外华人微生物学会主席、美国食品和药品管理局医疗器械咨询委员会委员。发表相关科研论文、综述和专著近400篇。

余启昆,西南大学家蚕基因组学国家重点实验室微生物学硕士,主修人类病原微生物方向。现任丹纳赫集团/贝克曼库尔特产品专员,负责华东区相关产品的产品管理和支持。曾参与组织业内多家头部病毒载体相关企业,协助中国食品药品检定研究院做出世界上第一个AAV空壳系统适应性标准品。发表多篇相关科研论文,目前2项产品相关专利正在申请沟通中。
【摘要】随着全球人口城市化及流动加剧,新发性传染病在全球范围内流行造成巨大的社会和经济负担。污水是一种包含多种生物和化学标志物重要信息来源。污水监测可用于传染病爆发提前预警,监控疾病爆发趋势及动态变化,作为一种重要的独立、互补的方法学越来越多被世界各国所关注。特别是新冠爆发以来,通过污水监控可以获得社区乃至社会层面的爆发信息,这对于其防控及预警至关重要。在应对临床前或无症状感染者时,污水监测相较于临床检测优势显著。本文从多个维度系统性从污水监测概念、优势、监测人类病毒类型、污水样本特点、采样分布及富集检测等诸多方面进行综述及讨论。污水中病毒颗粒含量极低且成分复杂,需要搭配高回收率病毒富集方式和高灵敏度检测手段,从而为疾病爆发预警及流行趋势监测成为可能。
【关键词】污水;污水监控;预警;病毒;富集;检测
在漫长的人类历史长河中,人类进化史就是一部和微生物病原体抗争的历史[1]。步入21世纪,伴随着城市化进程加快、人口高度集中及全球人口迁移及流动促进了病毒传播和爆发,例如SARS(2003)、甲流H1N1(2009)、埃博拉病毒(2014)、寨卡病毒(2015)、SARS-CoV-2(2019)和猴痘病毒(2022)等,人口越稠密的地区风险越高[2]。传统监控手段过度依赖于点对点筛查如临床症状等,这些方法虽然具有高灵敏度和特异性,但在应对大规模人群筛查,该方法不仅费时费力,而且经济上实现难度较大,当遇到临床检测能力不足或者不可用时,情况将变得尤为挑战。甚至其中许多病毒会导致无症状感染/排毒,这也增加了点对点筛查难度,使得流行情况难以估计。污水监测(wastewater surveillance)的基本原理是基于特定微生物病原体的排泄模式,受感染个体会在长达数周时间内通过粪便排出病毒,无论他们是否有临床症状。例如,大多数感染新冠病毒或者肠道病毒的人在出现症状之前和之后会从粪便中排出大量病毒[3]。因此,开发一种经济、高效、灵活、独立且能够与现有方法强力互补的监测手段尤为重要。基于污水监测病毒流行的方法越来越受到重视,主要原因在于该方法可覆盖大量人群,为相关疫情爆发提供预警信号、监控疫情动态发展变化及评估干预后的效果等。病毒通常会从血液、唾液、分泌物、粪便和尿液等体液中渗入污水。传染病爆发早期预警对于阻止其传播至关重要,而基于污水监测的污水流行病学(Wastewater-based epidemiology)是一门很有前途的全人群传染病监测的新兴学科,它能够监测污水中不同类型传染源存在、预警疾病爆发。它考虑了有症状和无症状患者,不仅可以提供有关确诊病例活动的信息,而且还可用于衡量疾病的流行情况。
一、污水监测概述
污水作为一种包含多种生物和化学标志物重要信息来源,对污水的研究历史由来已久,早期主要集中在分析化学品、外源性污染物等,分析的主要重点通常是确定进入污水处理过程的药物浓度,监测废水处理过程的去除效率等。基于污水可用于分析违禁药物(如甲基苯丙胺[4]、海洛因[5]、大麻[5]、氯胺酮等[6])、合法药物(咖啡因[7, 8]、酒精[9]、烟草[10, 11])、个人护理产品(苯二氮卓类药物[12, 13]、抗抑郁药[14]、抗生素[15, 16]和其他抗微生物制剂[17])及工业化学品(杀虫剂[18, 19]、增塑剂[20])的使用情况,相关化学标志物已经得到了广泛的研究。研究学者将污水中这些化学标志物浓度与人口规模使用、消耗或接触率联系起来,进而可以提供关于特定污水流域内居民活动重要定性或定量信息[21]。
在病原体领域,污水监测可监测病原体如细菌、病毒、真菌和原生动物病原体等,也可用于追踪或监测特定社区内传染性病原体的传播趋势。在多重耐药菌方面,污水代表了人类相关菌群的复合体,如病原体、抗生素耐药细菌(ARB)和抗生素抗性基因(ARG)等[22, 23]。通过污水监测特定社区可确定抗生素耐药性的基本水平,为抗生素合理使用和抗生素污水处理提供宝贵参考信息及评估干预措施的效果。污水监测更可用于选定人群,这些人群被怀疑存在相应的监测缺陷,且存在使人群面临对应病毒传播风险。需要注意的是,关于污水环境监测(environmental surveillance),其研究内容与污水监测类似,只是命名有所不同。污水监测用于传染病监测是一个新兴热点领域,引起了越来越多全球关注。
二、基于污水监测人类病毒
能够感染人类的病毒非常多,为了便于叙述,根据其传播途径,我们简单划分为粪-口传播类型病毒、呼吸道/接触传播病毒及虫媒传播病毒。各种通过粪口传播的病毒,如诺如病毒、埃可病毒、柯萨奇病毒、爱知病毒、星状病毒、轮状病毒、甲型和戊型肝炎病毒等。这些病毒可引起散发病例或广泛性暴发,从轻微到严重的胃肠炎到脑膜炎、呼吸系统疾病、结膜炎、瘫痪或肝炎等[24]。呼吸道/接触传播病毒以新冠为例,新冠爆发以来中国香港及世界各国大多都启动了污水监测相关研究。据相关数据统计,新冠在全球范围内造成了近6.83亿例感染,近680万人死亡(https://www.worldometers.info/coronavirus)。由于人类病毒感染者会在粪便或分泌物中释放病毒核酸,这就为污水监测提供了先决条件(图1)。
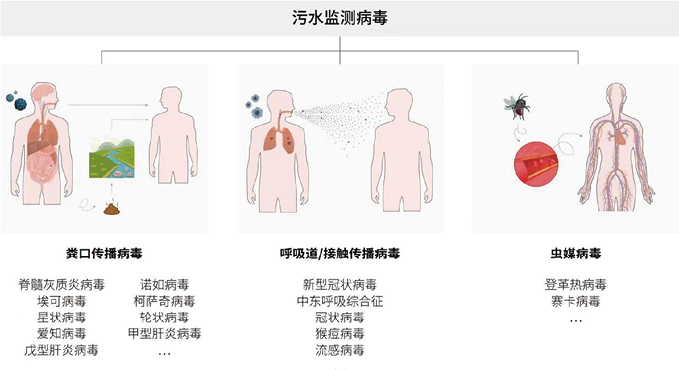
图1. 基于污水监测病毒传播
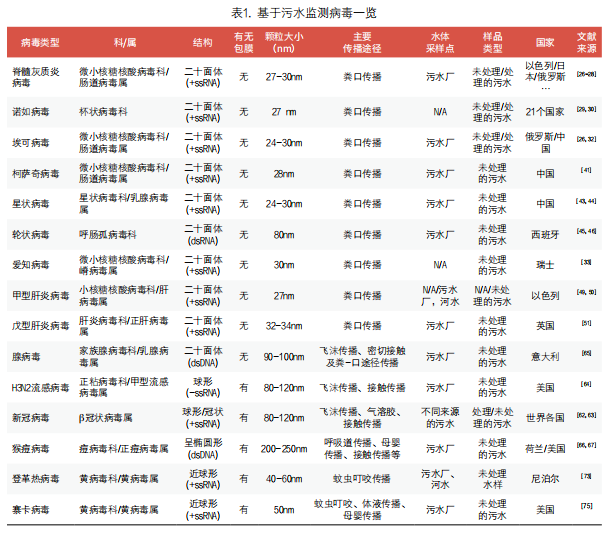
1. 基于污水监测粪-口传播病毒:粪口传播即病毒经肠道排出后,污染食物和饮水而经口传播的方式,脊髓灰质炎病毒、诺如病毒、埃可病毒、柯萨奇病毒、星状病毒、轮状病毒、爱知病毒、甲型肝炎病毒及戊型肝炎病毒等皆可通过粪口途径进行传播。通过污水监测对各种粪口传播病毒进行监测目前已有大量报道(表1)[25-35]。例如,脊髓灰质炎病毒被认为可在肠旁粘膜下淋巴组织中复制持续数周至数月,病毒可通过粪便排泄到环境中[36]。脊髓灰质炎病毒在环境温度下的水溶液中相对稳定,可吸附于环境中各种固相杂质上从而可能进一步延长其感染活性[36]。早在1991年Gina等在发现3个病例后,便通过社区污水病毒学分析方法来监测高风险社区内野生脊髓灰质炎病毒持续无症状的传播。在高风险社区直接采集污水样本也可以提供进一步的证据,证明当地是否已根除野生脊髓灰质炎病毒感染[25]。在2003年WHO就提出将污水监测脊髓灰质炎病毒作为一种强有力的补充手段[37]。例如,Olga E等追踪了从2004-2017年长达14年莫斯科脊髓灰质炎病毒和其他肠道病毒环境监测的数据,他们发现除一种脊髓灰质炎病毒分离株外,其余均为萨宾样脊髓灰质炎病毒。一种分离物是疫苗衍生的2型脊髓灰质炎病毒,与相应的萨宾毒株有17.6%的差异,表明其在监测范围之外长期传播。此外,他们还发现在污水中埃可病毒检测数据与特定年份临床病例发生率之间存在良好的相关性[26]。日本2010年在其九州区北部城市和农村地区的两个独立污水处理厂进行了污水相关研究,以追踪社区内的脊髓灰质炎病毒。比较有意思的是,在两个地点停用口服脊髓灰质炎病毒活疫苗之前,从污水中分离出脊髓灰质炎病毒的比率有所下降[27]。以色列在2013-2014年通过对污水系统环境监测发现了野生型脊髓灰质炎病毒,随后的疫苗接种运动避免了野生型病毒爆发[28]。在怀疑病毒持续传播或观察到病毒重新频繁引入的城市人口监测方面,污水监测也可提供具有重要价值的补充信息。
诺如病毒分为五个基因型(GI到GV),其中三个(GI、GII和GIV)可以感染人类,它们是粪-口传播病毒性胃肠炎最常见的病原体,同时导致污水中存在高含量病毒。Yue Huang等系统综述了约21个国家46项基于污水监测诺如病毒的进展,其中发达国家有29项研究,低死亡率发展中国家有17项研究。大部分研究的取样在1年以内,仅4项研究取样超过3年[29]。Zexin Tao等在山东地区基于污水监测对诺如病毒进行监测,揭示了当地多种基因型诺如病毒的共同传播和遗传多样性[30]。MaríaD在2005-2011年间通过追踪了阿根廷五条河流诺如病毒污染情况,揭示了不同规模大小社区水域诺如病毒多样性模式、季节性和时空扩散过程[31]。
肠道病毒属污水监测方面,6型埃可病毒是一种常见病毒,可引起多种人类疾病。尽管免疫能力强的个体感染该病毒通常无症状或引起轻度发烧,但它是神经系统疾病常见病原体,可引起包括无菌性脑膜炎、脑炎和急性松弛性瘫痪[38, 39]。Zexin Tao等通过对污水样品环境监测和序列分析揭示了中国济南6型埃可病毒两个传播谱系的共同传播[32]。柯萨奇B型病毒通常与神经系统疾病散发病例、脑膜炎的流行以及心肌病和糖尿病等慢性疾病有关[40]。Zexin Tao等对污水中人类肠道病毒做了为期一年期调查及影响病毒吸附于悬浮物的因素做了探究[41]。描述了7型埃可病毒和柯萨奇病毒-B5的系统发育,其中柯萨奇病毒B5是最常检测到的肠道病毒血清型[41]。
其他肠炎病毒监测方面:人类星状病毒是急性胃肠炎的主要病毒之一[42]。Nan Zhou等基于污水在2013年中国山东省开展了人类星状病毒监测,揭示了人类星状病毒在当地的基因型和分子流行病学规律[43]。此外通过二代测序也可揭示污水中星状病毒的多样性[44]。Cristina监测了2016-2017年西班牙瓦伦西亚污水中诺如病毒和轮状病毒的流行病学情况,对污水中病毒的监测有助于研究病毒在当地人群传播及其分子流行病学趋势,Shadi等监测了2017-2018年每月德黑兰已处理过污水中的轮状病毒情况[45, 46]。爱知病毒在人胃肠道中复制通常导致无症状感染,但也可造成胃肠炎、腹泻、腹痛、恶心、呕吐和发烧等临床症状[47]。Hao Wang等在瑞典哥德堡一处理厂污水样本中检测到其存在,爱知病毒在一年中的大部分时间里以不同数量存在,轮状病毒、呼肠孤病毒和星状病毒在流入污水中的病毒浓度存在季节性变化[33]。
甲型肝炎病毒是造成世界范围内病毒性肝炎最常见的病毒。该病毒通过粪便/口途径或通过与感染者直接接触而传播。感染不会导致慢性肝病,但会导致虚弱症状并导致急性肝衰竭,这与其高死亡率密切相关[48]。Yael等总结了2017-2018年以色列甲型肝炎病毒监测的经验教训,虽然幼儿普遍接种疫苗让色列甲型肝炎流行率非常低,但零星爆发仍然发生。结合病例中甲型肝炎病毒感染的分子机制和环境样本分析,综合相关流行病学调查,具有极大改善甲型肝炎病毒监测的潜力[49]。Laura等在阿根廷对同一地区污水和河流样本中的甲肝病毒进行环境监测,环境监测显示甲型肝炎病毒在当地人群中流行,通过对易感人群实施预防及保护措施可以降低该病毒感染的风险[50]。Donald在英国通过污水进行戊型肝炎病毒社区监测,通过对污水样本病毒系统遗传学分析发现污水样本与本地戊型肝炎感染患者病毒多样性是匹配的[51]。
2. 基于污水流行病学监测呼吸道/接触传播病毒:基于飞沫、呼吸道或接触传播的典型病毒包括新型冠状病毒、中东呼吸综合征冠状病毒、猴痘病毒、流感病毒等(表1)。以冠状病毒为例,SARS-Cov-2冠状病毒是一种引起人类疾病的冠状病毒,正义单链RNA(+ssRNA)基因组被包裹在具有双层包膜的病毒衣壳内,病毒呈球形或椭球形,直径为80-160nm。病毒衣壳具有螺旋对称性,由4类结构蛋白组成,包括包膜(E)、核衣壳(N)、膜(M)、刺突蛋白和非结构蛋白等。冠状病毒系统发育分析表明:SARS-CoV-2是Beta冠状病毒属成员,该属包括 SARS-CoV、MERS-CoV、蝙蝠SARS相关的冠状病毒等[52, 53]。病毒基因组突变为病毒增加传播能力及逃避免疫系统方面提供了潜在条件。S蛋白可形成长度约为20nm的突起,提供特征性冠状外观。S刺突蛋白是冠状病毒主要的表面糖蛋白,这种同源三聚体的S刺突蛋白可进一步细分为N末端S1结构域,该蛋白和可以和宿主细胞受体ACE2结合,锚定在冠状病毒膜上C端的S2结构域,负责病毒附着细胞后膜融合及病毒进入[54, 55]。不同的变体如Alpha,Beta和Gamma由于其S蛋白发生了变化,致使其传播能力更强。
此外,ACE2受体不仅在肺中表达,还在小肠上皮细胞、上食道、结肠中表达。临床研究表明2-50%的患者,除了有呼吸道症状外,还有胃肠道症状,当新冠病毒感染此消化系统相关组织或器官,病毒粒子会释放到消化系统中,随着粪便被排放出来。此外,病毒从咽部脱落后,患者在吞咽时可能将病毒粒子带入到消化系统中,上述证据表明基于污水监测是在新冠检测方面是可行的[56-58]。尽管粪便中病毒核酸浓度很高,但传染性病毒颗粒很难从粪便样本中分离出来,而从咽部或者肺部分离有传染性颗粒是非常容易的[59]。污水监测可以监测不同冠状病毒[60, 61]。新冠爆发后,中国香港包括全世界大部分国家及地区都开展了针对新冠病毒的污水监测项目及研究[62, 63]。呼吸道样本和粪便样本中病毒可检测性之间的间隔存在一定差异,与呼吸道样品相比,在粪便中检测到病毒会延迟1到3天,有时会延长到一周以上,但比临床早。在进入临床诊断之前,患者可以排放病毒长达一周,甚至更久。
在流感病毒污水监测方面,Marlene等基于污水监测了两次流感爆发,他们发现病毒RNA浓度反映了流感爆发模式和规模。对于密歇根大学的流感爆发,污水中流感病毒与在爆发期间的病例毒株是相同的[64]。在腺病毒监测方面,Laura在2021年1月1日-2022年5月1日每周在米兰一家污水处理厂收集城市污水样本,并对腺病毒进行量化和分析,她们通过污水监测发现2022年第一季度米兰(意大利)的腺病毒(Adv)含量增加,并在2022年3月达到顶峰,这与因急性呼吸道或胃肠道感染住院个体的呼吸道/粪便样本中Adv阳性率增加数据是相吻合的[65]。
在新发传染病污水监测方面,如2022年爆发的人传人猴痘病毒,从2022年5月以来,全球至少有74个国家报告了猴痘病毒病例,促使世界卫生组织宣布猴痘病毒疫情列为国际关注的突发公共卫生事件。由于感染猴痘患者通过皮肤损伤、唾液、分泌物、粪便和尿液排出猴痘病毒DNA,这些病毒可以通过厕所、水槽和淋浴排水管进入污水系统,因此可以通过污水监测手段对其进行监测[3, 66]。Eline基于阿姆斯特丹和史基浦机场的污水定性监测了污水中猴痘病毒含量及猴痘病毒相关病例[67]。
3. 基于污水流行病学监测虫媒传播病毒:虫媒病毒通过各类昆虫叮咬(如蚊子、蜱虫等)血源性媒介而传播,比较常见的如登革热病毒及寨卡病毒等(表1)。热带和亚热带地区最容易受到虫媒病毒影响,快速城市化和气候变暖等促进了埃及伊蚊等媒介昆虫繁殖。虫媒病毒脱落后可从人体尿液排出[68-70]及虫媒病毒或其核酸可以在一定温度范围内在污水中存在,这就为基于污水监测虫媒病毒爆发提供了前提条件[71]。不仅如此,虫媒病毒可导致亚临床感染,许多患者感染后无临床症状。
登革热病在世界范围内广泛传播,它是由雌性埃及伊蚊传播登革热病毒而引起的虫媒病毒性疾病,并且已知超过125个国家存在登革热流行,这给许多热带和亚热带地区带来重大的社会经济和疾病负担[72]。Ocean等在尼泊尔加德满都谷地开展试点研究,尝试通过污水监测尼泊尔加德满都谷地登革热疫情[73]。
在寨卡病毒污水监测方面,据相关报道,60%-80%寨卡病毒感染患者是无症状的[74]。Aaron等通过污水监测在亚特兰大污水处理厂监测到了寨卡病毒的存在[75]。
三、污水样本的特点和采样分布
1. 污水特点:污水按照来源可以分为民用污水、工业污水及雨水等。污水作为一种成分复杂样品样本,通俗来讲指含有唾液、痰液、粪便、尿液和淋浴的家庭和非家庭来源的水体。污水中含有大量杂质如钙离子、胆汁盐、尿素、酚类、醇类、多糖、SDS、腐殖酸和其他蛋白质,包括胶原蛋白、肌红蛋白、血红蛋白和蛋白酶等,具有大量复杂干扰成分。污水流量并不稳定并受多种因素影响:如雨水对下水道的稀释(卫生+雨水)、地下水渗入泄漏的下水道、非家庭水体、污水昼夜流量变化等。来自污水或污泥的复杂成分会抑制检测反应,导致灵敏度低或假阴性[108, 109]。值得注意的是在不同地区及位置收集的污水和污泥样品成分存在很大差异。
基于污水监测,可简单将其划分成5部分:分别为采样、浓缩富集、提取、检测及数据解读。由于污水样品基质极其复杂,病毒含量较低(特别是在社区暴发初期),因此从环境样品中取样、浓缩富集、提取和检测极具挑战(图2)。
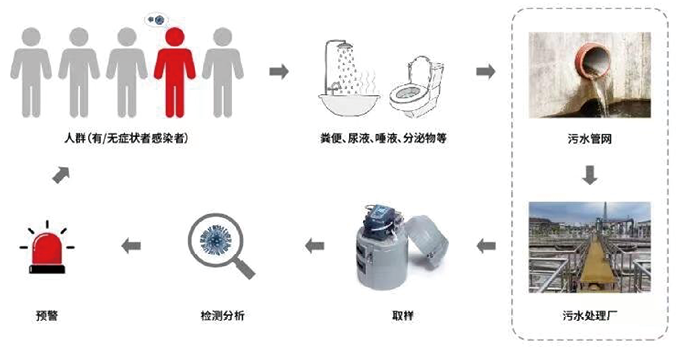
图2. 污水监测与传染病爆发预警
2. 污水样品采样和布点及运输:污水采样需要多个部门和单位进行协作,如大学、市政、环境、水务部门等。污水监测由于目的不同,其采样方式也存在较大差异。如果已知或疑似某类病毒传播变化或引入且需要对其监控,则需要针对特定范围人群采用更频繁的采样方式。如果旨在为病毒传播趋势提供补充证据或仅需要监测病毒是否存在,可以选择代表性人群进行长时间定期取样(如污水厂取样等),可根据不同病毒传播特点和周期,如一周、一月甚至更长时间采集一次样品。如针对于学校、医院、公寓大楼等小范围的研究,需要进一步采取公共卫生行动,则对目标人群频繁定期定点采样非常重要。如果针对于大量人群如十万甚至百万人群规模的人口进行污水监测,则可以选择在污水汇集处或污水处理厂附近进行样品采集。
(1)污水样品采样方式:可根据现场条件和检测需求确定水样采集方式,如瞬时水样(采样点位某一时间随机采集的样本)或24h混合水样(同一采样点位不同时间所采集的瞬时水样混合后的样本)。瞬时水样的优势在于无需安装专用设备,取样方便简单,可从大多数代表性流出管道等进行采集。需要注意,由于在一天内的不同时间段人群污水会受人群作息活动的影响,采用瞬时水样,需要选择代表性的时间段,否则可能会遗漏污水病毒信息。混合水样的优势在于可以系统覆盖收集不同时间段的污水信息,同时也需要相关设备投入,需要专门的人员安装及操作,可能受限于采样地的空间等[76]。除了上述2种方法以外,也可以采用被动采样方法(Passive sampling),如改进的“摩尔拭子(Moore swab)”,其采用吸附相关的材料如膜材料等,可将其放置于目标污水区域,在放置的时间段进行污水病毒收集,无需任何电源设备[77, 78]。此外,污水采样应根据采样场所排水系统分布情况,重点选取污水排水口、污水井、内部管网汇集处等关键位置对未经消杀处理的污水进行采样,采样点必须具有代表性。对于监测复杂的由大量人群构成的远距离下水道网络时,简单日常采集样本可能就足够了,因为可能任何位置输入病毒都会部分延迟。由于延迟,采样点病毒浓度可能不受来源人群如厕频率影响,但采样点距离源头越近,检出概率越高[36]。此外,如果采样点非常靠近感染人群,则污水病毒可能不会充分分散,因此可能需要采用复合型混合采样系统,即由每小时收集的等分试样组成的每日混合样本,从而避免遗漏污水病毒的峰值浓度。尽管如此,若部分人群的污水无法汇集至污水管网,我们也难以对其监测,如使用尿不湿的婴儿和部分老人等。
(2)污水样本运输:样本采集后应在现场使用75%酒精对采样瓶外表面进行消毒,然后将采样瓶装入密封采样袋中,对密封采样袋外表面再次进行消毒,并尽快将样本送至实验室,运输过程中确保0℃~4℃条件下冷藏运输。到达实验室后样本可保存于0℃~4℃环境中,实验室可在接到样本后在24h内进行富集浓缩处理,并在富集浓缩后及时完成核酸提取及实时定量荧光PCR(qPCR)检测。对于新冠病毒来讲,冻融对检测结果影响较大, 已有研究表明其在4℃条件下储存长达9天对其检测没有显着影响,而在-20℃储存下会导致基因拷贝数显著减少(4℃比-20℃储存条件下样品检测低2-3个Ct值,4℃储存条件下检测灵敏度更高)[79-81]。
四、污水浓缩富集方法
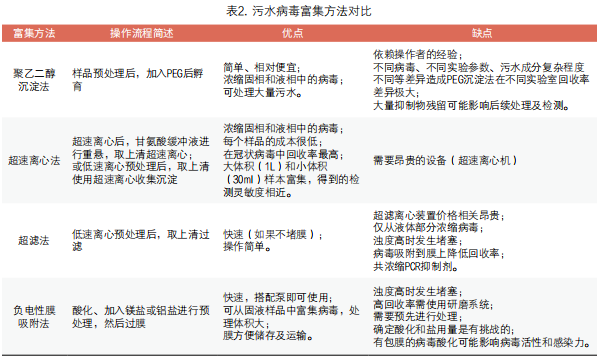
低浓度病毒核酸在复杂成分的污水中,需要高效率和高回收率的处理方法,这对于污水监测预警极其重要。低回收率可能会导致假阴性,高效的病毒污水浓缩富集方法能有效去除污水中干扰杂质,得到高纯度病毒,对于后续检测至关重要。对病毒样本进一步测序和系统发育分析也有助于了解感染源和传播动态。在评估回收效率时,由于不同样本差异极大,通常通过添加外源性内参替代病毒(surrogate viruses),从而可以更好校正及评估回收率。高效浓缩富集样品时,尽可能去除对下游检测干扰的杂质显得尤为重要,不同来源污水的基质成分差异极大,其对富集效率潜在影响较大。对于污水早期预警,浓缩富集方法应尽可能灵敏、高效、快速。常用的病毒浓缩方法包括聚乙二醇(PEG)沉淀法、超速离心、超滤、负电性膜(EM)吸附等(图3)[82]。

图3. 常见浓缩富集方法一览
1. 聚乙二醇(PEG)沉淀法:聚乙二醇(polyethylene glycol,PEG)是一种无电荷线性分子结构的多糖,具有高亲水性,在溶液中会吸收大量溶剂相中的水分,从而提高病毒相对浓度,减少病毒间的距离,使病毒浓度超过饱和的溶解度从而达到沉淀浓缩目的。PEG的优势在于该方法相对便宜、简单,但PEG沉淀实验过度依赖操作者的经验。据相关研究报道,即使使用同样的污水样本,PEG沉淀对冠状病毒的整体回收效率也因步骤而异,近75%的实验室回收率低于6%,仅少部分实验室回收效率大于36%,回收率跨度大(从0.03%~78%不等)[83]。对于细胞或组织培养上清,其样本成分相对简单,PEG法可以取得不错的回收率[84]。但该方法需要较长时间孵育,2h以上或过夜,抑制物也在浓缩过程中共沉淀下来,对于复杂的污水样本,大量抑制物残留可能影响后续处理及检测。在污水中分别加入鼠肝炎病毒(MVH)和假单胞菌噬菌体Phi6(Phi6),采用5种PEG沉淀实验方案产生了显着不同的回收效率MHV(0.070%~2.6%)和Phi6(0.071%~0.51%)。与较长的PEG孵育时间相比,具有较短孵育时间(约2h)的PEG沉淀可更好地回收 MHV、Phi6和辣椒轻斑驳病毒(PMMoV)病毒。不同的病毒、不同实验参数、污水成分复杂程度不同等差异造成PEG沉淀法在不同实验室回收率差异极大[85]。PEG 6000,8000及9000通常用来分离不同的病毒[85]。
2. 超速离心法:超速离心法利用超高速离心力将病毒样品从上清中离心沉淀下来。Mikaela等使用甘氨酸-超速离心法,将牛冠状病毒(BCoV)添加至污水样品中孵育1h后,使用110,000×g、4℃离心BCoV病毒1h,去上清后加入0.25N甘氨酸缓冲液进行重悬,然后低速离心后收集上清,最后使用超速离心110,000×g 4℃离心1h,重悬后获得病毒样品。样品富集后进行下游提取,并统计计算回收率为8.3%±11.7%。作者发现同时与Centricon Plus-70超滤法相比,甘氨酸-超速离心法在定量SARS-CoV-2方面显示出更高灵敏度。污水基质成分含量不同会影响浓缩法的回收率,总固体量对回收效率产生负面影响[86]。此外,由于病毒可能吸附在固体杂质上,甘氨酸重悬后离心去沉淀可能导致病毒损失。有意思的是Ahmed等比较了七种不同浓缩方法,MHV病毒超速离心回收效率(33.5+12.1%)也优于CentriconPlus-70超滤(28.0+9.10%),但反复离心重悬去除固体沉淀后造成了病毒损失[87]。Tatiana Prado采用类似的超速离心法富集浓缩牛呼吸道合胞体病毒(BRSV)和RNA噬菌体(PP7),其回收效率平均值分别为27.4±8.64%和18.5±7.46%[88]。Tulio M. Fumian等使用超速离心法对轮状病毒富集发现,校正回收率为47%(回收率范围为34~60%),而基于负电性膜吸附-洗脱法校正回收率仅为3.5%[89]。
香港大学XiaWan Zheng等,低速离心对污水进行预处理后,然后加入灭活的SARS-Cov-2病毒,使用超速离心150,000×g 4℃离心1h,去除上清后收集沉淀进行后续处理。他们对比了8种不同的富集浓缩方式,发现超速离心法是最有效的富集方式,整体回收率为25±6%。更进一步,他们对比了大体积(1L)和小体积(30ml)样本的富集,两种体积量差异巨大的富集方式得到的检测灵敏度是相近的,这就意味着超离的整体通量可以极大提升,可以极大提高效率节约人力成本[82]。
已有报道在预离心澄清步骤中,病毒损失了30%[90],因此应分析污水样品的固体和液体部分,以最大限度地提高病毒回收率。S. Wurtzer对污水样品匀浆后,直接超速离心,无需任何预先准备步骤(如澄清),对BCoV病毒和腺病毒进行分析发现其具有大于90%的高回收率。没有任何澄清步骤,充分考虑了游离病毒以及吸附在特定有机物上的病毒颗粒[91-93]。高pH可以降低病毒吸附到固体杂质上,以人类冠状病毒株229E(hCoV-229E)为例,pH调节至9.6可以提高其回收率[81]。需要提醒的是,由于不同转子离心效率有差异,即便是同一离心力、采用同样时间,但使用不同转子,其离心效果也可能存在差异。建议根据病毒颗粒的沉降系数和转头效率(k因子)进行精确计算后,再进行试验。高转速意味着更短的离心时间内进行高效富集!
3. 超滤法:超滤法基于尺寸排阻来浓缩病毒,当含有病毒的污水通过超滤膜时,病毒由于颗粒粒径大于滤膜孔径,因而病毒被截留在滤膜上,之后通过相应buffer进行洗脱,从而实现了样品的浓缩富集。Amicon Ultra-15(30K)和Centricon Plus-70是最常用的两类超滤膜。通过低速离心后,取上清过超滤膜,将病毒富集下来。Ahmed对比了多种富集方案,Amicon Ultra-15离心回收MHV平均回收率为56.0±32.3%,为回收率排名第三的方法。Centricon Plus-70超滤离心法与Amicon Ultra-15相似,但其应用于未处理MHV病毒污水样品其回收率降低了约50%,回收率只有28.0±9.10%[87]。作者分析回收率的巨大差异是由于滤膜设计,Centricon Plus70膜表面积大于Amicon Ultra-15,病毒通过范德瓦尔斯相互作用力或疏水键合吸附到膜上,可能造成了MHV病毒损失更多。Centricon Plus-70膜用于MS2大肠杆菌噬菌体(MS2)的回收率为75%、Echovirus病毒回收率为61%,Poliovirus 1病毒回收率为195%、Coxsackievirus B5回收率为109%及腺病毒回收率为33%。Yinyin等对包膜病毒和非包膜病毒回收率研究发现,与两种无包膜病毒6%的回收率相比,高达26%的两种包膜病毒吸附到污水固相部分[94]。包膜 MHV和假单胞菌噬菌体Phi6的平均回收率分别为25.1% ±3.6%和18.2%±9.5%,无包膜的大肠杆菌噬菌体MS2和T3平均回收率为55.6%±16.7%和85.5%±24.5%[94]。超滤法同样被广泛用于脊髓灰质炎病毒、腺病毒、诺如病毒和肠道病毒。但即便是同类回收装置,不同病毒回收率存在较大差异。此外,该方法只能用于从液体中回收病毒,如果在样品预处理不彻底、固体比例含量较多,容易导致滤膜堵塞,且单次处理体积相对有限。如果浓缩大量水样可能会增加污水中低丰度病毒的机会,但是增加污水处理体积也可能在样品浓缩物中引入更多的抑制剂,这会干扰RT-qPCR反应[81]。
4. 负电性膜吸附:负电性膜(EM)孔径大小一般为0.45微米,负电性膜依赖于pH,通过添加MgCl2和AlCl3促进病毒的捕获和吸附。污水中病毒通常呈现负电荷,预先酸化处理有利于带负电的病毒吸附到膜上,可以依靠静电力减少病毒回收的损失[95]。XiaWan Zheng使用EM膜吸附法对新冠病毒富集研究对比发现,基于EM膜吸附法回收效率为4%~11%,低于其他富集方法,为富集效率最低的方法[82]。Torri等研究发现EM膜吸附法提供了较低的MS2回收率,其回收范围为0.3~9.5%,Phi6回收率范围为0.5~21%[96]。但Ahmed对MVH研究发现,采用EM膜吸附法进行富集,富集完成后立即使用物理研磨方式进行预处理,其回收效率为65.7±23.0%,是效率最高的方法。推测通过对EM膜反复冲洗及洗脱难以将整体病毒回收下来,从而降低了整体回收率。EM膜吸附法的优势在于可以从固体和液体中浓缩病毒,最多可处理200mL样品,具体取决于样品过滤器尺寸和浊度。优势在于只需要一个过滤装置和一个泵,可以在现场进行处理。缺点在于需要相应的洗涤和清洁过滤装置,且需要预先进行pH值调整或添加MgCl2和AlCl3等。要想取得较好回收率,需要使用昂贵的研磨系统。对于浑浊度较高的污水样品,可以通过预过滤方式去过滤掉大杂质颗粒以降低浊度。此外,确定酸化和盐用量是有挑战的,且需要预先进行处理。对于有包膜的病毒,样品酸化可能影响病毒活性和感染力[95]。
以上这些富集方法都具有其独特的优点和限制。选择适当的富集浓缩方法通常取决于病毒类型、样品基质成分复杂程度等,需要综合考虑回收率、纯度、实验室设备和技能、以及成本和时间等多个维度因素(表2)。若疾病早期预警,此时病毒含量极低,高回收率、低杂质的富集浓缩方法极为重要!
五、污水病毒检测方法概述
污水可以成为监测人群中病毒传播最有价值信息源。传统污水样品病毒检测方法如细胞培养或电子显微镜,这些方法耗时、繁琐,通常需要高水平专业技术人员[97]。相比之下,分子生物学方法已经彻底改变了污水中病毒检测状况,让我们对各种病毒进行快速和灵敏的检测成为可能[98]。最常用的方法包括:实时荧光定量PCR(qPCR)、数字PCR(dPCR)、环介导等温扩增(LAMP)、二代测序(NGS)及Cepheid Xpert病原核酸检测试剂盒等(表3)。如下是这些方法在污水样品中直接检测病毒的详细介绍。
1. 实时荧光定量PCR(qPCR):实时荧光定量PCR(qPCR)是一种高灵敏度的PCR技术,可用于直接检测污水中的病原。与传统PCR不同,qPCR可以实时监测PCR反应中产生的荧光信号,从而实现对PCR反应的定量分析。使用qPCR进行污水病毒检测详细流程包括样品采集、样品制备、引物设计、PCR扩增、实时检测以及数据分析。
qPCR作为一种可靠且广泛使用的技术,用于直接检测污水中的病毒,可以在水质监测和公共卫生方面发挥重要作用。与传统细菌培养和显微镜检查相比,qPCR具有更高灵敏度和特异性,并且可以在更短时间内获得结果。然而,qPCR检测方法也存在一些限制和挑战。例如qPCR对样品中的抑制剂非常敏感,这可能会影响检测结果,因此必须在样品制备过程中仔细处理,以确保qPCR反应的特异性和灵敏性。同时为了确保结果准确,需要进行良好的实验室操作和PCR质量控制。
2. 数字聚合酶链式反应(dPCR):dPCR是一种高度敏感和精确的基于PCR的方法,允许对样品中病毒核酸进行绝对定量。该技术将样品分为数千个微小液滴,每个液滴包含一份分子目标如病毒核酸,PCR反应在每个区域内单独进行。液滴在PCR过程中被扩增,产生许多PCR产物,从而允许确定病毒载量的绝对数目[99]。dPCR的主要过程包括样品收集、核酸提取、dPCR分割引物设计、PCR扩增检测以及分析和定量等几个步骤。
总的来说,dPCR在直接检测污水中病毒方面具有更高的准确性和灵敏度。它能够在非常低的病毒浓度下进行定量,从而更好地追踪病毒爆发趋势和预警。此外,dPCR可以忽略PCR反应中的抑制剂,因为每个区域中只有一个分子扩增,从而降低了假阴性结果的可能性。然而,dPCR也存在限制:如该方法设备和耗材成本更高,样品前处理可能会影响结果,因此必须具有良好的实验操作。
3.环介导等温扩增(LAMP,Loop-Mediated Isothermal Amplification):LAMP是一种快速、简单、高灵敏度的核酸扩增技术,可用于检测病毒DNA或RNA。该技术使用一组4~6个引物,识别目标序列上6~8个特定区域,从而实现高特异性的目标序列扩增,可用于污水病毒直接检测。LAMP技术扩增目标病毒特定核酸序列,并产生实时可见信号,从而实现对病毒快速灵敏检测[104-106]。LAMP反应在单个管中进行,采用等温条件,即在恒定温度下进行反应(通常在60~65℃),无需热循环仪,反应混合物含有引物、链位移聚合酶、dNTPs和pH敏感染料等。反应混合物中pH敏感染料变色,表明存在扩增的病毒核酸。
LAMP用于直接检测污水中病毒的性能已在多个研究中得到评估。LAMP被证明具有高度特异性和灵敏性,检测限可以低至每个反应10个病毒核酸拷贝数。该技术已用于检测各种病毒在污水中的存在,包括诺如病毒、甲肝病毒和脊髓灰质炎病毒,用于检测不同地理位置收集的污水样品。但它也存在一些局限性和缺陷。例如:LAMP方法的检测灵敏度受到多种因素的影响,如引物浓度过高、反应体系中的离子强度变化等,在污水等复杂样品中,其检测灵敏度可能受到影响。而且,LAMP方法需要较为复杂的实验室设备和技术,操作难度较大。尤其在样品处理和DNA提取过程中,存在许多容易出错的环节。总体而言,LAMP是一种有前途的污水病毒直接检测技术。它是一种快速、灵敏且经济的方法,随着进一步的发展和优化,LAMP未来可能成为监测和控制病毒爆发有价值的工具之一。
4. 赛沛Xpert病原核酸检测试剂盒:赛沛公司(Cepheid)商品化病原核酸检测试剂盒是一种基于PCR技术的快速、全自动化临床病原检测试剂盒,可用于直接检测污水中病毒。它将PCR反应封装在一种小型塑料试剂盒中,称为Xpert卡盒。该技术的主要过程包括以下几个步骤:(1)样品收集;(2)样品加入:将经过处理的样品加入Xpert卡盒中。卡盒包含了所有必要的试剂,包括引物、酶和缓冲液,以及自动混合样品并提取核酸的功能;(3)自动核酸提取:样品在Xpert卡盒中被加入到提取试剂中,并自动混合以提取样品中的核酸,该步骤可以自动进行,无需任何操作员干预;(4)PCR扩增:经过提取的核酸在Xpert卡盒中进行PCR扩增,该芯片可以自动控制PCR反应的温度、时间和扩增周期;(5)结果分析:经过PCR扩增后的结果可以通过读取Xpert卡盒中的荧光信号来分析,结果可以在几十分钟内获得。
在新冠疫情期间,Xpert新冠病毒检测试剂盒在很多地区得到了广泛地使用,与其他快速诊断测试相比,赛沛Xpert具有几个特点,使其成为目前检测污水中SARS-CoV-2理想候选者[107]。该检测的提取步骤使用了Xpert卡盒内的一个过滤系统,该系统分离和浓缩病毒颗粒,同时去除污水中经常存在的许多抑制剂。此外,该检测是现有的最灵敏的快速检测方法之一,据报道,其在临床环境中的检测极限低于50拷贝(Cp)/毫升。通过监测GeneXpert终点荧光,可以进一步提高GeneXpert检测极限,这是一种在进行高度多重样本汇集时用于提高临床环境中灵敏度的做法。另外,该测试是定量的,并提供了一个循环阈值(CT值),通过使用标准曲线可以估计样本中SARS-CoV-2浓度。
为了更好地跟踪和预测新冠肺炎疾病的趋势,需要一种易于使用的、移动的、快速的SARS-CoV-2污水检测方法,特别是在偏远社区或资源有限的环境中,赛沛Xpert病原核酸检测试剂盒很好地满足了这一需求。
5. 二代测序(NGS,Next-Generation Sequencing):NGS是一种高通量测序技术,可以在单次运行中对数百万个DNA或RNA片段进行测序。它可用于检测污水样品中各种病毒,包括新发病毒或病毒变异。由于其高灵敏度和高通量,已越来越多地用于直接监测污水中的人类病毒[100]。使用NGS进行这种检测方法通常涉及样品收集、浓缩、核酸提取、PCR扩增和文库制备、测序、生物信息学分析以及数据解读等几个步骤。
NGS直接检测污水中人类病毒的结果好坏取决于不同因素,例如病毒载量、样品质量、文库制备、测序深度和生物信息学分析。目前已经证明它是一种监测病毒爆发和识别环境中新出现病毒变种的敏感有效方法[101-103]。
以上这些检测方法都具有其独特的优点和限制。选择适当方法通常取决于病毒类型、样品类型、所需灵敏度和特异性、实验室设备以及成本和时间等多个因素。PCR是最常用的方法,因为它易于操作、可靠、快速和高效。然而,NGS对于发现新型、变异或未知病毒以及进行详细的病毒流行病学研究非常有用。LAMP是一种简单快速的方法,需要少量设备和技术,并可在不同环境下使用。dPCR是一种非常精确的定量方法,特别适用于低浓度病毒的检测及预警。

六、质量控制
分子检测技术已被广泛地用于定量检测各种污水样本中的致病性病毒DNA/RNA水平,作为社区中病毒感染的监测指标,也可以用于特定群体(如学校、养老院)感染爆发的早期预警,防止疾病的传播。但目前,各监测机构之间的结果和数据往往不能分享和比较,这主要是因为目前还没有标准化的检测流程或商品化检测产品;因此,污水监测过程的质量控制就变得尤为重要。
据相关报道,污水中的蛋白质、脂肪、碳水化合物、多酚、金属离子和RNA酶可能会抑制或降低PCR反应的灵敏度,可能导致假阴性结果[108, 109]。为了确保污水中病毒检测的准确性和可靠性,分子检测方法需要进行质量控制。其中一个重要的方面是对每个实验批次进行阳性对照和阴性对照。阳性对照应该包括已知数量的病毒DNA或RNA,以评估检测效率和准确性。阴性对照应该包括与目标病毒无关的样本,以评估检测的污染和假阳性。此外,在检测中加入内参,例如内源性或外源性内参,以评估提取和扩增效率以及检测中的潜在抑制物质。
内源性内参质控是在样本中添加已知的定量内参靶分子或基因,以评估实验室检测过程中的效率和准确性,这是目前常用的质控方法[110]。这些靶分子或基因应该与分析的目标靶分子或基因不同,以避免干扰分析结果。内源性内参质控目的是确认检测结果的准确性和可靠性,以及其在整个检测流程中的可重复性。
外源性内参质控方法是在样品中加入已知含量的目标病毒标准品或者内参替代病毒(surrogate viruses)作为质控,并使分子检测结果的解读不受标本种类影响[111]。外源性内参质控应该与样品一同进行提取和扩增,并使用相同的引物和探针进行检测。在PCR检测中,使用外源性内参质控的方式如在扩增反应中加入已知量的人造RNA,这样可以判断扩增过程中的变异情况和PCR抑制情况,以及是否存在潜在的污染问题。外源性内参质控应该设置在阳性对照和阴性对照之间,以确保扩增过程中的质量控制和数据准确性。
在外源性对照的使用中,有两个目的:一是通过计算目标分子的回收率(如SARS-CoV-2 RNA的数量和质量)来评估实验室开发的PCR分析的整体表现;二是监测样品基质中的抑制性物,以避免导致假阴性结果[112]。使用下列公式可以计算回收率:Recovery(%)=加入对照病毒后检测到的病毒量/基线样品中检测到的病毒×100[81]。但据目前研究文献,采用不同类型的外源性内参质控品产生的回收率差异很大,还无法确定一个统一的回收率标准范围[113, 114]。
在污水中检测病毒时,还需要注意不同样本类型和来源之间的差异。因此,需要根据不同类型的样本和病毒选择最佳的提取方法和扩增方案。为了确保结果的一致性,需要对所采用的方法和步骤进行严格的标准化和验证。还需要定期进行质量控制,并对每批样品进行重复测试以确保结果的准确性和可重复性。此外,为了确保数据质量和一致性,还需要开发和采用国家和国际标准检测方案,以确保检测方法和数据交换的一致性和可比性。
七、结果解读
解读污水中病毒监测结果需要考虑多个因素。我们需要将污水中病毒的分子检测结果与其他流行病学监测数据相结合,例如临床病例、疫情地图、人口流动等,以便全面评估当前的疫情形势和风险。特别是对于一些高传染性和致命性的病毒,例如新冠病毒,可以通过污水监测提前预警,发现潜在感染者,采取及时有效的防控措施,从而有效地遏制疫情的蔓延[115]。
有意义的结果解读基础在于如何与病毒感染在特定范围的流行情况建立相关性。以新冠举例,多项研究发现,在污水中检测到SARS-CoV-2 RNA与新冠流行的相关性从0.00005%~0.88%不等。这相当于在人口数量为114~2,000,000的范围内,仅需要一个COVID-19感染病例就可以检测到污水中的SARS-CoV-2 RNA[116, 117]。这种阈值的变化主要取决于三个关键因素:第一个因素是COVID-19检测的广泛程度,不同地区的检测策略会影响COVID-19确诊病例数和潜在病例数,从而影响污水中SARS-CoV-2 RNA的检测准确性;第二个因素是污水成分的影响,包括病毒在不同天气条件下在污水中的降解和稀释不确定性,以及污水中抑制物质对RT-qPCR性能的影响[108];第三个因素是研究设计的影响,大多数水环境监测的研究报告中,对SARS-CoV-2 RNA的检测敏感性的报道要么使用了有限数量的污水样品,要么仅在短时间观察,这些研究设计和数据分析的缺陷限制了数据集的代表性,从而影响了污水监测的敏感性。
因此,在开展水环境监测工作时,需要考虑到这些因素,制定合适的样品采集计划,以确保准确、可靠地监测病毒在社区中的传播情况。
八、展望
针对于特定区域下水道或污水处理厂,通过污水监测可以为某一区域或城市疾病爆发提前预警。污水监测可补充临床检测的局限性,不仅可以阐明目标病原真实的感染情况,而且可以为疾病的爆发进行预警。污水监测的另一个重要作用在于它可以通过系统发育分析检测病毒株的变异,为追踪病毒随着时间和不同区域变异情况提供了宝贵信息。污水监测还可以跟踪污水中病毒浓度的季节性波动,反映社区中的病毒流行病学模式。不仅如此,不同区域间污水的比较甚至可以深入了解导致疾病爆发的环境、社会经济因素和疾病模式等。
污水监测可以作为一个早期指标,表明社区中病毒感染者数量正在增加或减少。衡量公共卫生干预措施的效果,研究人员可以看到污水病毒信号是否在接种疫苗或学校停课等干预措施后增加或减少,通过污水处理厂取样来监测城市更大人群病例是在上升还是下降。污水监测可以为未来的大流行预测创建预警响应机制,它是提供城市人群健康状况和传染病发展趋势的重要信息来源。在未来,相信基于污水监测开发的强大健康监测系统将会发挥越来越重要的作用,它是有效和及时预防控制新发性、季节性乃至应对未来传染病的重要武器。
参考文献
Jiménez-Rodríguez M G, Silva-Lance F, Parra-Arroyo L, et al. Biosensors for the detection of disease outbreaks through wastewater-based epidemiology[J]. TrAC Trends in Analytical Chemistry, 2022, 155: 116585.
Kasprzyk-Hordern B, Adams B, Adewale I D, et al. Wastewater-based epidemiology in hazard forecasting and early-warning systems for global health risks[J]. Environ Int, 2022, 161: 107143.
Tiwari A, Adhikari S, Kaya D, et al. Monkeypox outbreak: Wastewater and environmental surveillance perspective[J]. Sci Total Environ, 2023, 856(Pt 2): 159166.
Zuccato E, Chiabrando C, Castiglioni S, et al. Estimating community drug abuse by wastewater analysis[J]. Environ Health Perspect, 2008, 116(8): 1027-32.
Du P, Zhou Z, Bai Y, et al. Estimating heroin abuse in major Chinese cities through wastewater-based epidemiology[J]. Science of The Total Environment, 2017, 605-606: 158-165.
Castiglioni S, Borsotti A, Senta I, et al. Wastewater analysis to monitor spatial and temporal patterns of use of two synthetic recreational drugs, ketamine and mephedrone, in Italy[J]. Environ Sci Technol, 2015, 49(9): 5563-70.
Senta I, Gracia-Lor E, Borsotti A, et al. Wastewater analysis to monitor use of caffeine and nicotine and evaluation of their metabolites as biomarkers for population size assessment[J]. Water Research, 2015, 74: 23-33.
Gracia-Lor E, Rousis N I, Zuccato E, et al. Estimation of caffeine intake from analysis of caffeine metabolites in wastewater[J]. Science of The Total Environment, 2017, 609: 1582-1588.
Mastroianni N, Lopez De Alda M, Barcelo D. Analysis of ethyl sulfate in raw wastewater for estimation of alcohol consumption and its correlation with drugs of abuse in the city of Barcelona[J]. Journal of Chromatography A, 2014, 1360: 93-99.
Rodríguez- lvarez T, Rodil R, Rico M, et al. Assessment of local tobacco consumption by liquid chromatography-tandem mass spectrometry sewage analysis of nicotine and its metabolites, cotinine and trans-3'-hydroxycotinine, after enzymatic deconjugation[J]. Anal Chem, 2014, 86(20): 10274-81.
Tscharke B J, White J M, Gerber J P. Estimates of tobacco use by wastewater analysis of anabasine and anatabine[J]. Drug testing and analysis, 2016, 8(7): 702-707.
Kosjek T, Perko S, Zupanc M, et al. Environmental occurrence, fate and transformation of benzodiazepines in water treatment[J]. Water Research, 2012, 46(2): 355-368.
Lei H J, Yang B, Ye P, et al. Occurrence, fate and mass loading of benzodiazepines and their transformation products in eleven wastewater treatment plants in Guangdong province, China[J]. Sci Total Environ, 2021, 755(Pt 2): 142648.
Golovko O, Kumar V, Fedorova G, et al. Seasonal changes in antibiotics, antidepressants/psychiatric drugs, antihistamines and lipid regulators in a wastewater treatment plant[J]. Chemosphere, 2014, 111: 418-426.
Michael I, Rizzo L, Mcardell C S, et al. Urban wastewater treatment plants as hotspots for the release of antibiotics in the environment: A review[J]. Water Research, 2013, 47(3): 957-995.
Gao P, Munir M, Xagoraraki I. Correlation of tetracycline and sulfonamide antibiotics with corresponding resistance genes and resistant bacteria in a conventional municipal wastewater treatment plant[J]. Science of The Total Environment, 2012, 421-422: 173-183.
Aarestrup F M, Woolhouse M E. Using sewage for surveillance of antimicrobial resistance[J]. Science, 2020, 367(6478): 630-632.
Rousis N I, Zuccato E, Castiglioni S. Wastewater-based epidemiology to assess human exposure to pyrethroid pesticides[J]. Environment International, 2017, 99: 213-220.
Rousis N I, Zuccato E, Castiglioni S. Monitoring population exposure to pesticides based on liquid chromatography-tandem mass spectrometry measurement of their urinary metabolites in urban wastewater: A novel biomonitoring approach[J]. Science of The Total Environment, 2016, 571: 1349-1357.
O’brien J W, Thai P K, Brandsma S H, et al. Wastewater analysis of Census day samples to investigate per capita input of organophosphorus flame retardants and plasticizers into wastewater[J]. Chemosphere, 2015, 138: 328-334.
Choi P M, Tscharke B J, Donner E, et al. Wastewater-based epidemiology biomarkers: Past, present and future[J]. TrAC Trends in Analytical Chemistry, 2018, 105: 453-469.
Tiwari A, Kurittu P, Al-Mustapha A I, et al. Wastewater surveillance of antibiotic-resistant bacterial pathogens: A systematic review[J], 2022.
Chau K K, Barker L, Budgell E P, et al. Systematic review of wastewater surveillance of antimicrobial resistance in human populations[J]. Environment International, 2022, 162: 107171.
Hellmer M, Paxeus N, Magnius L, et al. Detection of pathogenic viruses in sewage provided early warnings of hepatitis A virus and norovirus outbreaks[J]. Appl Environ Microbiol, 2014, 80(21): 6771-81.
Tambini G, Andrus J K, Marques E, et al. Direct Detection of Wild Poliovirus Circulation by Stool Surveys of Healthy Children and Analysis of Community Wastewater[J]. The Journal of Infectious Diseases, 1993, 168(6): 1510-1514.
Ivanova O E, Yarmolskaya M S, Eremeeva T P, et al. Environmental Surveillance for Poliovirus and Other Enteroviruses: Long-Term Experience in Moscow, Russian Federation, 2004(-)2017[J]. Viruses, 2019, 11(5).
Nakamura T, Hamasaki M, Yoshitomi H, et al. Environmental surveillance of poliovirus in sewage water around the introduction period for inactivated polio vaccine in Japan[J]. Appl Environ Microbiol, 2015, 81(5): 1859-64.
Brouwer A F, Eisenberg J N S, Pomeroy C D, et al. Epidemiology of the silent polio outbreak in Rahat, Israel, based on modeling of environmental surveillance data[J]. Proceedings of the National Academy of Sciences, 2018, 115(45).
Huang Y, Zhou N, Zhang S, et al. Norovirus detection in wastewater and its correlation with human gastroenteritis: a systematic review and meta-analysis[J]. Environ Sci Pollut Res Int, 2022, 29(16): 22829-22842.
Tao Z, Xu M, Lin X, et al. Environmental Surveillance of Genogroup I and II Noroviruses in Shandong Province, China in 2013[J]. Sci Rep, 2015, 5: 17444.
Fernández M D B, Torres C, Poma H R, et al. Environmental surveillance of norovirus in Argentina revealed distinct viral diversity patterns, seasonality and spatio-temporal diffusion processes[J]. Science of The Total Environment, 2012, 437: 262-269.
Tao Z, Wang H, Li Y, et al. Cocirculation of two transmission lineages of echovirus 6 in jinan, china, as revealed by environmental surveillance and sequence analysis[J]. Appl Environ Microbiol, 2011, 77(11): 3786-92.
Wang H, Neyvaldt J, Enache L, et al. Variations among Viruses in Influent Water and Effluent Water at a Wastewater Plant over One Year as Assessed by Quantitative PCR and metagenomics[J]. Applied and Environmental Microbiology, 2020, 86(24).
La Rosa G, Iaconelli M, Pourshaban M, et al. Detection and molecular characterization of noroviruses from five sewage treatment plants in central Italy[J]. Water Research, 2010, 44(6): 1777-1784.
Kazama S, Masago Y, Tohma K, et al. Temporal dynamics of norovirus determined through monitoring of municipal wastewater by pyrosequencing and virological surveillance of gastroenteritis cases[J]. Water Research, 2016, 92: 244-253.
Hovi T, Shulman L M, Van Der Avoort H, et al. Role of environmental poliovirus surveillance in global polio eradication and beyond[J]. Epidemiol Infect, 2012, 140(1): 1-13.
<WHO. Guidelines for environmental surveillance of poliovirus circulation. World Health Organization,Department of Vaccines and Biologicals, 2003..pdf>[J].
Chomel J J, Antona D, Thouvenot D, et al. Three ECHOvirus Serotypes Responsible for Outbreak of Aseptic Meningitis in Rhône-Alpes Region, France[J]. European Journal of Clinical Microbiology and Infectious Diseases, 2003, 22(3): 191-193.
Lee H-Y, Chen C-J, Huang Y-C, et al. Clinical features of echovirus 6 and 9 infections in children[J]. Journal of Clinical Virology, 2010, 49(3): 175-179.
<group-b-coxsackievirus-virulence.pdf>[J].
Tao Z, Wang Z, Lin X, et al. One-year Survey of human enteroviruses from sewage and the factors affecting virus adsorption to the suspended solids[J]. Scientific Reports, 2016, 6(1).
Svraka S, Duizer E, Vennema H, et al. Etiological Role of Viruses in Outbreaks of Acute Gastroenteritis in The Netherlands from 1994 through 2005[J]. Journal of Clinical Microbiology, 2007, 45(5): 1389-1394.
Zhou N, Lin X, Wang S, et al. Environmental surveillance for human astrovirus in Shandong Province, China in 2013[J]. Sci Rep, 2014, 4: 7539.
Tao Z, Lin X, Liu Y, et al. Detection of multiple human astroviruses in sewage by next generation sequencing[J]. Water Res, 2022, 218: 118523.
Santiso-Bellón C, Randazzo W, Pérez-Cataluña A, et al. Epidemiological Surveillance of Norovirus and Rotavirus in Sewage (2016–2017) in Valencia (Spain)[J]. Microorganisms, 2020, 8(3): 458.
Tavakoli Nick S, Mohebbi S R, Hosseini S M, et al. Monitoring of rotavirus in treated wastewater in Tehran with a monthly interval, in 2017–2018[J]. Journal of Water and Health, 2020, 18(6): 1065-1072.
Rivadulla E, Romalde J L. A Comprehensive Review on Human Aichi Virus[J]. Virol Sin, 2020, 35(5): 501-516.
Lavanchy D. Viral hepatitis: global goals for vaccination[J]. J Clin Virol, 2012, 55(4): 296-302.
Gozlan Y, Bar-Or I, Volnowitz H, et al. Lessons from intensified surveillance of viral hepatitis A, Israel, 2017 and 2018[J]. Euro Surveill, 2021, 26(6).
Yanez L A, Lucero N S, Barril P A, et al. Evidence of hepatitis A virus circulation in central Argentina: seroprevalence and environmental surveillance[J]. J Clin Virol, 2014, 59(1): 38-43.
Smith D B, Paddy J O, Simmonds P. The use of human sewage screening for community surveillance of hepatitis E virus in the UK[J]. J Med Virol, 2016, 88(5): 915-8.
Coronaviridae Study Group of the International Committee on Taxonomy Of V. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2[J]. Nat Microbiol, 2020, 5(4): 536-544.
Zhou P, Yang X L, Wang X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579(7798): 270-273.
Lan J, Ge J, Yu J, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor[J]. Nature, 2020, 581(7807): 215-220.
Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor[J]. Cell, 2020, 181(2): 271-280.e8.
D'amico F, Baumgart D C, Danese S, et al. Diarrhea During COVID-19 Infection: Pathogenesis, Epidemiology, Prevention, and Management[J]. Clin Gastroenterol Hepatol, 2020, 18(8): 1663-1672.
Megyeri K, Dernovics A, Al-Luhaibi Z I I, et al. COVID-19-associated diarrhea[J]. World J Gastroenterol, 2021, 27(23): 3208-3222.
Ghimire S, Sharma S, Patel A, et al. Diarrhea Is Associated with Increased Severity of Disease in COVID-19: Systemic Review and metaanalysis[J]. SN Comprehensive Clinical Medicine, 2021, 3(1): 28-35.
Wolfel R, Corman V M, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019[J]. Nature, 2020, 581(7809): 465-469.
Venugopal A, Ganesan H, Sudalaimuthu Raja S S, et al. Novel wastewater surveillance strategy for early detection of coronavirus disease 2019 hotspots[J]. Curr Opin Environ Sci Health, 2020, 17: 8-13.
La Rosa G, Bonadonna L, Lucentini L, et al. Coronavirus in water environments: Occurrence, persistence and concentration methods - A scoping review[J]. Water Res, 2020, 179: 115899.
Kumblathan T, Liu Y, Uppal G K, et al. Wastewater-based Epidemiology for Community Monitoring of SARS-CoV-2: Progress and Challenges[J]. ACS Environmental Au, 2021, 1(1): 18-31.
侯敏, 唐宋, 谢玉为. 污水新型冠状病毒监测研究进展及启示[J]. 环境科学研究(-):
Wolfe M K, Duong D, Bakker K M, et al. Wastewater-based Detection of Two Influenza Outbreaks[J]. Environmental Science & Technology Letters, 2022, 9(8): 687-692.
Pellegrinelli L, Uceda Renteria S C, Ceriotti F, et al. Wastewater Surveillance Captured an Increase in Adenovirus Circulation in Milan (Italy) during the First Quarter of 2022[J]. Viruses, 2022, 14(11): 2351.
Wolfe M K, Duong D, Hughes B, et al. Detection of monkeypox viral DNA in a routine wastewater monitoring program[J]. medRxiv, 2022: 2022.07.25.22278043.
De Jonge E F, Peterse C M, Koelewijn J M, et al. The detection of monkeypox virus DNA in wastewater samples in the Netherlands[J]. Sci Total Environ, 2022, 852: 158265.
Van Den Bossche D, Cnops L, Van Esbroeck M. Recovery of dengue virus from urine samples by real-time RT-PCR[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2015, 34(7): 1361-1367.
Poloni T R, Oliveira A S, Alfonso H L, et al. Detection of dengue virus in saliva and urine by real time RT-PCR[J]. Virology Journal, 2010, 7(1): 22.
Gourinat A C, O'connor O, Calvez E, et al. Detection of Zika virus in urine[J]. Emerg Infect Dis, 2015, 21(1): 84-6.
Chandra F, Lee W L, Armas F, et al. Persistence of Dengue (Serotypes 2 and 3), Zika, Yellow Fever, and Murine Hepatitis Virus RNA in Untreated Wastewater[J]. Environmental Science & Technology Letters, 2021, 8(9): 785-791.
Murray N E, Quam M B, Wilder-Smith A. Epidemiology of dengue: past, present and future prospects[J]. Clin Epidemiol, 2013, 5: 299-309.
Thakali O, Raya S, Malla B, et al. Pilot study on wastewater surveillance of dengue virus RNA: Lessons, challenges, and implications for future research[J]. Environmental Challenges, 2022, 9: 100614.
Rodriguez-Barraquer I, Costa F, Nascimento E J M, et al. Impact of preexisting dengue immunity on Zika virus emergence in a dengue endemic region[J]. Science, 2019, 363(6427): 607-610.
Muirhead A, Zhu K, Brown J, et al. Zika Virus RNA Persistence in Sewage[J]. Environmental Science & Technology Letters, 2020, 7(9): 659-664.
Wilson M, Qiu Y, Yu J, et al. Comparison of Auto Sampling and Passive Sampling Methods for SARS-CoV-2 Detection in Wastewater[J]. Pathogens, 2022, 11(3).
Sikorski M J, Levine M M. Reviving the "Moore Swab": a Classic Environmental Surveillance Tool Involving Filtration of Flowing Surface Water and Sewage Water To Recover Typhoidal Salmonella Bacteria[J]. Appl Environ Microbiol, 2020, 86(13).
Corchis-Scott R, Geng Q, Seth R, et al. Averting an outbreak of SARS-CoV-2 in a university residence hall through wastewater surveillance[J]. Microbiology spectrum, 2021, 9(2): e00792-21.
Hasing M, Yu J, Qiu Y, et al. Comparison of Detecting and Quantitating SARS-CoV-2 in Wastewater Using Moderate-Speed Centrifuged Solids versus an Ultrafiltration Method[J]. Water, 2021, 13(16): 2166.
Markt R, Mayr M, Peer E, et al. Detection and stability of SARS-CoV-2 fragments in wastewater: impact of storage temperature[J]. Pathogens, 2021, 10(9): 1215.
Qiu Y, Yu J, Pabbaraju K, et al. Validating and optimizing the method for molecular detection and quantification of SARS-CoV-2 in wastewater[J]. Sci Total Environ, 2022, 812: 151434.
Zheng X, Deng Y, Xu X, et al. Comparison of virus concentration methods and RNA extraction methods for SARS-CoV-2 wastewater surveillance[J]. Science of The Total Environment, 2022, 824: 153687.
Pecson B M, Darby E, Haas C N, et al. Reproducibility and sensitivity of 36 methods to quantify the SARS-CoV-2 genetic signal in raw wastewater: findings from an interlaboratory methods evaluation in the U.S[J]. Environmental Science: Water Research & Technology, 2021, 7(3): 504-520.
Alexander M R, Rootes C L, Van Vuren P J, et al. Concentration of infectious SARS-CoV-2 by polyethylene glycol precipitation[J]. Journal of Virological Methods, 2020, 286: 113977.
Torii S, Oishi W, Zhu Y, et al. Comparison of five polyethylene glycol precipitation procedures for the RT-qPCR based recovery of murine hepatitis virus, bacteriophage phi6, and pepper mild mottle virus as a surrogate for SARS-CoV-2 from wastewater[J]. Science of The Total Environment, 2022, 807: 150722.
Barbosa M R F, Garcia S C, Bruni A D C, et al. One-year surveillance of SARS-CoV-2 in wastewater from vulnerable urban communities in metropolitan São Paulo, Brazil[J]. Journal of Water and Health, 2022, 20(2): 471-490.
Ahmed W, Bertsch P M, Bivins A, et al. Comparison of virus concentration methods for the RT-qPCR-based recovery of murine hepatitis virus, a surrogate for SARS-CoV-2 from untreated wastewater[J]. Sci Total Environ, 2020, 739: 139960.
Prado T, Fumian T M, Mannarino C F, et al. Wastewater-based epidemiology as a useful tool to track SARS-CoV-2 and support public health policies at municipal level in Brazil[J]. Water Res, 2021, 191: 116810.
Fumian T M, Leite J P, Castello A A, et al. Detection of rotavirus A in sewage samples using multiplex qPCR and an evaluation of the ultracentrifugation and adsorption-elution methods for virus concentration[J]. J Virol Methods, 2010, 170(1-2): 42-6.
Fuschi C, Pu H, Negri M, et al. Wastewater-based Epidemiology for Managing the COVID-19 Pandemic[J]. ACS ES&T Water, 2021, 1(6): 1352-1362.
Wurtzer S, Marechal V, Mouchel J, et al. Time course quantitative detection of SARS-CoV-2 in Parisian wastewaters correlates with COVID-19 confirmed cases. medRxiv 2020.04. 12.20062679, 2020.
Wurtzer S, Waldman P, Levert M, et al. SARS-CoV-2 genome quantification in wastewaters at regional and city scale allows precise monitoring of the whole outbreaks dynamics and variants spreading in the population[J]. Sci Total Environ, 2022, 810: 152213.
Wurtzer S, Marechal V, Mouchel J-M, et al. evaluation of lockdown impact on SARS-CoV-2 dynamics through viral genome quantification in Paris wastewaters[J]. MedRxiv, 2020.
Ye Y, Ellenberg R M, Graham K E, et al. Survivability, Partitioning, and Recovery of Enveloped Viruses in Untreated Municipal Wastewater[J]. Environ Sci Technol, 2016, 50(10): 5077-85.
Shi H, Pasco E V, Tarabara V V. Membrane-based methods of virus concentration from water: a review of process parameters and their effects on virus recovery[J]. Environmental Science: Water Research & Technology, 2017, 3(5): 778-792.
Torii S, Furumai H, Katayama H. Applicability of polyethylene glycol precipitation followed by acid guanidinium thiocyanate-phenol-chloroform extraction for the detection of SARS-CoV-2 RNA from municipal wastewater[J]. Sci Total Environ, 2021, 756: 143067.
Metcalf T G, Melnick J L, Estes M K. Environmental virology: from detection of virus in sewage and water by isolation to identification by molecular biology--a trip of over 50 years[J]. Annu Rev Microbiol, 1995, 49: 461-87.
Monpoeho S, Maul A, Mignotte-Cadiergues B, et al. Best viral elution method available for quantification of enteroviruses in sludge by both cell culture and reverse transcription-PCR[J]. Appl Environ Microbiol, 2001, 67(6): 2484-8.
Ahmed W, Smith W J M, Metcalfe S, et al. Comparison of RT-qPCR and RT-dPCR Platforms for the Trace Detection of SARS-CoV-2 RNA in Wastewater[J]. ACS ES T Water, 2022, 2(11): 1871-1880.
Garner E, Davis B C, Milligan E, et al. Next generation sequencing approaches to evaluate water and wastewater quality[J]. Water Res, 2021, 194: 116907.
Chiara M, D’erchia A M, Gissi C, et al. Next generation sequencing of SARS-CoV-2 genomes: challenges, applications and opportunities[J]. Briefings in Bioinformatics, 2020, 22(2): 616-630.
Bloom J S, Sathe L, Munugala C, et al. Massively scaled-up testing for SARS-CoV-2 RNA via next-generation sequencing of pooled and barcoded nasal and saliva samples[J]. Nature Biomedical Engineering, 2021, 5(7): 657-665.
John G, Sahajpal N S, Mondal A K, et al. Next-Generation Sequencing (NGS) in COVID-19: A Tool for SARS-CoV-2 Diagnosis, Monitoring New Strains and Phylodynamic Modeling in Molecular Epidemiology[J]. Current Issues in Molecular Biology, 2021, 43(2): 845-867.
Haque M F U, Bukhari S S, Ejaz R, et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan[J]. Virus Res, 2021, 302: 198484.
Lass A, Guerrero M, Li X, et al. Detection of Acanthamoeba spp. in water samples collected from natural water reservoirs, sewages, and pharmaceutical factory drains using LAMP and PCR in China[J]. Sci Total Environ, 2017, 584-585: 489-494.
Nathaniel B R, Ghai M, Druce M, et al. Development of a loop-mediated isothermal amplification assay targeting lmo0753 gene for detection of Listeria monocytogenes in wastewater[J]. Lett Appl Microbiol, 2019, 69(4): 264-270.
Daigle J, Racher K, Hazenberg J, et al. A Sensitive and Rapid Wastewater Test for SARS-COV-2 and Its Use for the Early Detection of a Cluster of Cases in a Remote Community[J]. Appl Environ Microbiol, 2022, 88(5): e0174021.
Schrader C, Schielke A, Ellerbroek L, et al. PCR inhibitors - occurrence, properties and removal[J]. J Appl Microbiol, 2012, 113(5): 1014-26.
Ahmed W, Simpson S L, Bertsch P M, et al. Minimizing errors in RT-PCR detection and quantification of SARS-CoV-2 RNA for wastewater surveillance[J]. Sci Total Environ, 2022, 805: 149877.
Hamouda M, Mustafa F, Maraqa M, et al. Wastewater surveillance for SARS-CoV-2: Lessons learnt from recent studies to define future applications[J]. Sci Total Environ, 2021, 759: 143493.
Andreychuk D B, Andriyasov A V, Nikonova Z B, et al. Armoured exogenous internal control for real-time PCR diagnosis of avian influenza[J]. Avian Pathol, 2019, 48(5): 492-498.
Bar T, Stahlberg A, Muszta A, et al. Kinetic Outlier Detection (KOD) in real-time PCR[J]. Nucleic Acids Res, 2003, 31(17): e105.
Qiu Y, Li Q, Lee B E, et al. UV inactivation of human infectious viruses at two full-scale wastewater treatment plants in Canada[J]. Water Research, 2018, 147: 73-81.
Laturner Z W, Zong D M, Kalvapalle P, et al. evaluating recovery, cost, and throughput of different concentration methods for SARS-CoV-2 wastewater-based epidemiology[J]. Water Res, 2021, 197: 117043.
Li Q, Lee B E, Gao T, et al. Number of COVID-19 cases required in a population to detect SARS-CoV-2 RNA in wastewater in the province of Alberta, Canada: Sensitivity assessment[J]. J Environ Sci (China), 2023, 125: 843-850.
Hart O E, Halden R U. Computational analysis of SARS-CoV-2/COVID-19 surveillance by wastewater-based epidemiology locally and globally: Feasibility, economy, opportunities and challenges[J]. Sci Total Environ, 2020, 730: 138875.
Chik A H S, Glier M B, Servos M, et al. Comparison of approaches to quantify SARS-CoV-2 in wastewater using RT-qPCR: Results and implications from a collaborative inter-laboratory study in Canada[J]. J Environ Sci (China), 2021, 107: 218-229.




