Sensititre SLOMYCO和RAPMYCO药敏板评估非结核分枝杆菌药物敏感性试验的研究

逄宇,教授/研究员,博士研究生导师,首都医科大学附属北京胸科医院细菌免疫室主任。长期从事分枝杆菌分子流行病学、耐药机制及其与宿主免疫互作等研究领域。现任职中华医学会结核病学分会委员兼副秘书长、中华医学会结核病学分会潜伏感染专委会主任委员、临检专委会副主任委员、中国医促会结核病防治分会基础学组副组长、中国老年及老年医学学会呼吸分会常务委员、Microbial Drug Resistance编委、《中华结核和呼吸杂志》编委等。主持国家自然科学基金等国家级课题7项,省部级课题12项,获得省部级奖励6项,入选北京市百千万人才工程,北京市“青年拔尖人才”,“科技新星”等人才项目,同时在国际知名期刊以第一作者或通讯作者发表SCI文章160余篇,影响因子超过700分。
【摘要】目的 非结核分枝杆菌(NTM)会引起不同形式的分枝杆菌病。ATS/ERS/ESCMID/IDSA最新指南规定,在选择治疗方案前应进行药物敏感性试验(DST),推荐使用最低抑菌浓度(MIC)试验作为标准方法。Sensititre SLOMYCO和RAPMYCO药敏板开展NTM DST较MIC方法更为简便,但目前仅有两项SLOMYCO和MIC方法的比较研究,尚未见RAPMYCO与MIC方法的比较研究。本研究旨在评估与金标准方法(MIC方法)相比,SLOMYCO和RAPMYCO在检测药物敏感性方面的应用。方法 本研究用临床分离株来自Adolfo Lutz研究所结核病实验室,且均为巴西圣保罗州常见的分枝杆菌菌种,并用标准菌株用于评价药敏重复性和重现性分析。比较使用刃天青染色的MIC方法和使用及不使用刃天青染色SLOMYCO和RAPMYCO药敏结果,结果间的一致性定义为相同稀释度或不同稀释度的MIC值在两次试验中的分类相同。结果按分类误差进行分析。结果 RAPMYCO与MIC方法DST结果中阿米卡星、多西环素、环丙沙星和甲氧苄啶/磺胺甲恶唑药物一致性为100%,克拉霉素和莫西沙星的一致性为83.3%,头孢西丁一致性为60%。SLOMYCO药敏板涉及阿米卡星和莫西沙星的DST结果一致性为80%,克拉霉素、利福布丁、利福平和环丙沙星中的一致性为60%。RAPMYCO和SLOMYCO的DST所检测药物的重复性和重现性一致性高,高于刃天青染色的MIC方法。但是,实验室的常规情况需要进行评估。结论 本研究发现,在实验中使用Sensititre药敏板操作步骤较MIC方法步骤少,且操作更安全、高效,在加入刃天青显色后读数更加准确,结果表明Sensititre药敏板可以更好纳入NTM常规诊疗中。
【关键词】药敏试验;最低抑菌浓度;非结核分枝杆菌
非结核分枝杆菌(Nontuberculous mycobacteria,NTM)可引起多种疾病,其中最常见的是肺部疾病。研究表明,NTM菌种的分布存在地理差异,且能够引起各种疾病,因此这种分布具有重要的临床意义[1, 2]。已有文献报道了190多种NTM[3],其中了解比较清楚的25类菌种会导致分枝杆菌病[4]。在巴西人口最多圣保罗州,经常引起分枝杆菌病的是鸟分枝杆菌(Mycobacterium avium,MAC)、堪萨斯分枝杆菌、胞内分枝杆菌、脓肿分枝杆菌、龟分枝杆菌、偶发分枝杆菌和外来分枝杆菌[5, 6]。NTM药物敏感性特点差异显著,主要治疗方案为推荐用于结核病治疗的方案[7]。随着NTM发病率的普遍增长,由其引起的疾病也随之增加[8],因此,简单且快速地进行药物敏感性试验(drug resistant test,DST),评估治疗药物显得极为重要。
选择正确的治疗药物很重要,因为治疗至少需要12个月,且使用无效的药物可能会耗费时间并影响患者的生活质量[9, 10]。最低抑菌浓度试验(minimum inhibitory concentration test,MIC)是国家临床实验室标准研究院(National Committee for Clinical Laboratory Standards Institute,CLSI)推荐的方法[11]。MIC通过在肉汤中稀释抗菌药物,达到抑制DST中微生物可见生长的最低浓度。对于NTM,该标准方法仅适用于具有临床意义的菌种[10-12]。MIC方法作为医学实验室自行使用的诊断检测方法,需特别注意避免药物浓度出错以及所有操作阶段可能的错误[13]。因此,建议具有丰富NTM诊断经验的实验室使用MIC方法[13, 14]。为使检测精度更高,可将刃天青用于微孔板比色试验[15-17]。
为更快提供结果并减少移液和药物储存过程中可能出现的问题,商品化的药敏板应运而生[13]。Trek Sensititre SLOMYCO和RAPMYCO板(Trek Diagnostics/Thermo Fisher,Bremen,德国)是含有冻干药物的微量稀释测定药敏板,用于检测缓慢生长(SLOMYCO)和快速生长(RAPMYCO)分枝杆菌的MIC值。可使用Sensititre® Vizion®设备(Trek Diagnostic Systems)自动读取专用Sensititre药敏板,并对图像进行数字化分析。然而,目前仅有两项研究对SLOMYCO和标准MIC方法进行对比[18, 19]。Babady等人[18]将SLOMYCO获得的结果与标准MIC进行比较,但研究中仅测试两个菌种(MAC和胞内分枝杆菌)且只使用克拉霉素一种抗菌药物,方法之间的一致性为93%,kappa值为0.87,因此显示出良好的一致性[18]。Chazel等人[19]在SLOMYCO与标准MIC方法比较研究中仅使用了海分枝杆菌,但涉及药物种类较多,其中阿米卡星、环丙沙星、克拉霉素、莫西沙星、利福布丁、磺胺甲恶唑-甲氧苄啶的一致性为100%,乙胺丁醇为98%,利福平为96%,结果表明SLOMYCO可作为海分枝杆菌的替代诊断检测工具(多西环素除外)[19]。
目前尚未见关于RAPMYCO药敏检测分枝杆菌对比研究的报道, Cavusoglu等人[20]使用RAPMYCO药敏板评估脓肿分枝杆菌、龟分枝杆菌、偶发分枝杆菌和外来分枝杆菌的药物敏感性特征,但未与任何其他方法进行比较。
因此,本研究旨在评估Sensititre SLOMYCO和RAPMYCO药敏板在常规实验室中用于检测临床NTM分离株药物感敏性特征,同时将标准MIC方法作为参考标准。
一、研究方法与材料
本研究的所有阶段均在Adolfo Lutz研究所。以上操作均在Adolfo Lutz研究所(Institute Adolfo Lutz,IAL)结核病和分枝杆菌病实验室的生物安全3级实验室(BSL3)进行。
1. 研究设计:本研究分三个阶段进行,为使Sensititre药敏板检测方法标准化,并与标准MIC方法(医学实验室自行使用的诊断检测方法)进行比较,评估检测结果重现性和重复性。同时,为使对比研究思路更加清晰,为三个阶段设计了流程图,如图1所示。
2. 参考菌株:第一阶段和第三阶段使用参考菌株MAC ATCC 25291及脓肿分枝杆菌ATCC 19977,第三阶段也使用堪萨斯分枝杆菌ATCC 12478。
3. 临床分离株:本研究用NTM临床分离株来自IAL结核病和分枝杆菌病实验室常规分离菌株,且这些分离株均为圣保罗州七种最常见的菌种,分别是MAC、胞内分枝杆菌、堪萨斯分枝杆菌、脓肿分枝杆菌脓肿亚种、脓肿分枝杆菌牛肝菌亚种、龟分枝杆菌、外来分枝杆菌和偶发分枝杆菌。选择的分离株通过PRA-hsp65 (PCR-restriction enzyme analysis,PRA)技术和生化试验进行鉴定[21]。
4. 基于Mueller-Hinton阳离子调节肉汤的最低抑菌浓度实验:本研究用参考标准MIC方法(医学实验室自行使用的诊断检测方法),按照CLSI规定的标准方案进行[11]。用两种不同方式制备的孔板测试临床分离株,一种用于缓慢生长的分枝杆菌(SGM),另一种用于快速生长的分枝杆菌(RGM)[检测流程分别为图2和3]。根据文件M100-S22[22]稀释药物、分装,并储存在-20℃以下备用。使用Mueller-Hinton阳离子调节肉汤(MHC)制备96孔药敏微孔板,加入可用于治疗分枝杆菌病的药物。在MHC中制备菌液接种物,浓度为0.5麦氏,添加到药敏板的每个孔中,使每孔中菌量最终浓度达1.5×105 UFC/ml。RGM孵育3天和SGM孵育7天后人工判读结果。读取结果后,如Carvalho等人[16]所述,将刃天青加入每个孔中,并根据文件M62[23]解释获得的MIC值。
5. Sensititre SLOMYCO和RAPMYCO药敏板的最低抑菌浓度实验:根据商品化SLOMYCO和RAPMYCO药敏板说明书进行药敏检测(图4和5)。RGM孵育3天和SGM孵育7天后,使用Sensititre® Vizion®设备在黑暗背景下通过明场间接光照读取结果后,加入刃天青染料,再孵育24小时,使用同一结果读取设备通过间接光照再次读取结果。根据文件M62[23]规定获取MIC值。
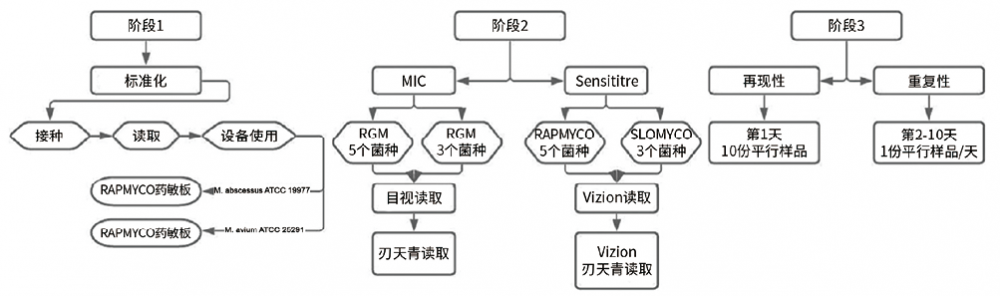
图1. 详细研究设计的流程图
注:A-H:第2-10列的药物浓度下降(μg/mL)且比例为2;CC:生长控制;CM:培养基无菌控制;INH:异烟肼;RF:利福平;EMB:乙胺丁醇;STR:链霉素;RB:利福布丁;CIP:环丙沙星;AK:阿米卡星;CLA:克拉霉素;MFX:莫西沙星
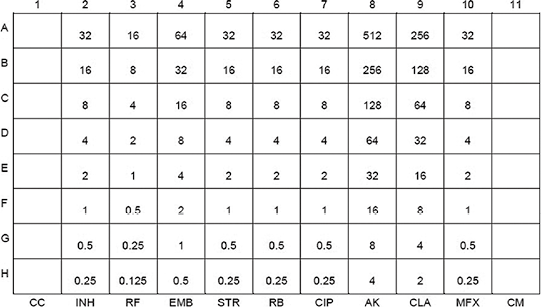
图2. SGM最低抑菌浓度试验药物分布设计
注:A-H:每种药物的浓度范围(μg/mL);CC:生长对照;CM:培养基无菌控制;AMK:阿米卡星;FOX:头孢西丁;CIP:环丙沙星;CLA:克拉霉素;DOX:多西环素;MFX:莫西沙星;SXT:甲氧苄啶/磺胺甲恶唑
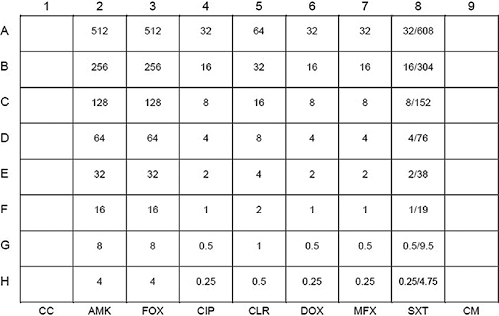
图. 3 RGM最低抑菌浓度试验药物分布设计
6. 精密度研究:在重复性分析中评估了日间精密度,即在一天内重复进行了十次试验(每一相同菌株使用十个药敏板,编号为1到10)。在重现性分析中评估了中间精密度,即在九天内重复进行了九次试验,每天每个菌株使用同一类药敏板。
药敏板制备和接种方法与临床分离株试验方法相同,并在使用和不使用刃天青的情况下读取读数,以便进行比较。
7. 数据分析:比较MIC方法和Sensititre药敏板读取结果。仅对IAL研究所开展药敏试验的药物进行了分析,结果间的一致性定义为相同稀释度或不同稀释度的MIC在两次试验中分类相同。
分类误差分为三类:次要(中度耐药和敏感或耐药结果)、主要(MIC:药敏结果;Sensititre:耐药结果 [假耐药]),或非常严重(MIC:耐药结果;Sensititre:药敏结果 [假敏感])。
二、研究结果
1. 最小抑菌浓度法和Sensititre方法(使用参考菌株)之间的比较:本研究测试了Sensititre药敏板和医学实验室自行使用的诊断检测方法用微孔板,并使用参考菌株进行比较,以验证可行性(表1)。测试参考菌株脓肿分枝杆菌ATCC19977时,两种方法都显示出一致的结果(莫西沙星除外)。这种不一致归类为次要误差,因为除分类误差之外,结果还存在两个浓度梯度差异。
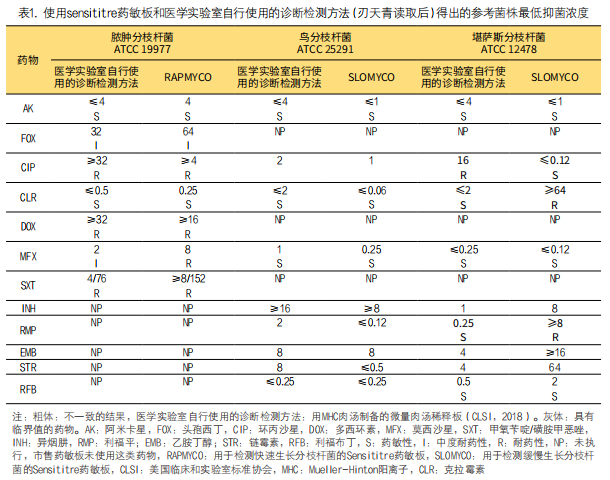
对于MAC ATCC 25291菌株,CLSI推荐的所用药物[23](阿米卡星、克拉霉素和莫西沙星)在不同方法检测结果一致性高。且异烟肼、环丙沙星、乙胺丁醇和利福布丁的MIC值一致,但链霉素和利福平有差异,使用医学实验室自行使用的诊断检测方法检测两种药物的MIC值比使用SLOMYCO药敏板MIC值高四倍。
参考菌株堪萨斯分枝杆菌ATCC 12478,阿米卡星、莫西沙星和利福布丁在两种方法中的结果一致。而环丙沙星的结果不一致,视为常严重的错误,因在医学实验室自行使用的诊断检测方法中显示耐药性但SLOMYCO药敏结果显示敏感(假敏感)。克拉霉素和利福平显示结果不一致的,标准MIC方法显示敏感而SLOMYCO药敏结果为耐药,视为假耐药,这两种药物均存在严重误差。
注:POS:阳性生长对照;AMI:阿米卡星;CIP:环丙沙星;CLA:克拉霉素;DOX:多西环素;EMB:乙胺丁醇;ETH:乙硫异烟胺;INH:异烟肼;LZD:利奈唑胺;MXF:莫西沙星;RFB:利福布丁;RIF:利福平;STR:链霉素;SXT:甲氧苄啶/磺胺甲恶唑。参见:http://tools.thermofisher.com/content/sfs/brochures/Sensititre-Plate-Layout-SLOMYCO.pdf
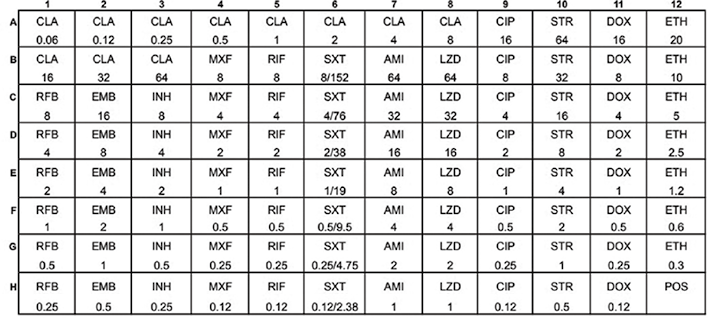
图4. Sensititre SLOMYCO药敏板设计和药物浓度
注:POS:阳性生长对照;AMI:阿米卡星;AUG2=阿莫西林/克拉维酸;FEP:头孢吡肟;FOX:头孢西丁;AXO:头孢曲松;CIP:环丙沙星;CLA:克拉霉素;DOX:多西环素;IMI:亚胺培南;LZD:利奈唑胺;MIN:米诺环素;MXF:莫西沙星;TGC:替加环素;TOB:妥布霉素;SXT:甲氧苄啶/磺胺甲恶唑。参见:https://assets.thermofisher.com/TFS-Assets/MBD/Specification-Sheets/Sensititre-Plate-Layout-RAPMYCO.pdf
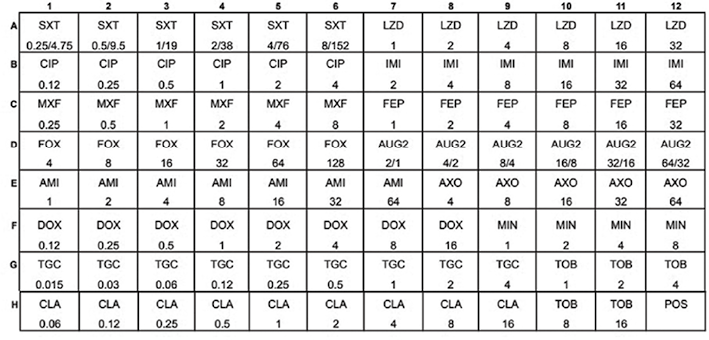
图5. Sensititre RAPMYCO药敏板设计和药物浓度
堪萨斯分枝杆菌的乙胺丁醇、异烟肼和链霉素的药敏MIC值尚未确定[23]。然而,这三种药物在两种方法中的结果不一致,与SLOMYCO药敏结果相比,乙胺丁醇、异烟肼和链霉素在标准MIC方法的MIC值分别低两倍、三倍和四倍。
2. 医学实验室自行使用的诊断检测方法与sensititre药敏板(使用临床分离株)之间的比较:对于临床分离株脓肿分枝杆菌脓肿亚种、脓肿分枝杆菌牛肝菌亚种和外来分枝杆菌,两种方法药敏结果一致(表2)。对于龟分枝杆菌,只有头孢西丁在参考方法显示耐药性,在RAPMYCO药敏方法中表现出中度耐药性,有三个浓度梯度差异,归类为轻微误差。对于偶发分枝杆菌,不同方法获得的头孢西丁、环丙沙星和克拉霉素药敏结果不一致,但只有头孢西丁和克拉霉素的结果被归类为轻微误差,两种药物显示为两个稀释对数的差异。
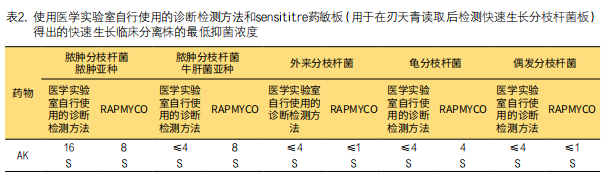
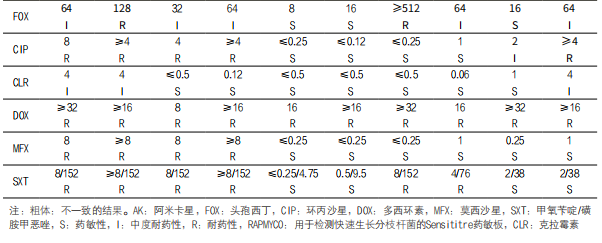
对于临床分离株胞内分枝杆菌,结果显示仅莫西沙星一致(表3)。阿米卡星和克拉霉素的误差非常大,因SLOMYCO药敏结果显示假敏感且医学实验室自行使用的诊断检测方法显示高耐药性。两种方法检测乙胺丁醇、异烟肼、利福平和链霉素药敏结果一致,但尚未确定以上4种药物对胞内分枝杆菌治疗的价值。相比之下,它与医学实验室自行使用的诊断检测方法相比,SLOMYCO药敏结果中环丙沙星和利福布丁MIC值分别高出四倍和五倍。
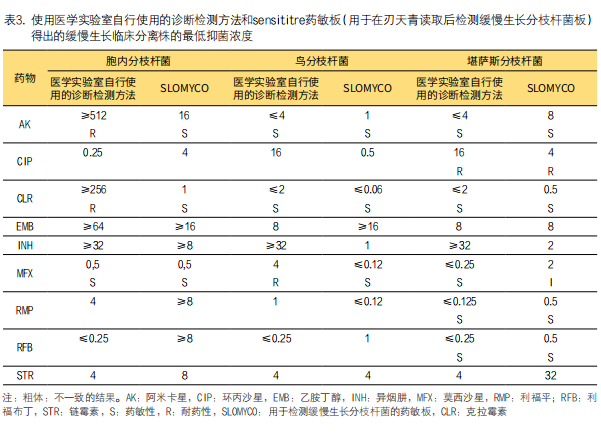
对于堪萨斯分枝杆菌,所有药物的两种药敏方法显示的MIC值和药物敏感性均一致,但莫西沙星除外,医学实验室自行使用的诊断检测方法显示敏感结果,而SLOMYCO药敏板显示中度耐药性,且存在三个稀释对数的差异,归类为轻微误差。
在未确定堪萨斯分枝杆菌药敏MIC值药物中,结果一致,但异烟肼和链霉素不一致,与自建MIC方法相比,异烟肼在SLOMYCO中的MIC值低四倍,而链霉素在SLOMYCO中的MIC值高三倍。
在MAC试验中,阿米卡星和克拉霉素的药敏结果一致,而莫西沙星不一致,归为重大误差。在未确定临界值的药物中,链霉素是唯一在两种方法中呈现一致性结果的药物,而环丙沙星和异烟肼药物的医学实验室自行使用的诊断检测方法药敏结果比SLOMYCO高五倍。对于利福平,MIC方法药敏结果比SLOMYCO高三倍,而利福布丁比SLOMYCO药敏MIC值低两倍。
3. 刃天青显色读数的评估:甲氧苄啶/磺胺甲恶唑和克拉霉素(表4),RAPMYCO药敏结果目视判读和加入刃天青后的比色判读的一致性低于100%。结果显示,测试的RGM临床分离株以及参考菌株脓肿分枝杆菌ATCC 19977中,仅有一株分离株药敏结果显示不一致。
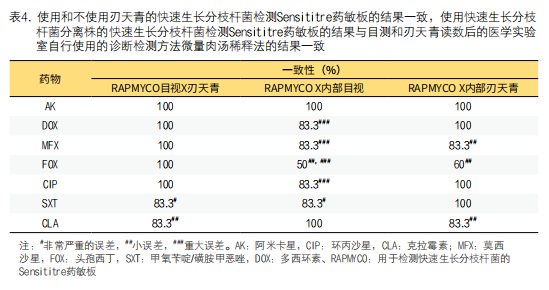
该分离株药敏检测结果目视读数显示对克拉霉素敏感,在添加刃天青后显示中度耐药,其误差评级最低。只有甲氧苄啶/磺胺甲恶唑的药敏结果归类为非常严重的误差,该分离株目视判读结果为敏感,在添加刃天青后显示耐药。在比较添加刃天青前后药敏判读药敏结果显示阿米卡星、多西环素、环丙沙星和甲氧苄啶/磺胺甲恶唑结果一致性达100%(表4)。而对于克拉霉素、莫西沙星和头孢西丁,结果差异被归类为小误差。
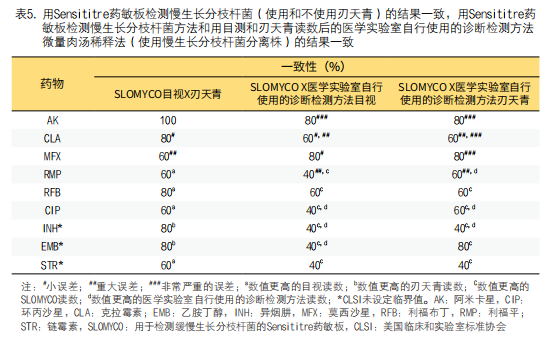
当比较添加刃天青前后SLOMYCO药敏结果时,只有阿米卡星在研究的五个SGM菌株之间有100%的一致性(表5)。对于所有SGM分离株,阿米卡星和莫西沙星的一致性为80%,克拉霉素、利福布丁、利福平和环丙沙星的一致性为60%(表5)。通过比较SLOMYCO和医学实验室自行使用的诊断检测方法药敏结果目视及刃天青判读情况,利福平、环丙沙星和乙胺丁醇一致性更高,其他药物无变化。
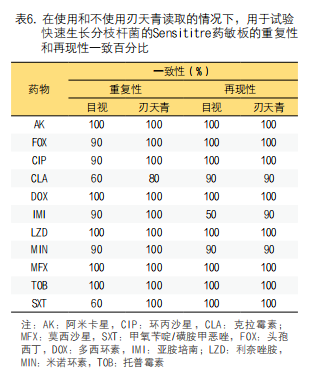
4. 精密度研究结果:分析RAPMYCO和SLOMYCO药敏结果在目视判读和使用刃天青后的重复性和重现性。在目视判读的RAPMYCO药敏重现性分析中,一致性高于90%,但克拉霉素和甲氧苄啶/磺胺甲恶唑除外,其一致性为60%。然而,加入刃天青后,除克拉霉素增至80%外,RAPMYCO其他所有药物的重复性均显示100%一致性。
在目视判读和刃天青判读的RAPMYCO药敏结果重复性分析显示一致性高于90%,但除亚胺培南的其他药物,目视判读药敏结果一致性为50%,加入刃天青判读的一致性增至90%(表6)。
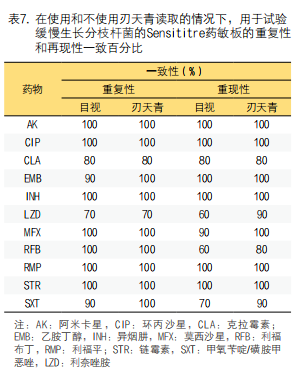
在目视判读和刃天青判读的SLOMYCO药敏重复性分析中,显示所有药物药敏结果均高度一致,而克拉霉素和利奈唑胺判读的一致性分别为80%和70%。在目视判读的SLOMYCO药敏结果重复性分析中,显示一般药物具有高度一致性,克拉霉素为80%,甲氧苄啶/磺胺甲恶唑为70%,利奈唑胺和利福布丁为60%。使用刃天青的重复性分析显示所有药物均具有高度一致性,但克拉霉素和利福布丁的一致性为80%(表7)。
三、分析与讨论
NTM病尚未建立标准的治疗方案,所以其药敏试验显得更加重要。美国和欧洲胸科学会最近发布的指南[10]强调了解NTM药物敏感性特点以确定适当治疗方法意义重大。CLSI推荐的DST方法为在肉汤中微量稀释MIC法[11],而使用医学实验室自行使用的诊断检测方法操作步骤多,并且需要经过药敏结果判读和结果解释培训的专业人员[16]。
自2015年起,Adolfo Lutz研究所的结核病和分枝杆菌实验室开始对NTM进行药敏试验,使用肉汤微稀释法和刃天青染色作为从巴西圣保罗州患者收集的临床分离株的常规方法。
结核病和分枝杆菌病实验室常规开展的药敏试验和本研究评估的不同之处在于在Sensititre药敏板使用了刃天青染料,使得没有读取设备的实验室能够以简单的方式进行试验。本研究中获得的数据表明刃天青染色不会改变读数并能够提供更可靠的结果。此外,据观察,医学实验室自行使用的诊断检测方法和Sensititre药敏结果的一致性在使用刃天青染色而增加。
通过比较医学实验室自行使用的诊断检测方法和Sensititre药敏板检测参考菌株上不同药物MIC值和分类标准,显示脓肿分枝杆菌ATCC 19977的一致性为85.7%,只有一个差异归类为莫西沙星的小误差,而对于SGM参考菌株,则观察到一些相互矛盾的结果,参考菌株MAC ATCC 25291药敏结果的一致性达77.7%,而堪萨斯分枝杆菌ATCC 12478,九种试验药物中仅有三个结果一致(33.3%)。
对临床分离株进行试验时,在医学实验室自行使用的诊断检测方法和RAPMYCO药敏结果的一致性高,不一致结果被视为小误差。根据Trollip等人[24]研究表明此类型错误主要发生在稀释度高于或低于临界值时,是由MIC临界值范围造成的。
另一方面,医学实验室自行使用的诊断检测方法和SLOMYCO药敏结果之间的一致性分析显示:许多差异视为主要误差以及非常严重的误差,可能因SGM需要更长的培养时间以及营养添加剂(OADC)。此外,Sensititre SLOMYCO药敏板中的大多数药物尚未有CLSI[23]确定的MAC复合群药敏MIC值,而在本研究中,MAC复合群菌株占SGM分离株的60%。
观察分析药敏结果发现尽管有一些药敏结果差别在1个对数或者1个对数之上,但依然归为同一类别的误差,然而因尚未建立分类误差标准,本研究中超过一个浓度的差异即报告结果不一致。
CLSI描述MAC的MIC折点指出,尽管乙胺丁醇、利福平和利福布丁药物在临床上有用,但尚未确定药物敏感或耐药的折点[23],且既往研究表明,在MAC患者中,体外MAC药敏结果和临床药物使用之间没有相关性[25, 26]。然而,常规诊疗流程中,药敏试验结果仅用于流行病学分析。这些药物中,链霉素可以代替阿米卡星;但未有将MIC值与MAC病的患者临床药物使用相关联的研究,因此,如果试验药物为链霉素,则仅应报告药敏试验的MIC值[23]。
除了以上可能导致SLOMYCO药敏结果不准确外,另一个必须考虑的因素是在制备微孔板时需要非常谨慎,以避免移液错误(可能导致药物浓度发生变化)。根据质量标准[11],药敏试验的最终结果受方法学的影响显著,必须仔细控制方法学以获得可重复的结果(实验室内和实验室间)。
Nikolayevskyy等人[27]进行了一项研究,以验证31个实验室用NTM DST的方法,发现结果之间存在显著差异,作者解释此种差异不是由于使用了不同的方法,而是因为接种物制备、孵育时间和对细菌生长的主观解释等差异造成的。
虽然我们使用的是CLSI推荐的方法[11],考虑到试验的每个步骤都可能发生错误并增加一系列偏差的困境,可使用现成的商品化冻干药物制备的药敏板,从而大大减少这些偏差。此外,商品化的药敏板配套读取药敏结果的设备,使读取的结果更加一致和可靠。
本研究的局限性在于未对成本进行分析。但是,考虑到医学实验室自行使用的诊断检测方法试验的错误的可能性更大和重复试验的需要,商品化的药敏板很可能具有成本效益,因为仅需检测一次分离株就可提供更正确的结果。
RAPMYCO和SLOMYCO药敏板在加入刃天青比色判读结果时,两者重复性和重现性高度一致,可提供较好的药敏结果。因此,建议在NTM的DST检测流程中使用。然而,后续需要进行更多的比较研究(主要针对SLOMYCO药敏板)来评估不一致结果。
结论:本文评估了Sensititre药敏板在NTM菌株中使用情况,发现使用刃天青染色后检测和读取的步骤数减少,可以更安全、高效地用于NTM DST检测。尽管该研究测试的分离株数量有限,但提供的数据仍有助于是否将商品化药敏板纳入诊断流程中。
参考文献
Marras TK, Daley CL. Epidemiology of human pulmonary infection with nontuberculous mycobacteria. Clin Chest Med 2002; 23:553-67.
Hoefsloot W, van Ingen J, Andrejak C, Angeby K, Bauriaud R, Bemer P, et al. The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples: An NTM-NET collaborative study. Eur Respir J 2013; 42:1604-13.
Parte AC, Sardà Carbasse J, Meier-Kolthoff JP, Reimer LC, Göker M. List of prokaryotic names with standing in nomenclature (LPSN) moves to the DSMZ. Int J Syst Evol Microbiol 2020; 70:5607-12.
van Ingen J. Diagnosis of nontuberculous mycobacterial infections. Semin Respir Crit Care Med 2013; 34:103-9.
Pedro Hda S, Pereira MI, Goloni Mdo R, Ueki SY, Chimara E. Nontuberculous mycobacteria isolated in São José do Rio Preto, Brazil between 1996 and 2005. J Bras Pneumol 2008; 34:950-5.
Zamarioli LA, Coelho AG, Pereira CM, Nascimento AC, Ueki SY, Chimara E. Descriptive study of the frequency of nontuberculous mycobacteria in the Baixada Santista region of the state of São Paulo, Brazil. J Bras Pneumol 2008; 34:590-4.
Egelund EF, Fennelly KP, Peloquin CA. Medications and monitoring in nontuberculous mycobacteria infections. Clin Chest Med 2015; 36:55-66.
Abe Y, Fukushima K, Hosono Y, Matsumoto Y, Motooka D, Ose N, et al. Host immune response and novel diagnostic approach to NTM infections. Int J Mol Sci 2020; 21:4351.
van Ingen J, Boeree MJ, van Soolingen D, Mouton JW. Resistance mechanisms and drug susceptibility testing of nontuberculous mycobacteria. Drug Resist Updat 2012;15:149-61.
Daley CL, Iaccarino JM, Lange C, Cambau E, Wallace RJ, Andrejak C, et al. Treatment of nontuberculous mycobacterial pulmonary disease: An official ATS/ERS/ESCMID/IDSA clinical practice guideline. Clin Infect Dis 2020; 71:905-13.
Clinical and Laboratory Standards Institute. Susceptibility Testing of Mycobacteria, Nocardia and Other Aerobic Actinomycetes. CLSI Standart M24. 3rd ed. Wayne, PA: Clinical and Laboratory Standards Institute; 2018.
Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med 2007; 175:367-416.
Lee J, Armstrong DT, Ssengooba W, Park JA, Yu Y, Mumbowa F, et al. Sensititre MYCOTB MIC plate for testing Mycobacterium tuberculosis susceptibility to first- and second-line drugs. Antimicrob Agents Chemother 2014; 58:11-8.
Woods GL, Williams-Bouyer N, Wallace RJ Jr. Brown-Elliott BA, Witebsky FG, Conville PS, et al. Multisite reproducibility of results obtained by two broth dilution methods for susceptibility testing of Mycobacterium avium complex. J Clin Microbiol 2003; 41:627-31.
Palomino JC, Martin A, Camacho M, Guerra H, Swings J, Portaels F. Resazurin microtiter assay plate: Simple and inexpensive method for detection of drug resistance in Mycobacterium tuberculosis. Antimicrob Agents Chemother 2002; 46:2720-2.
Garcia de Carvalho NF, Sato DN, Pavan FR, Ferrazoli L, Chimara E. Resazurin microtiter assay for clarithromycin susceptibility testing of clinical isolates of Mycobacterium abscessus group. J Clin Lab Anal 2016; 30:751-5.
Jamil NI, Wahab WN, Ali IA, Yahaya ML. Direct resazurin microplate assay in drug susceptibility testing of smear-positive sputum samples against Mycobacterium tuberculosis. Malays J Med Sci 2018; 25:59-66.
Babady NE, Hall L, Abbenyi AT, Eisberner JJ, Brown-Elliott BA, Pratt CJ, et al. evaluation of Mycobacterium avium complex clarithromycin susceptibility testing using SLOMYCO Sensititre panels and JustOne strips. J Clin Microbiol 2010; 48:1749-52.
Chazel M, Marchandin H, Keck N, Terru D, Carrière C, Ponsoda M, et al. evaluation of the SLOMYCO Sensititre® panel for testing the antimicrobial susceptibility of Mycobacterium marinum isolates. Ann Clin Microbiol Antimicrob 2016; 15:30.
Cavusoglu C, Gurpinar T, Ecemis T. evaluation of antimicrobial susceptibilities of rapidly growing mycobacteria by Sensititre RAPMYCO panel. New Microbiol 2012; 35:73-6.
Chimara E, Ferrazoli L, Ueky SY, Martins MC, Durham AM, Arbeit RD, et al. Reliable identification of mycobacterial species by PCR-restriction enzyme analysis (PRA)-hsp65 in a reference laboratory and elaboration of a sequence-based extended algorithm of PRA-hsp65 patterns. BMC Microbiol 2008; 8:48.
Clinical and Laboratory Standards Institute. Susceptibility Testing of Mycobacteria, Nocardiae, and Other Aerobic Actinomycetes; Approved Standard. NCCLS document M24-A2. 2nd ed. Wayne, PA: Clinical and Laboratory Standards Institute; 2011.
Clinical and Laboratory Standards Institute. Performance Standards for Susceptibility Testing of Mycobacteria, Nocardia spp., and Other Aerobic Actinomycetes. CLSI document M62. 1st ed. Wayne, PA: Clinical and Laboratory Standards Institute; 2018.
Trollip AP, Moore D, Coronel J, Caviedes L, Klages S, Victor T, et al. Second-line drug susceptibility breakpoints for Mycobacterium tuberculosis using the MODS assay. Int J Tuberc Lung Dis 2014; 18:227-32.
Pulmonary disease caused by Mycobacterium avium-intracellulare in HIV-negative patients: Five-year follow-up of patients receiving standardised treatment. Int J Tuberc Lung Dis 2002; 6:628-34.
Kobashi Y, Yoshida K, Miyashita N, Niki Y, Oka M. Relationship between clinical efficacy of treatment of pulmonary Mycobacterium avium complex disease and drug-sensitivity testing of Mycobacterium avium complex isolates. J Infect Chemother 2006; 12:195-202.
Nikolayevskyy V, Maurer FP, Holicka Y, Taylor L, Liddy H, Kranzer K. Novel external quality assurance scheme for drug susceptibility testing of non-tuberculous mycobacteria: A multicentre pilot study. J Antimicrob Chemother 2019; 74:1288-94.
本研究作者声明:
1. 伦理批准:本研究经Adolfo Lutz研究所科学和研究伦理委员会批准,编号为30-I/2016。
2. 财政支持和赞助:本文得到了Thermo Fisher Scientific的支持,其为本研究提供了Sensititre培养基和板条。
作者已指导并对所有内容和编辑决定负责。
3. 利益冲突:本研究无利益冲突。




