Microflex LT Biotyper鉴定丝状真菌的影响因素

张敬霞,硕士、主管技师。2019年毕业于河北北方学院,获临床检验诊断学医学硕士学位;现任航空总医院主管检验师;主要研究方向细菌的流行病学特征及耐药性分析;发表学术论文4篇,参与新药体外抗菌作用研究、北京市科技计划课题及国家科技重大专项子课题各一项。
【摘要】目的 快速而准确的鉴定丝状真菌对于侵袭性真菌感染患者的及时救治尤为重要,Matrix-Assisted Laser-Desorption/Ionization Time of Flight Mass Spectrometry (MALDI-TOF MS)可以通过丝状真菌的核糖体蛋白而实现丝状真菌的快速鉴定。本研究探讨不同的培养和鉴定条件(培养基、培养温度、培养时间、生长部位、提取方法)对Microflex LT Biotyper鉴定丝状真菌的影响。方法 收集102株临床分离的丝状真菌分别接种于马铃薯葡萄糖琼脂培养基(PDA)和沙氏葡萄糖琼脂培养基(SDA),分别于27℃和35℃进行培养,在培养的第24h-168h,每24h对菌落的边缘部位(菌丝为主)和中间部位(孢子为主)分别使用直接涂抹法和甲酸乙腈提取法进行鉴定。结果 Microflex LT Biotyper对丝状真菌的鉴定率SDA是PDA的1.090倍(P=0.044)、35℃是27℃的1.018倍(P=0.001)、48h-144h是其他时间的1.033倍(P=0.001)、甲酸乙腈提取法是直接涂抹法的1.169倍(P=0.000)。结论 培养基、培养温度、培养时间和提取方法均影响Microflex LT Biotyper对丝状真菌的鉴定率。将丝状真菌接种于SDA培养基并放置35℃进行培养,在培养48h时使用甲酸乙腈法进行提取可获得理想的鉴定结果和高质量的质谱图谱。
【关键词】Microflex LT Biotyper;丝状真菌;培养条件,鉴定方法;影响因素
由于丝状真菌的形态各异且细胞壁厚,导致丝状真菌的鉴定始终是一个难题[1]。近年来,分类学的研究显示丝状真菌的表型鉴定极其复杂且具挑战性,尤其是由隐匿性丝状真菌引起的感染通过表型鉴定时往往会得到错误的鉴定结果[2]。一种新型的鉴定工具MALDI-TOFMS可以通过病原微生物的核糖体蛋白实现物种的鉴定,但是它多用于细菌、酵母菌、病毒和其他病原微生物的鉴定,但是很少用于丝状真菌的鉴定[3]。尽管近年来越来越多的学者进行MALDI-TOF MS鉴定丝状真菌的研究,但是鉴定技术和条件仍然需要持续探索。本研究是探讨在5种影响因素条件下,Microflex LT Biotyper鉴定丝状真菌的最佳条件。
材料与方法
1. 材料:菌株来源 收集解放军总医院第五医学中心和宁夏医科大学总医院临床患者分离的丝状真菌102株,剔出了同一患者反复出现的同一菌株,将所有菌株通过纯培养和分子测序后冻存于-80℃备用。
实验器材,马铃薯葡萄糖琼脂培养基和沙氏葡萄糖琼脂培养基(OXOI,英国);70%甲酸、乙腈、无水乙醇(Fisher, 美国);基质(Biomer-ieux,美国);Microflex LT Biotyper和96孔板(Bruker Daltonics,德国)。
2. 方法:菌株培养和传统方法学鉴定 将冻存实验菌株分别接种于SDA和PDA培养基,然后分别放置于27℃和35℃进行培养。由实验室内有经验的实验人员通过观察菌落形态和棉兰染色后镜下观察菌丝结构来进行传统方法学的鉴定。Microflex LT Biotyper鉴定丝状真菌见图1。
直接涂抹法 每24小时使用无菌牙签将菌落的边缘部位和中间部位分别直接均匀的涂抹在96孔板上,然后在96孔板上加1ul70%甲酸溶液,自然风干,最后在96孔板上加1ul基质溶液,自然风干后由Microflex LT Biotyper进行鉴定。
甲酸乙腈提取法 每24小时使用无菌牙签分别取菌落的边缘部位和中间部约5毫克放置于300ul的蒸馏水中,然后加入900ul的无水乙醇,涡旋后在1,3000rpm的转速下离心2分钟,弃掉上清液后自然风干。在风干后的菌体中加入70%的甲酸溶液50ul,涡旋后再加入50ul乙腈溶液,再次涡旋后在1,3000rpm的转速下离心2分钟,加1ul上清液至96孔板上,自然风干后加1ul基质溶液,自然风干由Microflex LT Biotyper进行鉴定。
数据统计 使用SPSS22统计学软件对数据进行分析,计数资料以频数及构成比(%)表示。卡方检验用来分析单一因素对Microflex LT Biotyper鉴定丝状真菌结果的影响,回归分析用来统计多重因素对Microflex LT Biotyper鉴定丝状真菌结果的影响,P<0.05
时具有统计学意义。
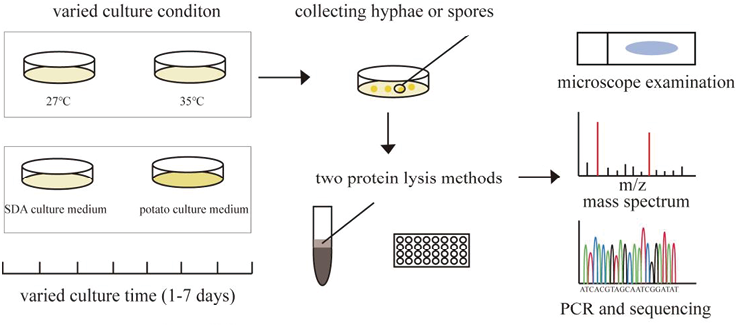
图1. Microflex LT Biotyper鉴定丝状真菌实验流程图
结 果
1. 临床丝状真菌:102株丝状真菌分离自临床感染患者的痰液、皮肤、鼻咽拭子、分泌物等标本,菌种包括烟曲霉20株、黄曲霉21株、黑曲霉15株、塔宾曲霉6株、镰刀菌8株、土曲霉6株、草酸青霉3株、构巢曲霉5株、小孢根霉2株,其他丝状真菌包括米根霉、卷枝毛霉、宛氏拟青霉、总状共头霉、短帚霉、焦曲霉、皮炎外瓶霉、红曲霉、赤曲霉、尖端赛多孢菌、白僵菌、红色毛癣菌、暗色节菱孢、黄孢原毛平革菌、毛束霉菌和木霉菌各1株。
2. Microflex LT Biotyper鉴定结果与常规方法学鉴定结果比对:分子生物学方法为该实验的金标准。结果显示 Microflex LT Biotyper对102株丝状真菌的菌属和菌种鉴定率分别达到了88.2%(90/102)和84.3%(86/102)(见图2)。而传统法学对菌属和菌种的鉴定率仅为79.4%(81/102)和63.7%(65/102)。 Microflex LT Biotyper对曲霉菌和镰刀菌的鉴定效果较好,菌种水平的鉴定率分别达到了90.7%和100%。但对于青霉菌,Microflex LT Biotyper和常规鉴定方法学都只能将其鉴定到菌属水平。
12株被Microflex LT Biotyper鉴定错误的丝状真菌,包括6株塔宾曲霉,被错鉴定为黑曲霉;另外6株分别为黄曲霉、总状共头霉、红曲霉、暗色节菱孢、黄孢原毛平革菌和毛束霉菌。值得注意的是这是我们首次提到使用Microflex LT Biotyper对赤曲霉、暗色节菱孢、毛束霉菌和总状共头霉的鉴定。但是除了赤曲霉,其他三种丝状真菌我们没有得到鉴定结果,但是质谱图谱清晰(见图3)。
3. Microflex LT Biotyper鉴定丝状真菌影响因素的分析(见表1):结果统计时剔除了12株鉴定失败的丝状真菌。SDA和PDA的鉴定率分别为70.3%和68.4%;27℃和35℃的鉴定率分别为67.8%和70.9%;边缘部位和中间部位的鉴定率分别为70.0%和68.7%;直接涂抹法和甲酸乙腈提取法的鉴定率分别为67.7%和71.0%;24h-168h的鉴定准确率分别为61.5%、70.6%、67.9%、71.5%、71.5%、73.6%和68.8%。单一影响因素分析,不同的培养基χ2=4.036(P=0.045)、不同的培养温度χ2=10.923(P=0.001)、不同的培养时间χ2=63.266(P=0.000)、不同的提取方法χ2=13.103(P=0.000),这四种因素均为P<0.05,因此它们对Microflex LT Biotyper鉴定丝状真菌具有统计学意义的影响。而不同的提取部位χ2=1.582(P=0.174),P>0.05,提示提取部位对Microflex LT Biotyper鉴定丝状真菌无显著影响。对于培养时间,我们做了进一步的多重分析,卡方检验结果显示培养时间可以分为三个节点(24h、48-144h和168h),表明在培养的48h至144h内,Microflex LT Biotyper鉴定丝状真菌的结果不具有统计学差异。
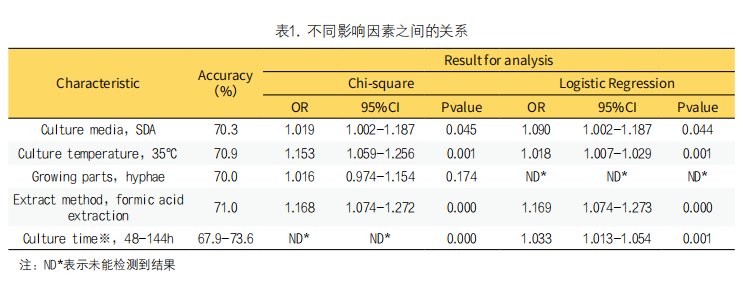
对具有统计学意义的四种影响因素做进一步回归分析,结果显示48h-144h是24小时和168h的1.033倍,由于48h-144h之间各点Microflex LT Biotyper鉴定丝状真菌的结果不具有统计学差异,根据早期诊断的原则,48h是Microflex LT Biotyper鉴定丝状真菌的最佳时间点。对于其他三种影响因素甲酸乙腈提取法是直接涂抹法的1.169倍,35℃培养是27℃的1.018倍,SDA培养基培养是PDA的1.090倍。
4. Microflex LT Biotyper鉴定丝状真菌设定cutoff值的影响(见图2):分子生物学方法为金标准。将菌种水平的cutoff值从≥2.0调整为1.7-1.999,菌种水平的鉴定率会从76.7%(69/90)显著提升到96.7%(87/90)。cutoff值对于常见的丝状真菌例如烟曲霉和黄曲霉影响不大,但是对于少见丝状真菌例如短帚霉、赤曲霉、白僵菌和木霉菌,当菌种水平cutoff值为≥2.0时,Microflex LT Biotyper将无法得到鉴定结果,但是当菌种水平cutoff值调整为1.7-1.999甚至1.5-1.699时,它们的菌种水平鉴定率可达100%。
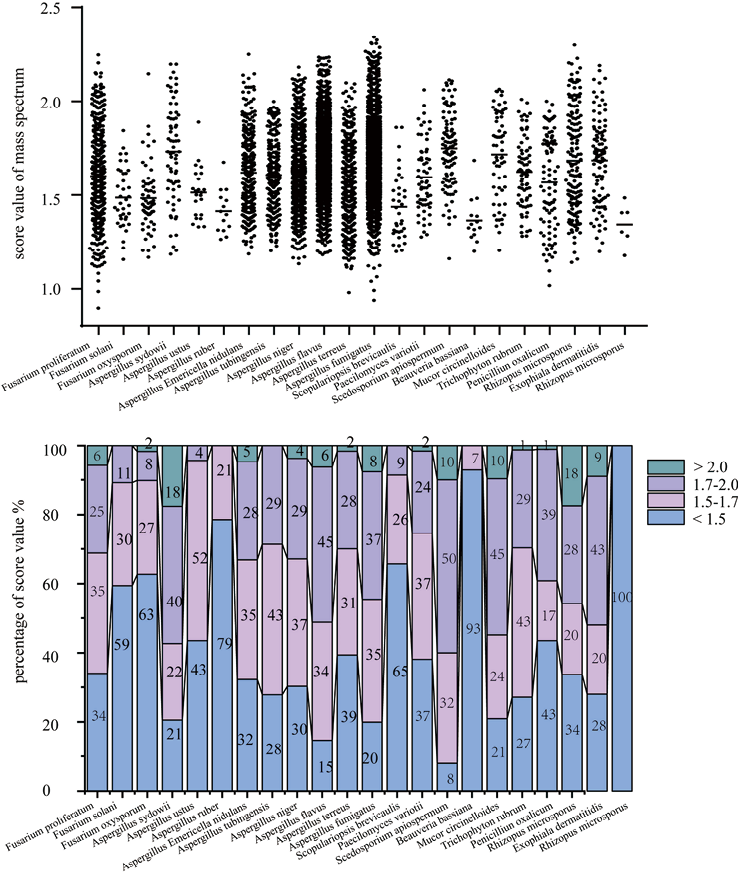
注:ND*表示未能检测到结果
图2. 实验菌株的散点图及不同cutoff值的鉴定准确率
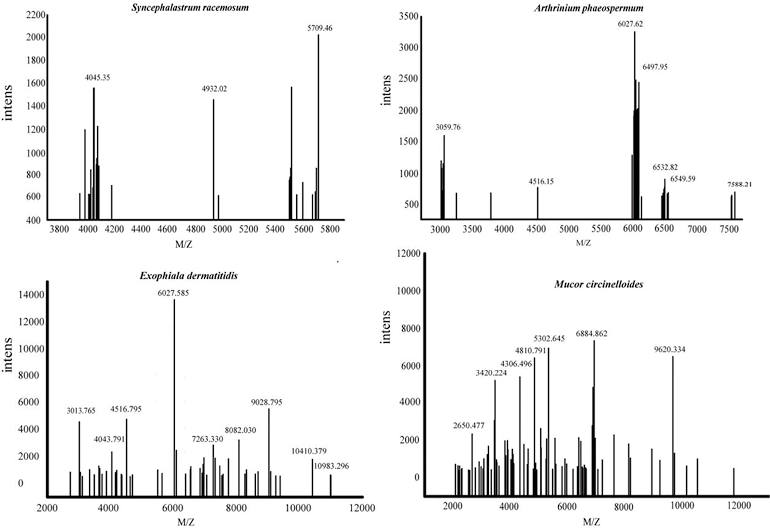
图3. 总状共头霉、暗色节菱孢、皮炎外瓶霉、卷枝毛霉质谱图谱
讨 论
丝状真菌在自然界中的分布极其广泛,大约有300种丝状真菌为导致人类感染的病原菌,它们具有不同的形态学特征、临床特征和耐药性。侵袭性丝状真菌感染对于重症监护室和器官移植患者具有很高的死亡率[4-5]。因此,早期诊断并及时治疗对于感染丝状真菌的患者极为重要。但由于丝状真菌生长缓慢,所以很大程度上降低了诊疗进程[6-7]。另外丝状真菌的形态各异,增加了临床的诊断难度[4]。因此,这些因素对早期诊断和治疗提出了很大的挑战。MALDI-TOF MS在临床实验室的应用加快了对细菌和酵母菌快速而准确的鉴定[1-3]。布鲁克公司在2012年首次宣布建立丝状真菌质谱图谱库,该图谱库包含了127种丝状真菌,使得丝状真菌的快速鉴定看到了曙光。但是Markus Stein等人对该数据的验证性实验仅得到了13.6%的菌种水平鉴定率[8]。丝状真菌在不同的生长时期具有不同的组成成分(包括分生孢子、子实体、表面菌丝、基底菌丝体)这些都增加了Microflex LT Biotyper鉴定丝状真菌的难度,并且目前对影响因素方面的研究极少。
本文首次用Microflex LT Biotyper完成4种丝状真菌鉴定,并探索了影响因素。根据丝状真菌的菌落形态特征,有研究者将其分为菌丝部位和孢子部位,由于孢子的细胞壁比较厚导致核糖体蛋白很难析出,因此研究者认为菌丝是质谱鉴定丝状真菌的最佳部位[9]。Liet等人使用MALDI-TOF MS对曲霉菌的菌丝部位进行鉴定,结果显示鉴定率达到了89%[10]。MALDI-TOF MS也可以用于非曲霉菌的鉴定,对菌种和菌属的鉴定正确率可达88.9%和92.2%[8]。Zhou等人对52株烟曲霉进行了影响因素的研究,结果显示,培养时间对鉴定结果的影响具有统计学意义,然而三种培养基(沙氏葡萄糖琼脂培养基、沙氏葡萄糖液体培养基和 察氏固体培养基)之间的鉴定结果不具有统计学差异,并且培养的温度之间也不具有统计学差异[3]。本研究结果与此结论不同,Microflex LT Biotyper鉴定丝状真菌时,SDA培养基较PDA培养基有优势,可能的原因是本研究所选培养基与上述研究所选培养基不同。甲酸乙腈提取法优于直接涂抹法,是由于在甲酸乙腈提取法的实验过程中,在相对较多的丝状真菌中加入了大量的甲酸,二者充分作用,导致细胞壁破坏更加完全,从而使得核糖体蛋白充分析出进而得到满意的质谱图谱。本研究显示35℃是丝状真菌的理想生长温度,因为在此温度下,丝状真菌生长迅速,从而使得在实验过程中可以获得较多的菌丝和孢子,最终增加了核糖体蛋白的析出量。对于培养时间,根据早期诊断原则,48h是最佳的鉴定时间节点。24h鉴定结果最差,是由于此时丝状真菌菌落过小,无法提取到适量的核糖体蛋白。在中间部位和边缘部位的研究中我们没有发现二者在鉴定结果上具有统计学差异,导致该结果的原因可能是因为我们在实验过程中,无法完全区分二者之间的组成成分。总之,Microflex LT Biotyper鉴定丝状真菌的最佳条件是将丝状真菌接种于SDA培养基,放置于35℃进行培养,在培养48h后,使用甲酸乙腈提取法进行鉴定,此时可获得理想的鉴定结果。
黄曲霉、总状共头霉、红曲霉、暗色节菱孢、黄孢原毛平革菌和毛束霉菌各1株未能实现鉴定,除了黄曲霉之外,其余5株鉴定失败是因为数据库没有它们的质谱图谱,因此急需完善质谱数据库,尤其是增加少见丝状真菌的图谱。对于黄曲霉鉴定失败的原因可能是同一丝状真菌不同菌株之间的孢子和细胞壁具有定性和定量的差异[10],这就导致同一种丝状真菌之间具有不同的鉴定效果。Microflex LT Biotyper不能区分黄曲霉和米曲霉,是由于二者具有基本一致的基因序列[3]。塔宾曲霉和黑曲霉都属于黑曲霉组[11],导致本研究中Microflex LT Biotyper将6株塔宾曲霉错误的鉴定为黑曲霉。
本研究结果发现适当降低菌种水平的cutoff值可以提高Microflex LT Biotyper鉴定丝状真菌的准确率,该发现与Li Y等人的研究结果一致[10]。因此,基于这些研究,我们可以考虑重新调整Microflex LT Biotyper鉴定丝状真菌的cutoff值。虽然培养24h时Microflex LT Biotyper鉴定丝状真菌的效果最差,但是还是可以得到准确的鉴定结果。相反,常用方法学需要等到菌落长成一定的形态特征并且镜下观察到它们的菌丝结构才可鉴定,该过程耗时较长,因此,Microflex LT Biotyper极大程度的缩短了诊断时间,为临床的及时诊治提供了有利保障。
本研究探索以Microflex LT Biotyper快速鉴定25种丝状真菌,具有低成本和稳定性好等优点;较传统方法更加高效,较分子生物学方法操作简单[12-13]。初步确定Microflex LT Biotyper鉴定效果受培养基种类、培养温度、培养时间和提取方法的影响;需要在实际工作中不断积累经验,探索对丝状真菌标准的培养方式和样本制备流程[14];丝状真菌的数据库也需要不断完善,尤其是少见丝状真菌的质谱图谱,多方位提高丝状真菌的正确诊断率,改善真菌感染者的预后。
参考文献
Vidal-Acuna MR, Ruiz-Perez de Pipaon M, Torres-Sanchez MJ, Aznar J. 2018. Identification of clinical isolates of Aspergillus, including cryptic species, by matrix assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF MS). Med Mycol 56: 838-846
Pihet M, Le Govic Y. 2017. Reappraisal of Conventional Diagnosis for Dermatophytes. Mycopathologia 182:169-180.
Zhou L, Chen Y, Xu Y. 2017. Performance of VITEK mass spectrometry V3.0 for rapid identification of clinical Aspergillus fumigatus in different culture conditions based on ribosomal proteins. Infect Drug Resist 10: 499-506.
Li Y, Wang H, Hou X, Huang JJ, Wang PC, Xu YC. 2020. Identification by Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry and Antifungal Susceptibility Testing of Non-Aspergillus Molds. Front Microbiol 11: 922.
Ranque S, Normand AC, Cassagne C, Murat JB, Bourgeois N, Dalle F, Gari-Toussaint M, Fourquet P, Hendrickx M, Piarroux R. 2014. MALDI-TOF mass spectrometry identification of filamentous fungi in the clinical laboratory. Mycoses 57:135-40.
Gomez-Velasquez JC, Loaiza-Diaz N, Norela Hernandez G, Lima N, Mesa-Arango AC. 2020. Development and Validation of an In-House Library for Filamentous Fungi Identification by MALDI-TOF MS in a Clinical Laboratory in Medellin (Colombia). Microorganisms 8.
Zvezdanova ME, Escribano P, Ruiz A, Martinez-Jimenez MC, Pelaez T, Collazos A, Guinea J, Bouza E, Rodriguez-Sanchez B. 2019. Increased species-assignment of filamentous fungi using MALDI-TOF MS coupled with a simplified sample processing and an in-house library. Med Mycol 57:63-70.
Lau AF, Drake SK, Calhoun LB, Henderson CM, Zelazny AM. 2013. Development of a clinically comprehensive database and a simple procedure for identification of molds from solid media by matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol 51:828-34.
Iriart X, Lavergne RA, Fillaux J, Valentin A, Magnaval JF, Berry A, Cassaing S. 2012. Routine identification of medical fungi by the new Vitek MS matrix-assisted laser desorption ionization-time of flight system with a new time-effective strategy. J Clin Microbiol 50:2107-10.
Li Y, Wang H, Zhao YP, Xu YC, Hsueh PR. 2017. evaluation of the Bruker Biotyper Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry System for Identification of Aspergillus Species Directly from Growth on Solid Agar Media. Front Microbiol 8:1209.
Gomez-Velasquez JC, Loaiza-Diaz N, Norela Hernandez G, Lima N, Mesa-Arango AC. 2020. Development and Validation of an In-House Library for Filamentous Fungi Identification by MALDI-TOF MS in a Clinical Laboratory in Medellin (Colombia). Microorganisms
Stein M, Tran V, Nichol KA, Lagace-Wiens P, Pieroni P, Adam HJ, Turenne C, Walkty AJ, Normand AC, Hendrickx M, Piarroux R, Karlowsky JA. 2018. evaluation of three MALDI-TOF mass spectrometry libraries for the identification of filamentous fungi in three clinical microbiology laboratories in Manitoba, Canada. Mycoses 61:743-753.
Becker PT, de Bel A, Martiny D, Ranque S, Piarroux R, Cassagne C, Detandt M, Hendrickx M. 2014. Identification of filamentous fungi isolates by MALDI-TOF mass spectrometry: clinical evaluation of an extended reference spectra library. Med Mycol 52:826-34.
17. Hendrickx M. 2017. MALDI-TOF MS and Filamentous Fungal Identification: A Success Story? Current Fungal Infection Reports 11:60-65.




