临床分子诊断实验室的风险点与风险评估

刘向祎,主任技师,教授,博士生导师。现任首都医科大学附属北京同仁医院检验科主任。主要研究方向为生物标志物的筛选应用、实验室管理和方法标准化。先后发表中英文论文90余篇,主持参与多项国家和省部级重点课题;获国家发明专利4项。参与国家标准和行业标准制定16项。主要学术兼职:CNAS评定委员会委员,CNAS医学实验室主任评审员,中华医学会检验分会临床生化学组委员等。
近年来,风险管理的理念在医学实验室管理中日益受到广泛重视。风险管理指如何在一个肯定有风险的环境里把风险减至最低的管理过程。风险管理方法是基于对风险的认识、衡量和分析,选择最有效的方式,主动地、有目的、有计划地处理风险,以最小成本争取获得最大安全保证的管理方法。对于医学实验室的风险管理,指当检验结果影响患者安全时,实验室应评估工作过程和可能存在的问题对检验结果的影响,应修改过程以降低或消除识别出的风险,并将做出的决定和采取的措施文件化。实验室风险评估包括实验室风险估计和风险评价两个过程。风险估计是将危害发生概率与严重程度赋值的过程,接下来进行风险评价,估计风险与给定标准的比较,确定风险的可接受性。总结起来,即判断实验室有哪些风险点,然后判断风险点发生的概率与它的严重程度,进而评价可接受性。其目的是与实验室预定风险进行比较,把风险设定在可接受或可控的范围。
在临床实践中有学者认为实验室风险评估仅仅是生物安全管理,实际上实验室风险管理是基于实验室生物安全,加入检测项目风险和设备医疗安全等,最大程度保证检测人员和病人的安全。实验室风险管理相关规范、标准有风险管理原则及指南ISO27001和ISO31000。关于生产商风险管理的标准有医疗设备风险管理ISO14971、识别和控制实验室误差来源的风险管理技术(FMEA、FTA、FRACAS)、CLSI EP18和CLSI EP23。基于风险管理的实验室质量控制规范可以学习ISO22367。医学实验室可通过风险管理和持续改进减少错误,本文以分子实验室为例,介绍了实验室风险管理的实施过程。
一、标本采集的风险评估
临床实验室的风险评估涉及检验前、中、后的风险评估。
1. 标本采集运输保存:(1)检验前。方法选择和标本类型关乎结果,对于新冠核酸检测可以做普通的荧光定量PCR、测序或等温扩增。标本采集、运送和保存是质量保证的关键性环节,在采集点是否需要放置冰箱、在常温放置多久等问题都直接关系到检验质量,可通过验证放置时间、提取效率是否降低来保证质量。实验结果的不准确60%以上来源于检验前,涉及方法选择、标本类型选择、标本的采集、运送和保存。(2)检验中。以新冠核酸检测为例,北京定期都会有监督管理部门——如北京市疾控中心、区疾控中心还有每个区的质量监督部门组织的检查。实验室环境的分区需要做好温湿度控制,物品专用、设备专用和试剂专用。设备需要维护、定期校准。试剂要做好性能验证或性能确认。做好人员培训、室内质控和室间质评。对于新冠核酸检测来说,特别需要做好人员之间的比对,因为基于人工操作的步骤比较多。(3)检验后。需要对数据分析、结果解读、对临床应用(筛查、诊断、预测、治疗)的指导和评估与临床的诊断符合率。对于新冠核酸检测来说,由于是定性项目相对比较简单,对于定量的项目则需要判读截断点以及临床诊疗符合率有多少。
2. 分子检测标本采集原则:(1)样本的留取量和类型:CNAS-CL02:2012:5.4.4.2采集前活动的指导(c)原始样品采集的类型和量,这部分有详细规定。对新冠核酸检测来说可以采用鼻拭子、咽拭子和肛拭子,规范地采集咽拭子,其后续核酸提取效率并不亚于鼻拭子。采集量和采集类型应当熟记。(2)样本不被外界因素污染:CNAS-CL02:5.4.4.3:使用无DNase和/或无RNase的一次性密封容器。其中强调了密闭,不应在外界环境中打开。(3)适当处理满足检验要求:CNAS-CL02:5.4.4.3(b)正确使用抗凝管;(c)用于RNA扩增检测的血样宜进行抗凝处理;(d)分泌物、拭子、肿瘤组织等样品留取注意事项,这部分有明确规定。(4)保护操作者不被潜在病原体感染:CNAS-CL05:实验室生物安全认可准则,第二部分第九条介绍了采集病原微生物样本应当具备的条件。
3. 分子检测的标本转运:(1)针对不同基质的标本和检测目的做出适当处理:CNAS-CL02:5.4.7指出,样品应尽快处置并以适当方式存储,检验样本若为组织,固定液的量和固定时间应符合检测要求。(2)标本妥善处理后及时送检:CNAS-CL02:2012:5.4.5(a)要求,运送时间适合于申请检验的性质和实验室专业特点。基于文件要求样本在室温下放置不能超过4小时。(3)送检过程环境需要符合要求:CNAS-CL02:2012:5.4.5(b)规定,保证收集、处理样品所需温度范围,使用指定保存剂,以保证样品的完整性。在夏天需要放置冰袋保证标本环境温度,冬天的华北地区保证三层包装、保证运输的完整性。(4)超时存储标本需要重新评估标本完整性:CNAS-CL02:5.4.7规定,超长储存后的标本,使用前应再次评估样本的完整性。因需要半个小时运送到实验室,所以至少每三个半小时运输一次。(5)转运过程不会污染环境:CNAS-CL02:2012:5.4.5(c)规定,确保运送者、公众及接受实验室安全,并符合规定要求。运输箱里配备消毒的器具,防备意外的遗洒。
4. 标本转运及质量要求:DNA检测全血、血清和血浆标本可室温稳定24h,2~8℃可稳定72h。RNA检测应加入RNA稳定剂,转运须在2~8℃进行。DNA在Tris-EDTA中更稳定,室温可保存半年,2-8℃≥1年,-20℃≤7年,-70℃≥7年。保存的产物应当标记清楚。分子检测血清、血浆标本长期储存需分离转移至无RNase酶的密封容器中。分子检测血液标本不宜反复冻融,反复冻融会严重影响样本中核酸片段的完整性,多次冻融应该评估标本完整性。还需要指出,分子检测血液标本不能放置在自动除霜功能的冰箱中。
二、分子诊断实验室的风险评估
1. 分子实验室环境设置:环境设施基本要求:(1)应合理分区,工作有序。CNAS-CL02:5.2.2规定,涉及基因扩增检验的实验室原则上至少3个独立的工作区域,具体实验室分区应依据其所使用的技术平台及检验项目和工作量而定,例如处置区与工作区分开。(2)环境条件符合要求。CNAS-CL02:5.2.2规定,实验室及相关办公设施应提供与开展工作相适应的环境。应依据所用设备和实验过程的要求,制定环境温湿度控制要求并记录。(3)防止各区域相互污染,互不干扰。CNAS-CL02:5.2.6规定,不同实验区域应该有其各自的清洁用具以防止交叉污染,进入基因扩增实验室应按单一方向进行。
2. 分子诊断实验室主要设计依据:(1)依据《关于印发医疗机构临床基因扩增检验实验室管理办法的通知》(卫办医政发〔2010〕194号)及其附件《医疗机构临床基因扩增检验实验室工作导则》有关规定,北京地区开展分子检测需经北京市医学检验质量控制与改进中心审核。国内其他地区也根据这些规定指导分子生物学检测实验室的设计与建设。(2)相关规范和标准有:GB50346《生物安全实验室建筑技术规范》、GB19489《实验室生物安全通用要求》,特别建议要重视WS/T233-2018《病原微生物实验室生物安全通用准则》。WS/T442-2014《临床实验室生物安全指南》中,对生物安全实验室做了清晰而明确的规定。检验科工作人员要意识到,只要进到检验科,就是进到了一个相对不安全的区域,就需要告知其风险,临床实验室应参照二级生物安全实验室实现分区及分流。《医疗卫生机构检验实验室建筑技术导则》中也有相应的规定。
3. 分子诊断实验室设备和试剂及材料:(1)分子诊断实验室各分区应合理安排设备。CNAS-CL02:5.3.1.1规定,实验室应配备其提供服务所需的全部设备,例如各种冰箱、离心机。(2)仪器、试剂和材料必须符合国家规定和相关行业标准。(3)设备必须定期进行校准和维护。CNAS-CL02-A001:5.3.1.4规定,应定期对加样枪、生物安全柜、扩增仪等进行校准。需要确认实验室校准的内容、标准,复核后签字。5.3.1.5指出,设备故障修复后,可通过一些合适的方式进行检测、验证。(4)根据需要选择枪头量程及是否带滤芯,根据PCR仪选择不同的八连管,RNA检测应用DEPC水,并定期检测是否合格。避免实验室出现假阳性。
4. 分子诊断实验室布局:传统PCR实验室分为四个区:试剂准备区、样本制备区、核酸扩增区和产物分析区。在新冠核酸检测中至少需要试剂准备区、样本制备区和扩增分析区。PCR实验室设计的核心问题是如何避免污染。样本制备间(BSL-2)要适当增大,便于处理较多的样本量。当采用新风系统有困难时,每区的空气只能在其室内自循环。如果没有新风系统,要保证充分的通风。
5. 分子诊断实验室环境设施要求:各区域入口应有明确的标识,不同区域物品不能混用。各区域应配备足够的温度适宜的存储空间,并进行温度监控和记录。各区域根据设备及实验要求设定符合要求的温度和湿度。各区域备有消毒物品,装备紫外线灯、水池、电话、网线以及做好应急预案。标本处理区放置洗眼器、高压锅等。
6. 分子诊断实验室设计细节问题:房间大小要根据设备数量和工作确定,一般要求试剂储存区最小,样本处理区最大。消毒设备方面,实验室内应配置内排式压力蒸汽灭菌锅,以及其他适用的消毒设备。设备摆放原则是避免相互干扰,避免气溶胶污染。桌柜和设备之间应有足够的间距,以便于清洁。标本制备区设立紧急洗眼器。实验室走廊宜设置喷淋装置。
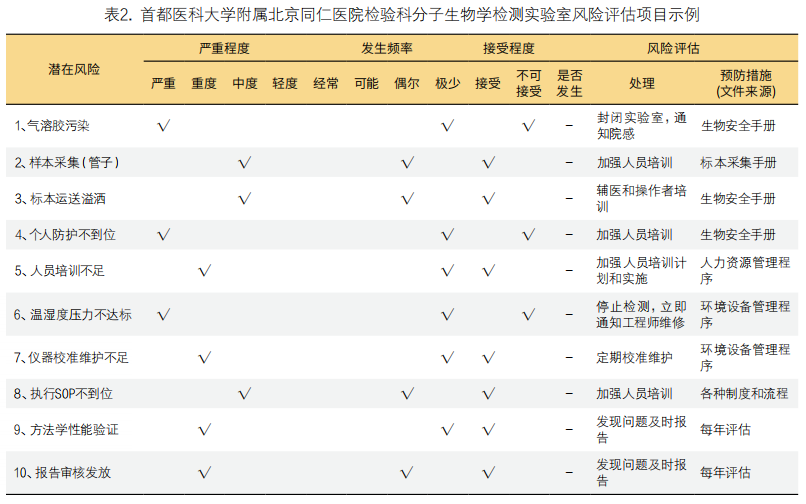
7. 分子诊断实验室设备要求:PCR仪应该带有UPS电源。另外RNA检测必须配备低温离心机和超低温冰箱。这是实验室设计时需要注意的,应预留出这些设备的摆放空间。如表1。
三、分子实验室的性能验证
分子实验室性能验证有相应的法规,即CNAS-GL039:分子诊断检验程序性能验证指南。
1. 性能验证的时机:CNAS-GL039:4.1对于性能验证的时机作了规定。CNAS-CL02:5.3.1.4指出,应进行外部校准的设备,如果符合检测目的和要求,可按制造商校准程序进行。5.3.1.5指出,设备维护与维修可能影响方法学性能,故障修复后可通过合适的方式进行相关的检测、验证。5.3.2.3规定实验室应对新批号或同一批号的试剂和关键耗材进行验收。性能验证时机包括:(1)检验程序常规应用前;(2)任何严重影响检测系统分析性能的情况发生后,包括仪器主要部件故障,仪器搬迁,设施、环境严重失控等;(3)检测系统包含的任一要素(仪器、试剂、校准品等)变更,如试剂升级、仪器更新、校准品溯源性改变都需要按照新系统进行验证。
2. 性能验证的参数:CNAS-GL039:4.2对此做了说明,对于PCR定性和定量检测、二代测序(NGS)等项目的性能验证参数分别做了规定。PCR定量检测项目需要验证包括测量正确度、测量精密度(重复性和中间精密度)、测量不确定度、线性范围等;PCR定性检测项目需要验证包括符合率、检出限、抗干扰能力、交叉反应等;NGS选择性能验证的指标包括符合率、检出限等。需要注意的是,如果样本类型包括血清和血浆,应进行血清和和血浆一致性的验证。检验程序高度依赖人工操作或判断,应进行不同人员间的比对。
3. 性能验证判断标准:CNAS-GL039:4.3对于性能验证的判断标准做了详细规定。实施性能验证过程需要注意以下几点:(1)熟悉操作系统;(2)室内质控在控;(3)实验方案设计要综合考虑标本选择(标本类型、标本数量、浓度、不同基因型)、试验周期、比对方法的选择、结果统计和评价;(4)实验室应独立完成性能验证试验,充分了解系统的检测性能;(5)应优先选取临床标本;(6)保留原始数据。
四、专业技术人员培训的风险评估
1. 专业人员培训和资质:人员培训和资质是最难的地方,也是当前实验室头疼的问题。人员培训的原则是:(1)相关人员资质符合要求,持证上岗。CNAS-CL02:5.1.2要求实验室负责人从事临床分子检测至少三年,操作人员应经过有资质的培训机构培训合格取得上岗证。(2)合理的人员培训计划及内容。CNAS-CL02:5.1.2要求实验室应为所有员工提供培训。(3)合理的人员配置。CNAS-CL02:5.1.3要求实验室至少具有2名检验人员。(4)工作能力定期评估。CNAS-CL02:5.1.6指出应每年评估员工的工作能力。这也是实验室的一个难点。
2. 人员培训及效果评估:人员培训需要建立分子诊断实验室培训制度、计划和培训记录。工作人员培训应该包括分子诊断相关的、分子实验室质量保证和质量管理方面的专门培训。效果评估是定期对学习效果进行评估,每十二个月至少一次对学习培训效果进行评估,对新来的人员可能一年要进行两次。总而言之,可执行的培训效果是有针对性的计划,重点为新进人员、和转岗人员,采用考试、操作、问答形式等进行效果评估。
五、检测报告的风险评估
1. PCR出现假阳性结果:PCR出现假阳性结果的原因有很多,例如扩增产物污染、标本污染、DNA污染、试剂污染、非特异扩增(引物设计、交叉反应、碱基错配)等,需要高年资工作人员去处理。此时需要立即停止实验,采取去除污染措施。例如无污染试剂、紫外线消毒、反复擦拭等。预防措施有:实验室严格分区,严格执行SOP,紫外线消毒、化学去污(10%次氯酸钠或70%乙醇擦拭器物及仪器表面),使用一次性耗材、吸头必须有滤芯等等,同时做好操作人员的反复培训。
2. PCR出现假阴性结果:原因包括:核酸提取(RNA降解、DNA丢失)问题、试剂问题(引物设计不佳、聚合酶失活)、反应体系中有抑制剂的存在以及扩增条件不适宜(比如温度不当)等。预防措施包括去除RNA酶防止RNA降解、最大可能地得到质、量均佳的核酸,合理设计引物、去除抑制物,并优化扩增反应条件等。需要指出的是,手工核酸提取操作复杂,操作人员如果未经正规培训很容易出错,造成假阴性。
3. 结果报告:以目前分子生物学检测实验室开展较多的药物基因组学项目为例,如CYP 2C19基因检测指导氯吡格雷用药和HLA-B*1502基因检测指导卡马西平等用药。分子检测报告需要包括备注!就像我们的新冠核酸检测报告一样,目的是规避实验室风险。核酸检测阴阳性结果可能受病程、标本、检测方法局限性的影响,因此需结合临床综合考虑。HLA-B*1502等位基因可作为卡马西平治疗后出现严重致死性皮肤不良反应的危险因素,尤其是对于汉族和其他东南亚人群。所以需要注明给临床提示。
六、临床分子诊断实验室风险评估建议
临床分子诊断实验室风险评估在实验室建立使用之前必须评估,以后每年进行,也要根据每年发生的事件、或者基于其他检验科的不良事件去评估。另外需要在设备、材料、方法、人员、环境发生变化时或变更检验工作流程后进行评估,保证实验室的风险降到最低。
分子实验室要最大程度地降低可能出现的污染。首先应是预防污染,而不是排除,可以从以下几个细节着手:(1)实验分区:操作器材专用,要有一定的方向性。如试剂准备→样本制备→扩增区及分析区。切记任何一间的产物及器材不要拿到其他两个工作区。(2)分装试剂:试剂反应液先分装成20ul的小管(一次分装不宜过多,以一周用完为宜),严格-20℃保存。试剂应放置在装有紫外灯的超净工作台。(3)严格取样:按照取样规程操作,做到专物专用(如取样袋、剪刀等),禁止一物用在多个样品上。(4)扩增产物处理:扩增产物容易产生气溶胶,尽量不开盖;丢弃时需放入密封袋中密封好再处理。(5)环境设施消毒:每次用完台面、超净台或者生物安全柜都要用酒精擦拭、紫外照射。(6)实验工具和设备定期清洁:移液枪和提取器等需定期清洗。(7)注意通风换气。每次实验都要保证排气扇或风扇的运行。
风险评估的流程是根据各种风险评估风险发生的概率、性质、范围和时限,还有风险产生的危害,共同形成风险评估报告,确定可接受的风险,实施减少风险的管理措施、手段和风险应对培训、应急措施及效果评估(如图1)。做风险评估的目的是为了采取措施规避风险,使实验室的操作更规范,采取相应的培训,降低风险的发生。
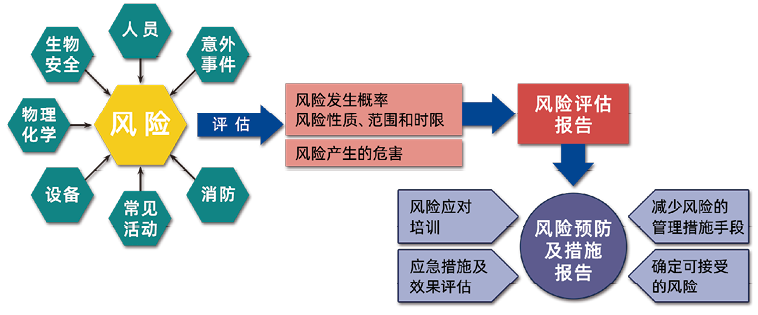
图1. 风险评估流程图
如表2,笔者所在的首都医科大学附属北京同仁医院检验科将实验室潜在的风险和发生的严重程度、发生频率、接受程度、处理和预防措施制作成表格,可以发现大多数潜在风险都是人的原因,而预防措施就是把风险点告知大家。人员培训时把关键点以问答的形式告知,加强规范,有助于降低风险。