异基因骨髓移植后急性移植物抗宿主病生物诊断标志物与临床应用价值

沈佐君,教授、主任技师,博士研究生及博士后导师。中国科学技术大学附属第一医院(安徽省立医院)伦理委员会主任委员兼办公室主任,安徽省临床检验质量控制中心常务副主任。主要从事分子诊断、高效毛细管电泳、液相色谱质谱等技术临床应用研究 。兼任中国医学装备协会临床检验装备技术专业委员会副会长;中国医师协会临床检验专业委员会常委;中国医院管理协会临床检验专业委员会常委;安徽省医院协会临床检验专业委员会主任委员;中国合格评定国家认可委员会医学实验室认可主任评审员等;《临床输血与检验杂志》副主编;《中华检验医学杂志》、《临床检验杂志》、《临床医学》《分子诊断与治疗杂志》等杂志编委。承担国家科技部重大专项分课题、国家自然科学基金面上项目和安徽省自然科学基金共7项。获安徽省级科学技术二等奖2项,三等奖4项,在国内外发表文章130余篇。第八届国家卫生计生突出贡献中青年专家,享受国务院政府特殊津贴。
异基因骨髓移植(allo-BMT)是迄今为止最有效的治疗血液系统恶性肿瘤的一种方法。移植物抗宿主病(GVHD),特别是急性移植物抗宿主病(aGVHD)是患者allo-BMT后发病和死亡的主要原因。因此亟需尽早准确地诊断aGVHD。尽管截至目前已有许多关于aGVHD诊断标志物的研究,但鲜有临床应用。血浆或血清中的蛋白、核酸,特别是微小RNA(miRNAs)一直是主流生物标志物研究的重点。鉴于细胞外囊泡(EVs)来源于各种体液且内容丰富,其也同样逐渐受到研究人员的青睐。本文介绍目前具有一定潜在价值的异基因骨髓移植后急性移植物抗宿主病诊断标志物,供研究人员、IVD厂商和临床医生参考。
一、aGVHD概述
虽然异基因骨髓移植(allo-BMT)是迄今为止最有效的治疗白血病等血液系统恶性肿瘤的肿瘤免疫疗法,然而相关副作用——移植物抗宿主病(GVHD),特别是急性移植物抗宿主病(aGVHD)的不良反应仍然是移植后发病和死亡的主要原因,影响超过50%的移植患者[1]。其多发于肠道、皮肤和肝脏。aGVHD的临床表现和其他相关信息见表1。
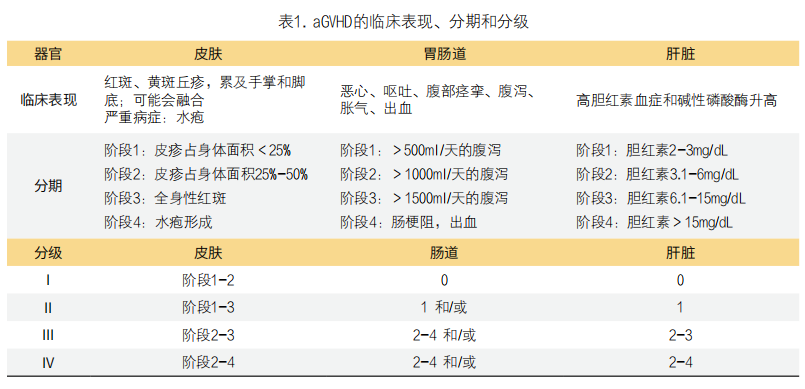
鉴于此病的危害性,准确的早期诊断aGVHD对于指导治疗方案和防止长期的严重并发症至关重要。不幸的是,很少有在aGVHD症状出现后能迅速可靠地识别患者的非侵入性诊断的选择。目前,aGVHD的诊断主要基于临床症状且需要侵入性检查,如胃肠道、皮肤或肝脏的活检[2]。然而,不同病人在不同时期的症状和体征存在差异,这就使得诊断aGVHD极具挑战性[3-5]。因此为了更好地预后和治疗,需要迫切地寻找一系列可靠且非侵入性的诊断标志物。
根据美国国立卫生研究院对生物标志物定义的修订,诊断性生物标志物是指在临床疾病发生时识别患者并帮助及时诊断和启动治疗,且能帮助区分患病患者和未患病却有类似症状的患者的一类分析[6-7]。截至目前,研究人员已经发现了一些潜在的生物标志物诸如miRNAs,细胞因子,趋化因子及其受体[8]。
通常生物标志物可以分为全身性(系统性)和器官特异性两类,前者的水平随全身性损伤发生而发生相应变化,后者则与目标组织相关。其中第一种包括miRNA例如miR-411、miR-28-5p、miR-489;致瘤性抑制蛋白2(ST2);以及许多生物标志物Panel。而后者包括适用于胃肠道GVHD的再生胰岛衍生蛋白3α(REG3α)、细胞角蛋白18片段(CK18F)和T细胞免疫球蛋白及粘蛋白结构域分子3(TIM3)、适用于肝脏GVHD的肝细胞生长因子(HGF)和适用于皮肤GVHD的弹力素(elafin)[9-15]。
细胞外囊泡(Extracellular vesicles,EVs)被认为是细胞间通讯的重要媒介,因为它们能够传输生物大分子,从而影响受体细胞和母体细胞广泛的生理和病理功能[16]。目前,至少有三个主要的EVs亚群,分别是凋亡体(apoptotic bodies)、核外颗粒体(ectosomes)和外泌体(exosomes)[17]。外泌体参与炎症过程并在多种病理状态中起关键作用[18]。考虑到使用EVs作为生物标志物载体的主要优势是其易于从除血液以外的体液中收集,越来越多的研究者选择EVs,特别是外泌体,作为他们的生物标志物研究对象,就像Lia G等[8]研究了EVs与aGVHD发病的潜在相关性一样。
临床组学领域的一个重要目标是鉴定体液中能够相对廉价测量并用于疾病早期诊断的生物标志物。目前,大多数研究者目光集中在血清或血浆上,但完整的唾液对于非侵入性样本收集非常有吸引力[19]。此外,由于尿液可以大量非侵入性收集,所以其也可作为替代血液的一种潜在的疾病生物标志物来源的选择[20]。出于这个原因,Wachalska M等为预防诊断aGVHD进行了尿液蛋白组肽谱分析,并取得了一些进展[21]。
尽管目前已经鉴定出了许多用于aGVHD的诊断标志物,遗憾的是,这些标志物没有一个可以直接应用于临床环境中[22]。如果能够在临床应用中使用一种早期且准确的诊断标志物,必将为aGVHD的治疗带来很大的进展。本文旨在通过对当前有关aGVHD生物标志物的全面知识进行综述,以帮助临床医生更好地治疗aGVHD并为研究人员提供一些新的思路以尽快找到一批新的诊断标志物。
二、aGVHD诊断标志物种类
1. 蛋白类标志物:由于细胞凋亡在aGVHD的病理生理过程中起着重要作用,Luft T等试图确定正在进行的GVHD活动是否由血清CK18F水平反映[10]。基于他们的数据,CK18F监测被建议用于定量评估与肠道或肝脏GVHD相关的细胞凋亡活动。因此,CK18F评估可能有助于区分活动性GVHD和具有类似症状的非GVHD情况,并监测对免疫抑制治疗的反应。
由于aGVHD累及皮肤、肝脏和胃肠道,对器官特异性生物标志物的研究也在蓬勃发展。研究人员利用aGVHD患者的皮肤样本结合下一代蛋白组学技术发现了elafin,其研究结果在某些方面支持aGVHD的特异性诊断[12, 23, 24]。然而针对elafin的酶联免疫吸附试验(ELISA)缺乏重复性,并且elafin作为诊断标志物在大型队列中复现尚具有挑战性[12]。同样也借助下一代蛋白组学技术,Reg3α和TIM3在aGVHD患者下消化道样本中被发现,并且已经在多个队列中单独或与其他生物标志物联合验证[14, 25-28]。此外,HGF和CK18F水平与肝脏GVHD发展之间显著相关[10, 28]。
多种蛋白质标志物组合可能比单一蛋白质标志物更有利于诊断,因此也有部分研究人员致力于研究蛋白质组合。首次确定并验证的用于aGVHD诊断的生物标志物组合是一组4种蛋白质标志物(sIL-2Rα+TNFR1+HGF+IL-8),该组合通过与抗体阵列竞争以筛选aGVHD患者的血浆样本[29]。它可以用于在临床症状出现之初诊断aGVHD,并被视为一种全身性生物标志物。
ST2是经过最广泛验证的用于aGVHD及其无复发死亡率(NRM)的生物标志物,可以单独[15, 30, 31]或与其他标志物组合[25, 32]使用进行测量。ST2是通过采用先进的无胶凝蛋白质组学和高分辨质谱技术对治疗抗性aGVHD样本进行分析而发现的[15]。它还在多个平台上进行了测试和验证[33],并已在移植后7天或14天的大规模队列中被验证为aGVHD及NRM的预后标志物[15, 25, 34]。鉴于此,几个研究小组已将ST2纳入生物标志物组合研究中。
上述提到的研究均是以患者的血浆或血清作为研究对象进行的。此外,唾液作为一种有吸引力的诊断性体液,其具有高度复杂和特异性组成,专门用于保护口腔,包含有机和无机溶质以及特定的肽和来自两种免疫组分的特异性成分[35]。且相比于血液,唾液样本易于非侵入性收集、便于处理和蛋白含量较低等几个关键优点。因此,Chiusolo P等把目光放在aGVHD患者唾液上并发现aGVHD患者唾液内S100A8和S100A9水平较高[19]。至于尿液方面,尿液蛋白质组学鉴定出与欧洲队列中的aGVHD相关的肽谱[36, 37]。此外,Weissinger EM等报道了对423名患者的17肽尿液蛋白组aGVHD特异性分类器的多中心验证[21]。而粪便蛋白与72名消化道GVHD患者对皮质类固醇的反应有关,因此也被认为是潜在的生物标志物[38]。但毕竟粪便蛋白样本量较小,并且使用了不同的分析方法进行的单中心队列研究,因此尚未证明这些蛋白质是可靠的诊断标志物。
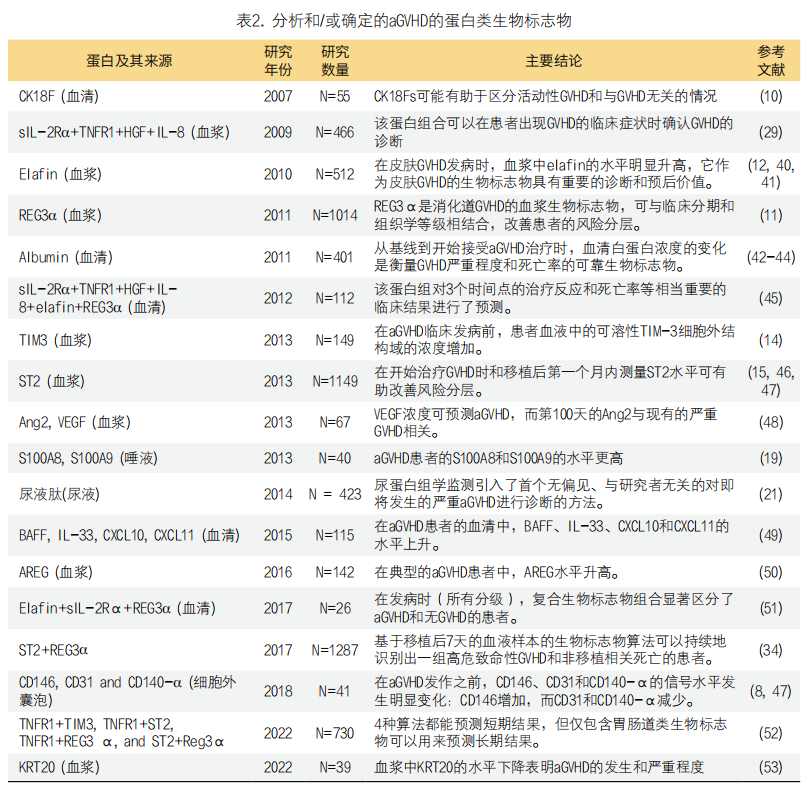
总的来说,临床上应用蛋白类生物标志物诊断aGVHD还是存在一些不足之处。首先,这些生物标志物的变化通常发生在细菌感染或肝窦阻塞综合征引起的炎症过程中,但对蛋白质生物标志物的研究必须排除其他炎症因素的干扰。例如,在患有aGVHD、鼻窦阻塞综合征或败血症的患者中,研究显示可溶性白细胞介素-27受体α(sIL-27α)蛋白水平升高[39],但高水平的sIL-27α是由感染还是由aGVHD引起的尚不清楚。其次,鉴定蛋白类生物标志物的方法更加昂贵、复杂,并且灵敏性较PCR来说更低。更多关于aGVHD蛋白类生物标志物总结在表2中。
2. 核酸类标志物:考虑到蛋白类生物标志物的局限性,研究人员开始关注核酸类生物标志物。Cheng AP等发现循环游离DNA(cell-free DNA,cfDNA)是监测骨髓移植后最重要的并发症如GVHD的高度通用分析物。他们证明,通过疾病特异性生物信息学分析单次cfDNA测序结果,可以了解GVHD的情况[3]。这种检测方法只需要低覆盖率的DNA测序,并且与少量血液兼容。鉴于cfDNA可以更早地检测并更好地预测allo-BMT后出现的一系列复杂并发症,它有潜力改善移植后患者的护理[3]。
除了cfDNA,miRNA也得到了广泛的研究。由于miRNA的高度稳定性、组织特异性、易于测量、低成本和简易性,它们有望作为aGVHD的预测、诊断或预后的生物标志物发挥作用。miRNAs以高度稳定的形式释放到血液和其它体液中,因此可以使用miRNA分析技术(如微阵列或RT-qPCR)进行鉴定[13]。
Xiao B等确定了一组血浆miRNA作为aGVHD的潜在生物标志物,并且为了预测aGVHD的可能性,他们已经开发了一个由4个miRNA(miR-423、miR-199a-3p、miR-93*和miR-377)组成的模型[13]。这些miRNA的水平变化可以在aGVHD被诊断之前进行检测,并且其差异表达与较低的生存率和aGVHD的严重程度呈正相关。Wang Y等从aGVHD患者的血浆中筛选出一系列的miRNAs,发现miR-586的表达在aGVHD发病时下降,在移植后第7天相对较高[54]。后来,Zhao XS等还发现在移植后第7天血浆中高水平的miR-153-3p可以用于预测可能发生的aGVHD[55]。Chen Y等发现与非GVHD患者相比,移植后15天miR-181b和miR-194两者在aGVHD患者中明显上调[56]。此外,Motaei J等报道了miR-455-3p、miR-5787和miR-548a-3p的差异表达也可能作为aGVHD诊断的潜在生物标志物[57]。
由于已知血清样本中miRNA的表达比血浆更高[58],除了研究患者的血浆之外,研究人员还将焦点转向患者的血清。Zhang CY等使用基于RT-qPCR的TaqMan miRNA阵列,在aGVHD患者和非aGVHD对照组的血清池中进行了miRNA分析[59]。基于此,他们开发并验证了一个由三种miRNA(miR-28-5p、miR-489和miR-671-3p)组成的诊断模型,用于治疗aGVHD[59]。随后,几个团队发现患者血清中还有其他miRNA在早期aGVHD期间上调。此外,Atarod S等探索了两种免疫特异性miRNA(miR-146a和miR-155)在患者外周血中作为aGVHD诊断生物标志物的潜力[60]。
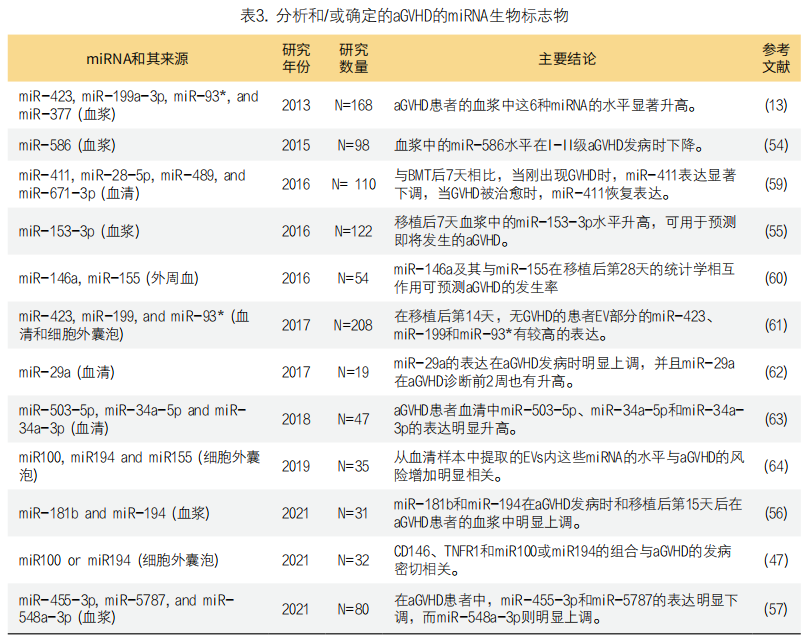
目前尚不清楚aGVHD患者血液中miRNA表达失调的分子机制。因此,需要进一步进行临床检查和功能研究以确定miRNA在aGVHD中的分子机制。表3中总结了aGVHD的miRNA类生物标志物。
3. 细胞外囊泡标志物:由于EVs能够传递多种生物分子,影响受体细胞和供体细胞的多种生理和病理功能,因此被认为是细胞通讯的强大媒介[16]。近年来,EVs及其亚群之一——外泌体(exosomes)已成为生物标志物研究的热门。Crossland RE等致力于通过评估骨髓移植患者血清样本中的miRNA表达,复现Xiao B等所确定的血浆中4种miRNA的诊断潜力[61]。除此之外,他们还对血清EVs中miRNA的表达进行了崭新的研究[61]。
Lia G等使用逻辑回归分析和Cox比例风险模型,确定了与aGVHD发生相关的三个EV表面抗原[8]。三年后,Lia G及其同事进一步研究了EV膜蛋白的表达模式及其miRNA载体(miRNA-100、miRNA-155和miRNA-194)在预测经PT-Cy半相合移植受者发生aGVHD中的作用[47]。此外,他们还试图确定EV表达模式与之前已显示与aGVHD相关的血浆生物标志物(如ST2、TNFR1和Reg3α)之间的潜在相关性[47]。这些研究解释了血浆EVs中表面标志物和miRNA表达的显著动态变化,这很可能是aGVHD发病前的具体事件的基础。因此,EVs与其他血浆生物标志物的组合可以可靠地识别新发aGVHD的患者。上述内容可见图1。
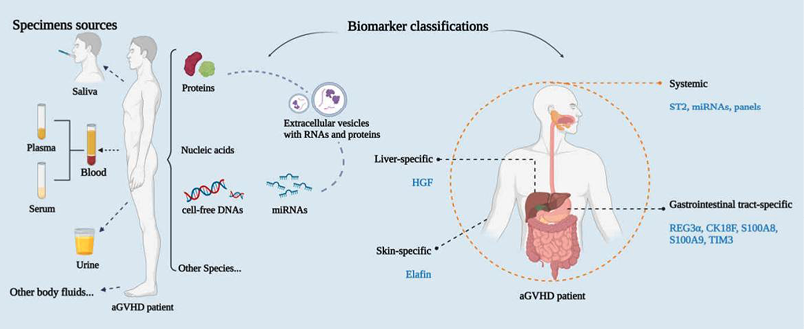
图1. 标本来源的总体概述和aGVHD诊断标志物的分类。这些样本来自各种体液,如血液、尿液和唾液。大多数标志物可以按照其成分分为蛋白质或核酸,而细胞外囊泡则结合了这两种生物分子的优势,并被视为新型标志物。这些标志物还可以分为系统性标志物和器官特异性标志物
4. 其他生物标志物:Wegner J等证明了一组特定的免疫组织化学标记物在区分aGVHD和其差异诊断中起到了辅助作用[65]。然而,该实验中的一些患者进行的是固体器官移植,而不是骨髓移植。因此,结果需要进一步验证。当然,免疫组化作为单一的诊断方法显然不够牢靠,但它可以作为诊断时重要的辅助及补充。此外,像Huang K和Luo J探索了T细胞作为早期预测TDTβ患儿aGVHD生物标志物的潜力[66]。
除上述之外,研究人员还开发了与已知蛋白类生物标志物相关的算法,以便更准确地进行诊断。Hartwell MJ等采集了骨髓移植后第7天的患者血液样本,测量了4种aGVHD生物标志物(ST2、REG3α、TNFR1和IL-2Rα)的水平,并利用严格的交叉验证策略来建立6个月无复发死亡率(NRM)的模型,以确定定义两个明确风险集群的最佳算法,称为西奈山aGVHD国际联盟(MAGIC)算法[34]。这种算法能够一致地识别一组具有致命性GVHD和高风险NRM的患者。另外,Etra A等从19个中心前瞻性地收集了新诊断的aGVHD患者的血清标本,将其分为训练组和验证组,通过ELISA测量了TNFR1、TIM3、IL6、ST2和REG3α的水平,并在验证组中评估了训练组中表现最佳的4个算法(TNFR1+ TIM3、TNFR1+ ST2、TNFR1+REG3α和ST2+REG3α)的表现[52]。这4个算法均能够预测短期结果,其中包含2种胃肠道类生物标志物的算法是4个算法中最准确的。
三、aGVHD展望
在过去的近20年里,众多研究者从不同的角度试图寻找能诊断BMT后发生的aGVHD的高敏感性和特异性的生物标志物。有的并对移植后患者血浆或血清中的蛋白质组成或表达进行了分析,通过使用液相色谱串联质谱法或ELISA测定筛选出一些值得进行多中心临床验证的潜在标志物[15, 34, 49]。另一些研究者采取了不同的方法,放弃血液转而关注患者的唾液或尿液。由于这两种体液相对于血液而言具有一些优势,研究者也取得了一些进展[9, 21]。然而,大多数研究者最终得到的是单一的生物标志物,因此还有一些团队选择将组织特异性和系统性生物标志物结合起来,以获得比单一生物标志物更好的诊断效果[29, 45, 51]。此外,由于仅仅分析特定蛋白质表达远不能满足研究者的好奇心,因此一些研究人员开始研发有关这些蛋白质组的算法,并取得了一些成果[34, 52]。这些算法旨在结合和解释不同蛋白质的表达模式,以提高aGVHD诊断的准确性和可靠性。通过整合来自不同生物标志物的数据,并利用先进的统计方法,如机器学习算法,研究人员已经能够开发出能够有效区分aGVHD和其他疾病,并且能够识别高风险aGVHD患者的预测模型。这些算法不仅增强了诊断能力,也为我们了解aGVHD发展的潜在机制和途径提供了思路和方法。
除了蛋白类生物标志物,核酸分子不可避免地引起了研究人员的关注。移植后患者血液中的cfDNA是从多个来源获得的DNA复杂混合物[67-69]。大量研究已经证明,从固体器官移植受者的血液中提取的cfDNA是固体器官损伤的定量标记物,Cheng AP等提出假设,cfDNA也可能揭示由于BMT后GVHD导致的组织损伤[3, 70, 71]。此外,最近发表的研究表明,循环miRNA可以作为多种不同疾病的非侵入性生物标志物,miRNA是一类小型非编码RNA,通过抑制转录或诱导mRNA降解来负调控基因表达[72, 73]。越来越清楚的是,miRNA以一种高度稳定的形式存在于多种体液中,并受内源性核酸酶的保护[57]。由于其具有成为不同疾病新的非侵入性生物标志物的潜力[74-77],一些研究者通过使用基于RT-qPCR的高通量miRNA阵列比较aGVHD患者或非GVHD患者的血浆miRNA,发现了有价值的结果。
EVs携带蛋白质、核酸、生物活性分子等,其组成根据患者状态和来源细胞的不同而有很大差异[16]。因此,EVs最近成为一类在多种情况下均有前景的生物标志物。基于此,部分研究人员进行了一系列的探索性研究,旨在通过流式细胞术表征EVs表面抗原,并通过RT-qPCR研究EVs中的核酸表达[8, 47, 61]。至于外泌体,这是一类由各种细胞不断分泌的直径在50~150nm之间的细胞外囊泡[79-82],已成为各种疾病的潜在诊断标志物。外泌体在包括尿液在内的多种体液中浓度较高,由于尿液可简便且非侵入性地收集且尿液外泌体内的分子由于外界环境中升高的核酸酶含量和酸性pH条件的保护,不易降解[83]。因此,尿液外泌体及其内含物被认为是液体活检的理想生物标志物。
总的来说,由于现有独立研究者及团队进行研究的标本大部分来源于单中心患者,样本收集存在一些限制,并且不同中心可能有不同的纳入标准。因此,后续的重点应该是进行多中心联合患者样本收集和统一纳入标准,就像迄今为止少数研究人员所做的那样。此外,考虑到异基因造血干细胞移植后患者的体弱情况,尤其是儿童患者,它与收集血液相比,尿液或唾液等体液收集则更加方便和无伤害。目前,随着对外泌体研究的深入进行,研究人员可以努力探索BMT后aGVHD发展过程中外泌体内含物和表面特异性抗原及它们水平的变化或差异表达;或者可以开发针对外泌体内含物的新算法,结合多个差异表达的蛋白或核酸,并在多中心平台上验证这些算法,因为与单一生物标志物相比,系统性和组织特异性生物标志物的组合可能对aGVHD的诊断更具信息价值。总之,尽管在将aGVHD的生物标志物纳入常规临床实践之前还有很多工作要做,但在众多研究人员的不懈努力下,相信在不久的将来,aGVHD诊断标志物的研究一定会有一个较大的飞跃。
参考文献
Zeiser R, Blazar BR. Acute Graft-versus-Host Disease-Biologic Process, Prevention, and Therapy. New Engl J Med. 2017; 377(22): 2167-79.
Aladag E, Kelkitli E, Goker H. Acute Graft-Versus-Host Disease: A Brief Review. Turk J Haematol. 2020; 37(1): 1-4.
Cheng AP, Cheng MP, Loy CJ, et al. Cell-free DNA profiling informs all major complications of hematopoietic cell transplantation. Proc Natl Acad Sci U S A. 2022;119(4).
Vogelsang GB, Lee L, Bensen-Kennedy DM. Pathogenesis and treatment of graft-versus-host disease after bone marrow transplant. Annu Rev Med. 2003; 54: 29-52.
Lee SJ. Classification systems for chronic graft-versus-host disease. Blood. 2017; 129(1): 30-7.
Paczesny S, Hakim FT, Pidala J, Cooke KR, Lathrop J, Griffith LM, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: III. The 2014 Biomarker Working Group Report. Biol Blood Marrow Transplant. 2015; 21(5): 780-92.
Paczesny S. Biomarkers for posttransplantation outcomes. Blood. 2018;131(20):2193-204.
Lia G, Brunello L, Bruno S, Carpanetto A, Omede P, Festuccia M, et al. Extracellular vesicles as potential biomarkers of acute graft-vs-host disease. Leukemia. 2018;32(3):765-73.
Ali AM, DiPersio JF, Schroeder MA. The Role of Biomarkers in the Diagnosis and Risk Stratification of Acute Graft-versus-Host Disease: A Systematic Review. Biology of Blood and Marrow Transplantation. 2016; 22(9): 1552-64.
Luft T, Conzelmann M, Benner A, Rieger M, Hess M, Strohhaecker U, et al. Serum cytokeratin-18 fragments as quantitative markers of epithelial apoptosis in liver and intestinal graft-versus-host disease. Blood. 2007;110(13):4535-42.
Ferrara JLM, Harris AC, Greenson JK, Braun TM, Holler E, Teshima T, et al. Regenerating islet-derived 3-alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. 2011; 118(25):6702-8.
Paczesny S, Braun TM, Levine JE, Hogan J, Crawford J, Coffing B, et al. Elafin is a biomarker of graft-versus-host disease of the skin. Sci Transl Med. 2010; 2(13):13ra2.
Xiao B, Wang Y, Li W, Baker M, Guo J, Corbet K, et al. Plasma microRNA signature as a noninvasive biomarker for acute graft-versus-host disease. Blood. 2013; 122(19): 3365-75.
Hansen JA, Hanash SM, Tabellini L, Baik C, Lawler RL, Grogan BM, et al. A Novel Soluble Form of Tim-3 Associated with Severe Graft-versus-Host Disease. Biology of Blood and Marrow Transplantation. 2013;19(9):1323-30.
Vander Lugt MT, Braun TM, Hanash S, Ritz J, Ho VT, Antin JH, et al. ST2 as a Marker for Risk of Therapy-Resistant Graft-versus-Host Disease and Death. New Engl J Med. 2013;369(6):529-39.
Yanez-Mo M, Siljander PRM, Andreu Z, Zavec AB, Borras FE, Buzas EI, et al. Biological properties of extracellular vesicles and their physiological functions. Journal of extracellular vesicles. 2015;4:27066.
Gould SJ, Raposo G. As we wait: coping with an imperfect nomenclature for extracellular vesicles. J Extracell Vesicles. 2013; 2.
Console L, Scalise M, Indiveri C. Exosomes in inflammation and role as biomarkers. Clin Chim Acta. 2019; 488: 165-71.
Chiusolo P, Giammarco S, Fanali C, Bellesi S, metafuni E, Sica S, et al. Salivary Proteomic Analysis and Acute Graft-versus-Host Disease after Allogeneic Hematopoietic Stem Cell Transplantation. Biology of Blood and Marrow Transplantation. 2013; 19(6): 888-92.
Pisitkun T, Shen RF, Knepper MA. Identification and proteomic profiling of exosomes in human urine. Proc Natl Acad Sci U S A. 2004; 101(36) :13368-73.
Weissinger EM, Metzger J, Dobbelstein C, Wolff D, Schleuning M, Kuzmina Z, et al. Proteomic peptide profiling for preemptive diagnosis of acute graft-versus-host disease after allogeneic stem cell transplantation. Leukemia. 2014; 28(4): 842-52.
Bidgoli A, DePriest BP, Saatloo MV, Jiang H, Fu D, Paczesny S. Current Definitions and Clinical Implications of Biomarkers in Graft-versus-Host Disease. Transplant Cell Ther. 2022.
Bruggen MC, Petzelbauer P, Greinix H, Contassot E, Jankovic D, French L, et al. Epidermal Elafin expression Is an Indicator of Poor Prognosis in Cutaneous Graft-versus-Host Disease. J Invest Dermatol. 2015; 135(4): 999-1006.
Solan L, Carbonell D, Muniz P, Dorado N, Landete E, Chicano-Lavilla M, et al. Elafin as a Predictive Biomarker of Acute Skin Graft-Versus-Host Disease After Haploidentical Stem Cell Transplantation Using Post-Transplant High-Dose Cyclophosphamide. Frontiers in Immunology. 2021; 12:7.
McDonald GB, Tabellini L, Storer BE, Lawler RL, Martin PJ, Hansen JA. Plasma biomarkers of acute GVHD and nonrelapse mortality: predictive value of measurements before GVHD onset and treatment. Blood. 2015; 126(1): 113-20.
Ferrara JL, Harris AC, Greenson JK, Braun TM, Holler E, Teshima T, et al. Regenerating islet-derived 3-alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. 2011; 118(25): 6702-8.
Levine JE, Logan BR, Wu J, Alousi AM, Bolanos-Meade J, Ferrara JL, et al. Acute graft-versus-host disease biomarkers measured during therapy can predict treatment outcomes: a Blood and Marrow Transplant Clinical Trials Network study. Blood. 2012; 119(16): 3854-60.
Harris AC, Ferrara JL, Braun TM, Holler E, Teshima T, Levine JE, et al. Plasma biomarkers of lower gastrointestinal and liver acute GVHD. Blood. 2012; 119(12): 2960-3.
Paczesny S, Krijanovski OI, Braun TM, Choi SW, Clouthier SG, Kuick R, et al. A biomarker panel for acute graft-versus-host disease. Blood. 2009; 113(2): 273-8.
Ponce DM, Hilden P, Mumaw C, Devlin SM, Lubin M, Giralt S, et al. High day 28 ST2 levels predict for acute graft-versus-host disease and transplant-related mortality after cord blood transplantation. Blood. 2015; 125(1): 199-205.
Kanakry CG, Bakoyannis G, Perkins SM, McCurdy SR, Vulic A, Warren EH, et al. Plasma-derived proteomic biomarkers in human leukocyte antigen-haploidentical or human leukocyte antigen-matched bone marrow transplantation using post-transplantation cyclophosphamide. Haematologica. 2017; 102(5): 932-40.
Abu Zaid M, Wu J, Wu C, Logan BR, Yu J, Cutler C, et al. Plasma biomarkers of risk for death in a multicenter phase 3 trial with uniform transplant characteristics post-allogeneic HCT. Blood. 2017; 129(2): 162-70.
Nelson RP, Jr., Khawaja MR, Perkins SM, Elmore L, Mumaw CL, Orschell C, et al. Prognostic biomarkers for acute graft-versus-host disease risk after cyclophosphamide-fludarabine nonmyeloablative allotransplantation. Biol Blood Marrow Transplant. 2014; 20(11): 1861-4.
Hartwell MJ, Ozbek U, Holler E, Renteria AS, Major-Monfried H, Reddy P, et al. An early-biomarker algorithm predicts lethal graft-versus-host disease and survival. JCI Insight. 2017; 2(3): e89798.
Amerongen AV, Veerman EC. Saliva--the defender of the oral cavity. Oral Dis. 2002; 8(1): 12-22.
Weissinger EM, Schiffer E, Hertenstein B, Ferrara JL, Holler E, Stadler M, et al. Proteomic patterns predict acute graft-versus-host disease after allogeneic hematopoietic stem cell transplantation. Blood. 2007; 109(12): 5511-9.
Weissinger EM, Human C, Metzger J, Hambach L, Wolf D, Greinix HT, et al. The proteome pattern cGvHD_MS14 allows early and accurate prediction of chronic GvHD after allogeneic stem cell transplantation. Leukemia. 2017; 31(3): 654-62.
Rodriguez-Otero P, Porcher R, Peffault de Latour R, Contreras M, Bouhnik Y, Xhaard A, et al. Fecal calprotectin and alpha-1 antitrypsin predict severity and response to corticosteroids in gastrointestinal graft-versus-host disease. Blood. 2012; 119(24): 5909-17.
Motaei J, Yaghmaie M, Ahmadvand M, Pashaiefar H, Kerachian MA. MicroRNAs as Potential Diagnostic, Prognostic, and Predictive Biomarkers for Acute Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2019; 25(12): e375-e86.
Zewde MG, Morales G, Gandhi I, Ozbek U, Aguayo-Hiraldo P, Ayuk F, et al. evaluation of Elafin as a Prognostic Biomarker in Acute Graft-versus-Host Disease. Transplant Cell Ther. 2021; 27(12): 988 e1- e7.
George L, Mahabal G, Mohanan E, Balasubramanian P, Peter D, Pulimood S, et al. Limited utility of plasma elafin as a biomarker for skin graft-versus-host disease following allogeneic stem cell transplantation. Clin Exp Dermatol. 2021; 46(8): 1482-7.
Takahashi N, Mochizuki K, Sano H, Kobayashi S, Ohara Y, Ikeda K, et al. Decline of serum albumin precedes severe acute GVHD after haploidentical HSCT. Pediatr Int. 2021; 63(9): 1048-54.
Rezvani AR, Storer BE, Storb RF, Mielcarek M, Maloney DG, Sandmaier BM, et al. Decreased Serum Albumin as a Biomarker for Severe Acute Graft-versus-Host Disease after Reduced-Intensity Allogeneic Hematopoietic Cell Transplantation. Biology of Blood and Marrow Transplantation. 2011; 17(11): 1594-601.
Ayuk F, Bussmann L, Zabelina T, Veit R, Alchalby H, Wolschke C, et al. Serum albumin level predicts survival of patients with gastrointestinal acute graft-versus-host disease after allogeneic stem cell transplantation. Annals of Hematology. 2014; 93(5): 855-61.
Levine JE, Logan BR, Wu J, Alousi AM, Bolanos-Meade J, Ferrara JLM, et al. Acute graft-versus-host disease biomarkers measured during therapy can predict treatment outcomes: a Blood and Marrow Transplant Clinical Trials Network study. Blood. 2012; 119(16): 3854-60.
Aladag Karakulak E, DemIroglu H, Malkan UY, Akman U, Goker H, Buyukasik Y. Assessment of ST2 and Reg3a levels in patients with acute graft-versus-host disease after allogeneic hematopoietic stem cell transplantation. Turk J Med Sci. 2021; 51(1): 355-8.
Lia G, Di Vito C, Bruno S, Tapparo M, Brunello L, Santoro A, et al. Extracellular Vesicles as Biomarkers of Acute Graft-vs.-Host Disease After Haploidentical Stem Cell Transplantation and Post-Transplant Cyclophosphamide. Front Immunol. 2021; 12: 816231.
Porkholm M, Bono P, Saarinen-Pihkala UM, Kivivuori SM. Higher angiopoietin-2 and VEGF levels predict shorter EFS and increased non-relapse mortality after pediatric hematopoietic SCT. Bone Marrow Transplantation. 2013; 48(1): 50-5.
Ahmed SS, Wang XN, Norden J, Pearce K, El-Gezawy E, Atarod S, et al. Identification and validation of biomarkers associated with acute and chronic graft versus host disease. Bone Marrow Transplant. 2015; 50(12): 1563-71.
Holtan SG, Khera N, Levine JE, Chai XY, Storer B, Liu HD, et al. Late acute graft-versus-host disease: a prospective analysis of clinical outcomes and circulating angiogenic factors. Blood. 2016; 128(19): 2350-8.
Min SS, Mehra V, Clay J, Cross GF, Douiri A, Dew T, et al. Composite biomarker panel for prediction of severity and diagnosis of acute GVHD with T-cell-depleted allogeneic stem cell transplants-single centre pilot study. J Clin Pathol. 2017; 70(10): 886-90.
Etra A, Gergoudis S, Morales G, Spyrou N, Shah J, Kowalyk S, et al. Assessment of systemic and gastrointestinal tissue damage biomarkers for GVHD risk stratification. Blood Adv. 2022; 6(12): 3707-15.
Lupsa N, Szegedi A, Gezsi A, Vuncs Z, Masszi T, Mikala G, et al. Decreased Plasma Level of Cytokeratin 20 (KRT20) Is Indicative of the Emergence and Severity of Acute GvHD Irrespective to the Type of Organ Involvement. Biomedicines. 2022; 10(3).
Wang Y, Zhao X, Ye X, Luo H, Zhao T, Diao Y, et al. Plasma microRNA-586 is a new biomarker for acute graft-versus-host disease. Ann Hematol. 2015; 94(9): 1505-14.
Zhao XS, Wang YN, Meng-Lv, Yuan-Kong, Luo HX, Ye XY, et al. miR-153-3p, a new bio-target, is involved in the pathogenesis of acute graft-versus-host disease via inhibition of indoleamine-2,3-dioxygenase. Oncotarget. 2016; 7(30): 48321-34.
Chen Y, Deng HL, Kang DL, Wang Y, Hong XL, Lu QY. [Plasma MiR-181b and MiR-194 As Biomarkers for Acute Graft- Versus-Host Disease and Significance of Their Changes]. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2021; 29(3): 957-62.
Motaei J, Kerachian MA, Mousavi SA, Alimoghadam K, Ghavamzadeh A, Manoochehrabadi S, et al. Circulating miR-455-3p, miR-5787, and miR-548a-3p as potential noninvasive biomarkers in the diagnosis of acute graft-versus-host disease: a validation study. Ann Hematol. 2021; 100(10): 2621-31.
Wang K, Yuan Y, Cho JH, McClarty S, Baxter D, Galas DJ. Comparing the MicroRNA Spectrum between Serum and Plasma. Plos One. 2012; 7(7): 9.
Zhang C, Bai N, Huang W, Zhang P, Luo Y, Men S, et al. The predictive value of selected serum microRNAs for acute GVHD by TaqMan MicroRNA arrays. Ann Hematol. 2016; 95(11): 1833-43.
Atarod S, Ahmed MM, Lendrem C, Pearce KF, Cope W, Norden J, et al. mir-146a and mir-155 expression levels in acute graft-Versus-host Disease incidence. Frontiers in Immunology. 2016; 7.
Crossland RE, Norden J, Kralj Juric M, Pearce KF, Lendrem C, Bibby LA, et al. Serum and Extracellular Vesicle MicroRNAs miR-423, miR-199, and miR-93* As Biomarkers for Acute Graft-versus-Host Disease. Front Immunol. 2017; 8: 1446.
Ranganathan P, Ngankeu A, Zitzer NC, Leoncini P, Yu X, Casadei L, et al. Serum miR-29a Is Upregulated in Acute Graft-versus-Host Disease and Activates Dendritic Cells through TLR Binding. J Immunol. 2017; 198(6): 2500-12.
Atarod S, Norden J, Bibby LA, Janin A, Ratajczak P, Lendrem C, et al. Differential MicroRNA expression Levels in Cutaneous Acute Graft-Versus-Host Disease. Front Immunol. 2018; 9: 1485.
Brunello L, Lia G, Bruno S, Tapparo M, Omede P, Festuccia M, et al. Biomarkers of Acute Graft-Versus-Host Disease: Surface Antigens and Micro Rnas in Extracellular Vesicles. Biology of Blood and Marrow Transplantation. 2019; 25(3).
Wegner J, Weidenthaler-Barth B, Engelbert J, Knothe M, Braun C, Helbig D, et al. Immunohistochemical markers for histopathological diagnosis and differentiation of acute cutaneous graft-versus-host disease. Exp Dermatol. 2021; 30(12): 1814-9.
Huang K, Luo J. Activated CD4 + T lymphocyte is a potential biomarker for acute graft-vs.-host disease after hematopoietic stem cell transplantation in children with transfusion-dependent beta-thalassemia. Front Pediatr. 2022; 10:985306.
Camargo JF, Ahmed AA, Lindner MS, Morris MI, Anjan S, Anderson AD, et al. Next-generation sequencing of microbial cell-free DNA for rapid noninvasive diagnosis of infectious diseases in immunocompromised hosts. F1000Res. 2019; 8: 1194.
Sharon E, Shi H, Kharbanda S, Koh W, Martin LR, Khush KK, et al. Quantification of transplant-derived circulating cell-free DNA in absence of a donor genotype. PLoS Comput Biol. 2017; 13(8): e1005629.
Buedts L, Vandenberghe P. Circulating cell-free DNA in hematological malignancies. Haematologica. 2016; 101(9): 997-9.
De Vlaminck I, Valantine HA, Snyder TM, Strehl C, Cohen G, Luikart H, et al. Circulating Cell-Free DNA Enables Noninvasive Diagnosis of Heart Transplant Rejection. Science Translational Medicine. 2014; 6(241): 241ra77-ra77.
De Vlaminck I, Martin L, Kertesz M, Patel K, Kowarsky M, Strehl C, et al. Noninvasive monitoring of infection and rejection after lung transplantation. Proc Natl Acad Sci U S A. 2015; 112(43): 13336-41.
Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell. 2009; 136(2): 215-33.
Qu Y, Zhang YP, Wu J, Jie LG, Deng JX, Zhao DB, et al. Downregulated microRNA-135a ameliorates rheumatoid arthritis by inactivation of the phosphatidylinositol 3-kinase/AKT signaling pathway via phosphatidylinositol 3-kinase regulatory subunit 2. J Cell Physiol. 2019; 234(10): 17663-76.
Kuwabara Y, Ono K, Horie T, Nishi H, Nagao K, Kinoshita M, et al. Increased microRNA-1 and microRNA-133a levels in serum of patients with cardiovascular disease indicate myocardial damage. Circ Cardiovasc Genet. 2011; 4(4): 446-54.
Montgomery RL, Hullinger TG, Semus HM, Dickinson BA, Seto AG, Lynch JM, et al. Therapeutic inhibition of miR-208a improves cardiac function and survival during heart failure. Circulation. 2011; 124(14): 1537-47.
Starkey Lewis PJ, Dear J, Platt V, Simpson KJ, Craig DG, Antoine DJ, et al. Circulating microRNAs as potential markers of human drug-induced liver injury. Hepatology. 2011; 54(5): 1767-76.
Mas VR, Dumur CI, Scian MJ, Gehrau RC, Maluf DG. MicroRNAs as Biomarkers in Solid Organ Transplantation. Am J Transplant. 2013; 13(1): 11-9.
Cho S, Yang HC, Rhee WJ. Development and comparative analysis of human urine exosome isolation strategies. Process Biochemistry. 2020; 88: 197-203.
Alagundagi DBB, Ghate SDD, Rajendra VKJ, Gollapalli P, Shetty VVV, D'Souza C, et al. Exploring breast cancer exosomes for novel biomarkers of potential diagnostic and prognostic importance. 3 Biotech. 2023; 13(1).
Chowdhury SG, Ray R, Karmakar P. Exosomal miRNAs-a diagnostic biomarker acting as a guiding light in the diagnosis of prostate cancer. Functional & Integrative Genomics. 2023; 23(1).
Shi Y, Wang R, Wang L, Liu Q, Han L, Duan X, et al. Exosomes as biomarkers and therapeutic measures for ischemic stroke. European journal of pharmacology. 2023; 939: 175477-.
Zheng L, Sun DF, Tong Y. Exosomal miR-202 derived from leukorrhea as a potential biomarker for endometriosis. The Journal of international medical research. 2023; 51(1): 3000605221147183-.
Wachalska M, Koppers-Lalic D, van Eijndhoven M, Pegtel M, Geldof AA, Lipinska AD, et al. Protein Complexes in Urine Interfere with Extracellular Vesicle Biomarker Studies. J Circ Biomark. 2016, 5:4.




