自身抗体检测技术方法学的不同特点

程松,西南医科大学附属医院医学硕士,副主任技师。参与国家863课题研究(2006AA02090407),题为《精神分裂症血清蛋白指纹图人工神经网络实验诊断模型研究》。先后参与发表精神分裂症相关诊断文章5篇,其中以第一作者发表核心期刊2篇。

万红,西南医科大学附属医院检验科主管技师,主要研究方向自身抗体谱在肿瘤中的应用。
自身免疫病(autoimmunity disease,AID)是由于免疫功能紊乱,机体产生针对自身抗原的病理性免疫应答反应而引起器官或系统损伤的一类疾病[1]。全球自身免疫性疾病的患病率为5%~20%。在过去的30年中,发病率和患病率显著增加。目前已知的AID有100多种,累及多器官、多系统。AID总体发病率占世界人口的5%,被世界卫生组织列为继心脑血管疾病、癌症后威胁人类健康的第三大杀手[2]。自身抗体检测对AID的预测、诊断和治疗至关重要。

自身抗体的产生是自身免疫病的基本特征之一,因而,自身抗体本身就成为大多数自身免疫病的血清学标记物。早期诊断对管理自身免疫疾病来说非常重要。在早期阶段发现自身免疫疾病可避免或延迟标的器官或组织发生无法补救的损伤。
自身抗体实验室检测技术方法
对于自身抗体的检测,特别是常规检测项目—抗核抗体(ANA)的检测,IIF一直都是检测方法的“金标准”。而对于特异性自身抗体检测,目前市场上不断有新的方法学出现,从经典的免疫印迹法、酶联免疫法(ELISA)、到化学发光法(CLIA)、流式荧光法和磁条码免疫荧光法[4]。本文将进行系统的介绍,旨在为临床实验室进行正确选择提供参考。
1. 间接免疫荧光法:间接免疫荧光技术(IIF)因其独具的技术优势成为自身抗体检测的“金标准”,是国内外公认的自身抗体筛查首选方法[3]。该方法以细胞或组织为检测基质,保留了抗原谱的完整性,保证了自身抗体筛查的敏感性。该技术将细胞中含量较低的靶抗原以其天然构象大量表达在细胞表面,极大提高了特异性抗体检测的灵敏度和特异性。但该方法操作相对复杂,需要利用荧光显微镜主观判断结果,对工作人员操作要求高,受人为主观判断影响较大,容易出现交叉反应,假阳性高。此类方法一般的检验结果一般是定性或半定量,涉及项目较少,一般是总抗核抗体。
随着IIF技术的广泛应用,临床实验室对自动化要求日益迫切,目前市场上已经推出了从加样到判读的全自动化检测平台,大大提升了实验室的工作效率并提高了检测结果判读的标准化。
《抗核抗体检测的临床应用专家共识2018版》[4]中指出,IIF可适用于ANA的初筛,若结果阳性,后续需进一步进行ANA针对靶抗原的特异性抗体检测。
2. 免疫印迹法:免疫印迹法作为多指标联检的特异性抗体确认技术,自90年代初进入中国以来,现已普遍应用于自身抗体检测。该技术是将各种特异性抗原呈条带状包被于理化性质相匹配的不同材质的膜基质上,各种抗原包被带之间间隔一定的距离,由此保证了检测结果的高灵敏高特异性,并完全避免各种抗原间的结果干扰[5]。
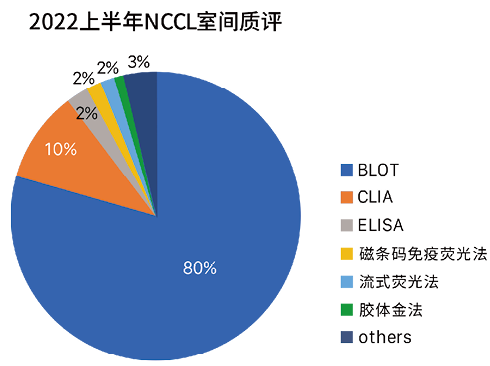
根据2022年国家卫生健康委临床检验中心(NCCL)室间质评上报的1752家实验室数据统计,ENA靶抗原检测的方法学中,使用免疫印迹法的实验室占比80%,是目前自免领域份额占比最大的方法学,可以看出免疫印迹法使用率很高,备受临床实验室的认可,是自身抗体检测的主流方法学[6,7]。
免疫印迹法备受青睐,究其原因主要是操作简单、性能优异,多指标联检符合临床特异性抗体筛查和确认的需求,经济高效,得到实验室老师的认可,稳居自身抗体靶抗原确认检测方法中的主导地位。但免疫印迹法存在检测手工操作、通量较小、步骤繁多、耗时较长、检测项目固定无法灵活组合等痛点。免疫印迹法作为定性或半定量方法与IIF同样更适用于自身免疫疾病的初筛。
3.酶联免疫法:酶联免疫吸附剂测定法,简称酶联免疫法,或者ELISA法。它的中心就是让抗体与酶复合物结合,然后通过显色来检测。使抗原或抗体结合到某种固相载体表面,并保持其免疫活性[8]。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应[9,10]。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。
酶联免疫法也是非常经典的方法,其检验结果可以是定性、半定量和定量。同时,ELISA的缺点也很明显,重复性不好;受自身抗体、嗜异性抗体等干扰,易出现假阳性;不论仪器和手工操作,干扰因素较多。在疾病进展的正确时间采用ELISA检测用于抗体检测,可以让临床医生更全面地了解患者病情进展等情况。
4.流式荧光法:流式荧光法基于荧光编码微球和流式技术,主要应用于蛋白和核酸检测领域,近几年被用于自身抗体检测领域,属于多指标联检技术。该技术是以不同荧光编码微球标记各类靶抗原的液相反应体系,通过流式检测仪测定各类靶抗原对应的二抗荧光强度,以此来检测样本中的自身抗体[11]。虽然流式荧光检测可提供数值化结果,但这些指标的数值结果并不能准确代表样本中抗体水平的高低[12]。
流式荧光技术具有全自动化、多指标联检、随机进样等优势,但该技术在自身抗体检测领域的应用时间较短,产品性能未被临床长期验证,并且检测技术还有待改进之处。如,该技术受嗜异性抗体干扰比较突出,有研究报道[13]超过80%的人血清中含有异嗜性抗体,至少一半人的血清可以产生这种非特异性结合。Waterboer T团队发现[14],在流式荧光检测中,至少59%的非洲人血清中的嗜异性抗体可以和微球产生非特异性结合,导致检测的背景信号过高干扰检测结果。
其次,流式荧光的检测结果易受温度影响,从而降低了检测结果的准确性。有研究对涵盖高、中、低浓度的临床样本进行分析,与定标温度25℃偏差±5℃时,测值出现显著的负偏倚,从而导致阳性样本可能出现阴性结果,高滴度样本出现低滴度结果[15],在流式荧光的日常检测中,实验室必须注意严格控制仪器和环境的温度。如果温度升高或降低都会影响检测性能。
5. 化学发光法:化学发光法(CLIA)是一种将高特异性的免疫反应和高灵敏度的化学发光测定技术相结合的检测技术。该技术根据化学反应产生的辐射光强度来确定物质含量,用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测[16]。CLIA具有反应速度快、检测灵敏度高、线性范围宽、精密度高,可随到随检等优势。
对于化学发光在自身抗体检测方面的应用,已经有很多研究。如对于系统性红斑狼疮患者的ANA检测,CLIA的检测灵敏度、特异性、阴阳性预测值都高于流式荧光(见表1),且CLIA与金标准IIF的阳性和阴性符合率均高于流式荧光法,CLIA与免疫印迹法的阳性和阴性符合率也均高于流式荧光法(见表2)[17]。
表1. ANA检测方法对SLE的诊断价值
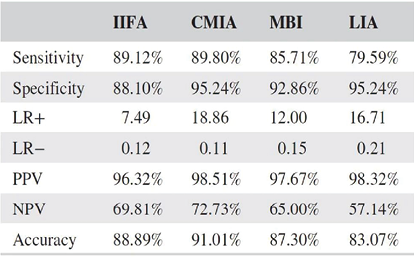
表2. 不同方法学检测ANA的一致性分析
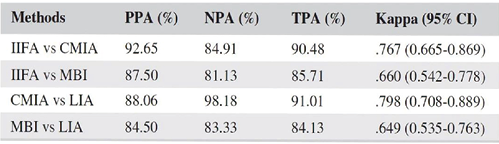
注:IIFA(间接免疫荧光法)、CMIA(化学发光法)、MBI(流式荧光法)、LIA(免疫印迹法)
2020年《自身免疫病抗体检测方法的推荐意见》推荐CLIA用于多种自身抗体的检测[10]。因CLIA为单指标检测,可根据疾病临床诊断路径对相应的指标进行单独或组合检测,不必每次进行全套自身抗体谱检测,可以降低医保及患者负担,符合DRG/DIP政策的实施。
根据国家风湿病数据中心(CRDC)室间质评数据统计,从2015年到2020年的5年间,使用CLIA检测的实验室不但从无到有,且数量占比大幅上升,如dsDNA和MPO/PR3抗体检测,2020年采用CLIA的实验室占比分别达到14.7%和22.4%。可见CLIA在自身抗体检测领域占有率越来越高。
CLIA作为单指标定量检测,极有可能会成为未来检测自身抗体的趋势。且CLIA技术可以用于自身免疫性疾病初筛及病情监控,全定量数值结果更有助于临床医生判断疾病进程,疾病分型等工作开展。
6.磁条码免疫荧光法:磁条码免疫荧光技术近两年开始用于自身抗体检测领域,也是一种液相多指标联检方法。该技术特点主要为通过各种光刻标记的芯片偶联不同抗原,免疫反应结束后,通过明场拍照识别各类靶抗原位置、暗场拍照测定各类靶抗原对应的二抗荧光强度,以此来检测样本中所含的自身抗体[18]。
磁条码免疫荧光检测技术具有全自动化、随机进样等优势,但在自身抗体检测领域起步较晚,技术还不够成熟。首先,在反应信号检测时,同一反应孔中各芯片之间的荧光信号有可能互相干扰,从而影响检测结果的准确性[19]。其次,芯片的尺寸过大,在反应体系中不能稳定分散,导致抗原抗体的不能充分结合[20]。
因此,在自身抗体检测方面,磁条码荧光技术属于刚起步,还需进行持续的技术完善,并经过长期的临床验证后,才能真正成为符合临床检测要求的方法学。
各种方法优缺点比较如下表。
上述各方法学的性能差异也体现在室间质评的结果上。如2021-2022 NCCL质评验证结果显示,磁条码免疫荧光法和流式荧光法检测的质评通过率较低,特别是对于RNP和Sm指标的质评结果,这两种方法的假阴性率高达35%和72%;而使用免疫印迹试剂检测的实验室数量多达800+家,质评通过率高;化学发光试剂用户不多但通过率很高。
随着时代的发展,医学技术的不断创新与进步,未来将会有越来越多的方法学应用于自身抗体检测领域,可谓百家争鸣。各种方法学有其各自的优势与短板,正可谓一枝独秀不是春,百花齐放春满园。
自身抗体检测技术的蓬勃发展,为用户带来了更多的选择空间,满足了更多的应用场景。用户只需从使用的需求出发,对方法学进行全面的评估,就能找到最适合自己实验室的检测技术。
参考文献:
Baghdadi H,Abdel-Aziz N, Ahmed NS, et al. Ameliorating role exerted by al-hijamah in autoimmune diseases: effect on serum autoantibodies and inflammatory mediators [J].Int J Health Sci (Qassim), 2015, 9(2): 207-232.
詹皓婷,李永哲. 自身免疫病实验室诊断指标与技术的临床应用现状及进展[J]. 临床检验杂志, 2021, 39(10): 725-731.
王志勇,阮杰,梁一等. 间接免疫荧光技术在免疫检验实验教学中的应用[J]. 科教导刊(中旬刊), 2017(17): 139-140.
中国医师协会风湿免疫科医师分会自身抗体检测专业委员会. 抗核抗体检测的临床应用专家共识[J]. 中华检验医学杂志, 2018, 41(4): 275-280.
张燕婉, 叶珏, 时那等. 蛋白质免疫印迹技术的实验研究[J]. 实验技术与管理, 2008(10): 35-37.
蒋跃根, 应葳, 王峰来等. 免疫印迹法检测抗核抗体谱比对分析[J]. 国际检验医学杂志, 2014, 35(01): 39-41.
高泽斌, 马悦, 李晓兰. 化学发光法和免疫印迹法检测糖尿病自身抗体的结果分析[J]. 放射免疫学杂志, 2011, 24(04): 453-454.
张宇, 陈玲, 熊中云等.免疫印迹法、酶联免疫法及放射免疫法对胰岛自身抗体检测的比较[J]. 华西医学, 2009, 24(03): 697-699.
Senant M, Musset L, Chyderiotis G, et al. Precision of autoantibody assays in clinical diagnostic laboratories: What is the reality?[J]. Clin Biochem, 2020, 83: 57-64.
中国免疫学会临床免疫分会专家组. 自身免疫病诊断中抗体检测方法的推荐意见[J]. 中华检验医学杂志, 2020, 43(09): 878-888.
王战, 王麟, 姚远等. 流式荧光免疫法检测原发性胆汁性胆管炎自身抗体的价值与临床应用[J]. 临床肝胆病杂志, 2021, 37(10): 2384-2388.
尚晓莹, 于腾, 孙桂荣等. 多重微球流式荧光免疫技术检测抗核抗体谱的评价与临床应用[J]. 中国免疫学杂志, 2019, 35(03):331-334.
[13] Wei Q, Jiang Y, Xiao M, Zhang X, Qi J, Xie J, Wu J, Wu Z, Gu J. Comparison of chemiluminescence microparticle immunoassay, indirect immunofluorescence assay, linear immunoassay and multiple microbead immunoassay detecting autoantibodies in systemic lupus erythematosus. Scand J Immunol. 2020 Mar;91(3):e12849.
Waterboer T, Sehr P, Pawlita M. Suppression of non-specific binding in serological Luminex assays. J Immunol Methods. 2006 Feb 20; 309(1-2): 200-4.
贺雯, 邹雅如, 鲁琼等. 环境温度对Luminex流式荧光免疫分析法测定糖类抗原242结果的影响[J]. 第二军医大学学报, 2019, 40(07): 759-762.
荀春华, 江代红, 瞿俊. 磁微粒化学发光法检测抗RA-33、抗CCP抗体及类风湿因子的临床应用评估[J]. 中国免疫学杂志, 2023, 39(11): 2393-2396.
罗宇维, 全树绿, 张明娇. 纳米磁微粒化学发光法定量检测抗核抗体谱的临床应用[J]. 海南医学, 2018, 29(11): 1527-1530.
Qin Y, et al. Analytical and clinical performance of different platforms simultaneously detecting 15 antinuclear antibodies. J Clin Lab Anal. 2022 Jul; 36(7): e24554.
Dillaerts D, De Baere H, Bossuyt X. Clinical autoantibody detection by microarray. Clin Chem Lab Med. 2017; 55(4): 578-585.
Fritzler MJ, Fritzler ML. The emergence of multiplexed technologies as diagnostic platforms in systemic autoimmune diseases. Curr Med Chem. 2006; 13(21): 2503-2512.




