肝素诱导血小板减少症管理意见与建议
【摘要】疑似肝素诱导血小板减少症(HIT)患者的特征:(1)肝素应用后(一般5-14天)不明原因血小板计数下降幅度>30%;(2)伴或不伴新发血栓。疑似HIT的处理要点:进行4T评分表评估HIT风险,并送检HIT-Ab(2小时出结果);根据临床体征和实验室检查综合判断,并决定治疗策略。诊断标准:(同时满足以下3条标准):(1)肝素持续使用或近期有应用史;(2)血小板计数下降≥30%,伴或不伴新发血栓;(3)HIT-Ab≥4.0U/ml;(如1.0-3.9U/ml,则为可疑HIT,建议3天后复查)。单纯依据临床症状或实验室检查均不能诊断HIT。治疗原则 (1)立即停止接触所有肝素类制剂(包括导管抗凝和留置针封管)。(2)启用替代非肝素抗凝(一般抗凝治疗首选阿加曲班,介入或外科手术首选比伐卢定)。严重肝肾功能损伤时,应关注选药类型和剂量,避免出血事件。
避免漏诊或过度诊断肝素诱导血小板减少症(Heparin-induced thrombocytopenia,HIT),减少不必要的治疗策略变更,降低因漏诊HIT患者出现致残、致死、出血等不良事件的发生率。
肝素诱导性血小板减少症(Heparin-induced thrombocytopenia,HIT)是一种灾难性肝素副作用,由IgG抗体介导血小板活化导致机体呈现血小板计数下降和高血栓形成倾向的一过性的疾病[1]。其中66.1%的HIT患者出现灾难性血栓并发症,致死率高达38%[2, 3],出血少见。早期诊断和积极治疗是降低致残、致死不良事件发生的核心[4, 5]。
HIT致病机制为肝素在体内与血小板4因子结合形成血小板4因子-肝素(PF4-H)复合物。通过PF4-H复合物暴露新的抗原决定簇导致产生PF4-H抗体(致病性抗体常为IgG型)。在血小板FcγIIa受体的介导下,触发血小板微粒生成,促使血小板活化,并释放促凝物质,导致大量凝血酶生成,体内呈高凝,处于血栓形成高风险状态。
最近研究报道的HIT发病率约0.1%-5.0%[6],应用普通肝素的患者高于低分子肝素暴露者;外科手术患者多于内科治疗;心脏外科手术使用普通肝素剂量大,HIT患者绝对数量最大[4]。高度风险人群(HIT发病率>1.0%):外科手术(心脏和骨科)或外伤术后普通肝素(UFH)。
第一部分 肝素诱导性血小板减少症诊断
一、HIT的诊断
1. 什么病人需要怀疑HIT?(1)主要特征:临床有肝素应用史;肝素应用3天后血小板计数(PLT)出现持续下降,降幅≥30%;无明确PLT降低原因。(2)次要特征:无明显诱因出现新发血栓;不明原因D-二聚体(D-dimer)、凝血酶-抗凝血酶复;(3)使用肝素患者PLT监测频率:使用肝素前、使用肝素后每(2-3)天一次,持续2周;如临床评估HIT风险低,可减少监测频率。
2. 出现疑似HIT后,该怎么办?疑似HIT的处理流程见图1:
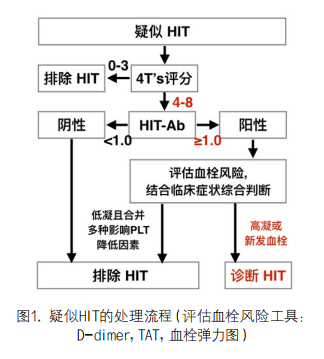
二、如何应用4T评分表的应用与解读结果?
1. 进行4T评分(表1)(新OA-检验专区下载评估表)。评估(0-3)分为HIT低风险;(4-5)分为HIT中度风险;(6-8)分为HIT高风险。
2. 评估<4分,一般不考虑HIT。
3. 4T评估≥4分,立即送检HIT-Ab检测(检测时间约1h)。
4. 4T评估≥6分,立即停止普通肝素,根据HIT-Ab结果决定是否继续使用肝素。HIT-Ab阴性,可继续使用肝素。
注:4T应动态进行,一次评估HIT低风险不代表持续无HIT。4T’s评估缺项或不准确可能导致总评分过高[7]。有研究显示无需4T’s评估直接进行实验室HIT-Ab筛查(尤其是ICU患者)[8]。
疑似HIT和4T中度风险且没有其他需要治疗抗凝强度患者可中断肝素应用;疑似HIT和4T中度风险,如果患者无出血高风险因素时,启动治疗剂量的非肝素抗凝;如果患者有出血高危因素,启动预防剂量的非肝素抗凝。疑似HIT和4T高风险,停肝素和使用替代抗凝剂。疑似HIT,4T中危,免疫学筛查阴性:中断非肝素抗凝,并恢复肝素使用。疑似HIT、4T高危、免疫学阴性,中断非肝素抗凝,并恢复肝素抗凝。如临床仍怀疑HIT,可重新评估并重新免疫学检测(更换方法学)。疑似HIT、4T中危、免疫学阳性,建议避免继续使用肝素和启动治疗剂量的非肝素抗凝治疗。
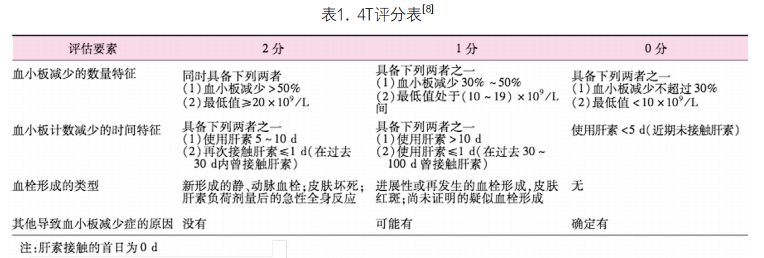
三、如何送检并解读 HIT-Ab结果?
本院HIT-Ab检测为HemosIL® HIT-Ab(PF4-H),抗体为IgG/IgM/IgA的混合抗体。该法又称“功能性筛查试验”。与HIT确诊试验“SRA”检测相关性好。
1. HIT-Ab结果(0.0-0.9)U/ml时,临床HIT可能性低,建议暂不考虑 HIT。查找其他血小板计数下降原因。
2. HIT-Ab结果(1.0-1.9)U/ml时,临床HIT轻度可疑。如临床出现新发血栓或D-dimer/TAT持续增高,需立即停用肝素,并启用替代抗凝剂(阿加曲班)。如无新发血栓,可停用普通肝素。每天检测D-dimer和TAT,3天后复查HIT-Ab,如结果持续增高并有血栓,诊断HIT,启动替代抗凝治疗。如无变化或下降,则按原治疗方案进行。
3. HIT-Ab结果(2.0-3.9)U/ml时,临床HIT中度可疑。立即停止接触所有肝素。评估患者体内凝血状态(检测:血栓弹力图-高岭土、D-dimer、TAT),根据评估结果决定抗凝方案。三天后复查HIT-Ab。
4. HIT-Ab结果(≥4.0)U/ml时,诊断HIT。立即停用接触肝素并启用替代抗凝治疗。评估体内凝血状态(血栓弹力图-高岭土、D-dimer、TAT)和是否存在新发血栓(颈部、四肢超声、必要时肺部、腹部和头部CT)。根据体内凝血状态决定抗凝强度。
四、HIT的诊断标准?
满足以下3个标准[9]:
1. 肝素持续使用或近期有应用史。
2. 血小板计数下降≥30%,伴或不伴新发血栓。
3. HIT-Ab≥4.0U/ml;(如结果在1.0-3.9U/ml判断可疑HIT,建议3天后复查)[8 ,10]。
注:单纯依据临床症状或实验室检查均不能诊断HIT。
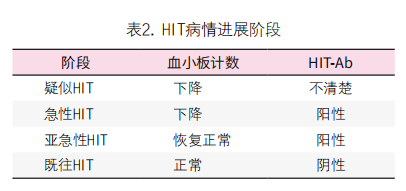
五、如何判断 HIT病情进展情况?
依据实验室检查将HIT病程分成4个阶段(表2)[11]
六、无症状的独立HIT是否需要筛查血栓风险?
建议采用超声扫描四肢、中心静脉导管排除深静脉血栓。
七、血小板计数减少原因的鉴别诊断
1. 心血管疾病患者常见导致血小板计数下降原因:HIT临床表现血小板计数减少无特异性,本院患者可导致血小板减少的原因很多。例如替罗非班诱导的血小板减少,抗生素(例如舒普深等)导致血小板减少,有创操作(如CPB、IABP、ECMO、血液透析或超滤肾替代治疗等),严重的感染(如脓毒血症),以及外科手术出现应激性血小板减少。HIT可能与这些疾病或治疗手段共存。采取HIT-Ab筛查是鉴别血小板减少原因和排除HIT最简便而有效的手段[12]。
2. 替罗非班诱导血小板减少:在24h内出现重度血小板计数减低(大多数<15×109/L), 替罗非班诱导血小板减少常呈“断崖式”,严重时用药24小时血小板计数下降低于<10×109/L。停用后,逐渐回升。(一般HIT血小板计数下降呈缓慢下降,很少有PLT绝对值<10×109/L)。
3. 心外科手术创伤:一般术后第2天降低最低,第3天起PLT开始恢复[13];当出现不明原因血小板计数持续偏低时[14],应警惕HIT[15, 16]。
4. 主动脉球囊反搏植入(IABP)患者:IABP启用后血小板计数持续下降;多数患者使用肝素抗凝,建议IABP使用4天后血小板计数下降或D-dimer、TAT持续升高,进行HIT-Ab筛查,排除 HIT,避免不必要的抗凝药物类型的更换。
5. 体外膜肺氧合(ECMO)辅助:血小板计数持续低,患者同时使用肝素抗凝,很难鉴别血小板降低是机械性还是免疫性。应警惕ECMO合并HIT[17],及时评估并更换替代抗凝剂[18]。建议所有ECMO患者出现管道堵塞时或在术前和术后第3天动态检测HIT-Ab。
6. 脓毒血症:革兰阴性菌或真菌感染,脓毒血症患者本身处于促凝状态,脓毒血症可合并HIT[19],细菌性感染可能会导致HIT抗体假阳性[4],建议动态观察。治疗时,应已抗菌为主,并给予低度抗凝避免新发血栓。
7. 弥漫性血管内凝血(DIC):DIC早期的高凝状态很难与HIT鉴别。另外DIC会导致PT延长,APTT延长,HIT抗体是最佳鉴别手段。不排除DIC合并HIT[20]。
8. 血栓性血小板减少性紫癜(TTP):是一种累及全身多器官系统的微血管血栓出血综合征,发病率约为3.7/1000 000,主要临床特征包括微血管病性溶血贫血,主要发病机制是体内血管性血友病因子裂解蛋白酶(ADAMTS 13)活性下降导致微血管内血管性血友病因子(vWF)剪切障碍,引起超大分子vWF多聚集黏附血小板增加,形成富血小板微血栓形成[21]。主要临床表现有以皮肤、黏膜出血为主(主要鉴别点,HIT出血少见),伴有轻中度贫血、血小板减少和外周血破碎红细胞增加,ADAMTS 13活性(<10%)(正常55%-170%,妊娠、肝硬化、尿毒症、炎症、DIC时均会显著降低,但一般多>10%),Coombs试验阴性(本院可测)。本院暂时无法检测ADAMTS 13,可联系外送检测。
9. 原发性免疫性血小板减少症(primary immune thrombocytopenia,ITP):又称特发性血小板减少性紫癜。ITP是一种临床排除性诊断。ITP是一种获得性自身免疫性出血性疾病。临床表现以皮肤黏膜出血为主。出血风险随年龄增长而增加。部分患者仅有血小板减少而没有出血症状[22]。60岁以上老年人是高发群体。主要发病机制是由于患者对自身抗原的免疫失耐受,导致免疫介导的血小板破坏增多和免疫介导的巨核细胞产生血小板不足。主要实验室检查为单克隆抗特异性俘获血小板抗原试验(MAIPA法)检测抗原特异性自身抗体(可鉴别免疫性和非免疫性血小板减少)和血小板生成素(TPO)检测(增高提示血小板生成减少,正常提示血小板破坏增加)。ITP患者血小板计数减少病程时间较长。
第二部分 肝素诱导血小板减少症的治疗
一、如何治疗HIT?
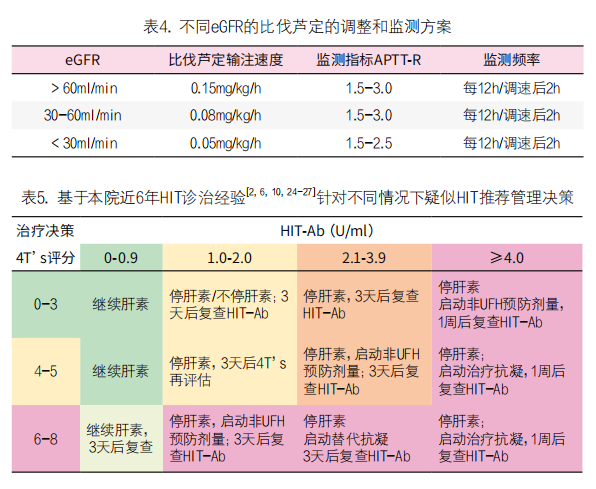
1. 总原则:立即停止接触肝素,启用替代抗凝剂(表3),最新指南[7]反对经验性治疗疑似HIT和低风险HIT患者(停用肝素或更换替代抗凝剂)。临床医生可根据患者出血风险适当调整抗凝强度。抗凝剂的品种选择需要考虑肝、肾功能(见表4)、出血风险和患者的基础疾病,医生也可以结合对抗凝剂使用经验进行选择。
本院24小时提供HIT-Ab检测(2小时内可出结果),即使临床高度怀疑HIT,也可待实验室结果出来再调整治疗方案(表5)。
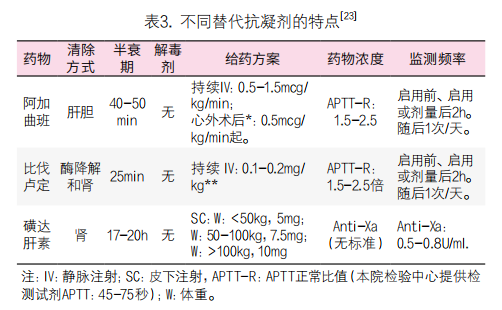
当患者合并有致命或致残性血栓(严重的肺栓塞或深静脉血栓坏疽)时,优先使用静脉抗凝药。急性期HIT首选治疗剂量的非肝素抗凝药。
2. 本院阿加曲班(达贝)20ml:10mg(支)配制方案:1支阿加曲班+30mg生理盐水稀释,静脉泵入速度:9ml/h(患者体重60kg),即0.5mcg/kg/min。肝功能正常时,半衰期为40min; 肝功能损伤时,半衰期可延长至180min,启始剂量为2mcg/kg/min。中度肝功能损伤(Child-Pugh评为B级或C级)时,0.5mcg/kg/min. 剂量调整上下浮动:0.25mcg/kg/min。最大剂量不超过10mcg/kg/min。
二、是否可以输注血小板制剂预防出血?
HIT患者出血不常见,主要以血栓高风险为主。
如评估目前暂无任何出血症状或PLT>15×109/L时,不建议输注血小板制剂。
如临床有出血症状时或PLT<15×109/L时,调低抗凝强度,可考虑输注同型血小板制剂,首选配型血小板。
三、PCI手术抗凝策略?
择期手术时,可待HIT-Ab阴性时,术中使用普通肝素抗凝,术后转阿加曲班。
急诊术中使用比伐芦定/阿加曲班抗凝(首选比伐芦定)。术前和术后可根据患者情况选择阿加曲班或比伐芦定持续抗凝。阿加曲班和比伐芦定之间可直接衔接使用,根据APTT调整抗凝药剂量,衔接期间APTT≤100秒(每2h监测一次,连续3次后转每天一次)。
如果患者无法承受比伐芦定时,延迟PCI至亚急性 HIT或HIT阴性时,使用肝素抗凝。
四、心脏外科手术的抗凝策略?
1. 尽可能推迟手术时机。择期手术时,待HIT-Ab阴性时进行心脏手术,术中采用肝素抗凝。术前和术后均禁用肝素。术后5-10天可能会再发HIT,需密切观察血小板计数情况。
2. 紧急手术时,建议。(1)比伐芦定作为术中抗凝药;(2)在术前或术中进行血浆置换后使用肝素抗凝(血浆置换的操作见附件二);(3)术中肝素抗凝联合抗血小板药(替罗非班或prostacyclin analog)。
五、HIT患者体外循环抗凝策略?
 体外循环抗凝剂首选比伐芦定。
体外循环抗凝剂首选比伐芦定。
 Cardio-pulmonary bypass(CBP)[28]。
Cardio-pulmonary bypass(CBP)[28]。
 预冲剂量:1mg/kg,启动循环时追加一次50mg。
预冲剂量:1mg/kg,启动循环时追加一次50mg。
 持续静脉剂量:2.5mg/kg/h,(调整幅度0.1-0.5mg)维持ACT>400秒(或>基线2.5倍)
持续静脉剂量:2.5mg/kg/h,(调整幅度0.1-0.5mg)维持ACT>400秒(或>基线2.5倍)
 Off-pump。
Off-pump。
 预冲剂量:0.75mg/kg。
预冲剂量:0.75mg/kg。
 持续静脉剂量:1.75mg/kg/h维持ACT≥300秒。
持续静脉剂量:1.75mg/kg/h维持ACT≥300秒。
六、患者已在使用华法林,是否停用?
如果已使用华法林,应使用静脉维生素K拮抗华法林,同时启用非肝素抗凝治疗。
急性期不建议使用华法林。华法林在血小板未恢复前不建议给予。
七、亚急性HIT的口服抗凝药如何选择?
新型口服抗凝药和利伐沙班需根据病情和患者经济能力决定。
1. 非瓣膜病患者且出血风险稳定的患者首选DOAC。
2. 非瓣膜病不合并房颤时,首选利伐沙班。
3. 非瓣膜病且合并房颤时,首选达吡加群。
4. 瓣膜病患者首选华法林。
八、如何选择桥接的华法林?
1. 血小板计数恢复至100×109/L[28]或持续上升幅度≥50%,可启动桥接。
2. 华法林与阿加曲班重叠5天。桥接初期华法林应从小剂量开始,同时监测INR、APTT和D-dimer,维持INR<5.0。阿加曲班可升高INR,重叠第3天起逐渐调低阿加曲班剂量。
建议在华法林使用前进行华法林基因检测,辅助华法林用药剂量调整,降低出血事件。
HIT患者避免使用华法林原因是:华法林使用早期会出现一过性高凝状态,主要是由于蛋白C和VII因子的半衰期(6-8h)较短,华法林使用的前3天可能由于蛋白C活性降低导致高凝状态,出现皮肤微血管血栓,导致皮肤坏死。相关报道案例非常罕见。
九、如何桥接新型口服抗凝剂(DOAC)?
直接口服抗凝剂包括利伐沙班和达吡加群(本院有的抗凝药)。目前发表的文献多数经验为利伐沙班。
急性期HIT,利伐沙班15mg/Bid或者20mg/Qd,持续3周;
独立HIT(不合并血栓):利伐沙班15mg/Bid或者20mg/Qd,持续到血小板恢复至100×109/L。
停止阿加曲班输注的2小时内启用新型口服抗凝药。
达吡加群的使用剂量:110mg/Bid,体重>80kg建议150mg/Bid。
十、替代抗凝剂需要使用多长时间?
口服抗凝剂持续时间根据患者情况而定[15, 29]:
1. 不伴新发血栓时,HIT-Ab检测阴性后延长抗凝1个月。
2. 合并新发血栓时,HIT-Ab阴性后延长抗凝3个月[9]。
3. 如患者基础疾病需进行抗凝时,按基础疾病抗凝要求制定抗凝策略。
十一、是否需要使用抗血小板药物?
HIT且患者无其他需要抗血小板指征时,不建议合并使用抗血小板药。
HIT伴CAD和支架内血栓时,可继续使用抗血小板药,但需要关注出血风险。建议使用前检测血小板聚集率,评估血小板功能。
十二、HIT-Ab何时转阴?
依据患者HIT-Ab浓度而定。本院患者一般2-4周不等。
峰值HIT-Ab<4.0U/ml 时,间隔3天复查一次;
峰值HIT-Ab(4.1-10.0)U/ml时,间隔1周复查一次;
峰值HIT-Ab:>10.0U/ml时,每2周复查一次,直至HIT-Ab阴性。
十三、如何快速消除HIT-Ab浓度或抑制HIT抗体诱导血小板活化?
1. 适应症:(1)需要紧急手术患者[1]。(2)经常规替代抗凝治疗血小板计数持续未恢复的难治性HIT[30-32]。(3)自发性HIT(近3月内无肝素应用史,自发出现血小板计数下降且血清学抗体阳性)[31, 33]。
2. 治疗方法:方法一,血浆置换疗法可快速清除或降低HIT-Ab浓度,具体实施方法(参见附件二)。方法二,高剂量丙种球蛋白冲击疗法,可抑制HIT抗体介导的血小板活化。目前暂无中国人群利用高剂量丙种球蛋白封闭HIT抗体的治疗报道。国外研究有报道采用高剂量(1.0-2.0g/kg/d)丙种球蛋白连续2天,成功封闭HIT抗体的治疗经验,这些患者在进行高剂量丙种球蛋白封闭后进行相关手术治疗。研究也认为如ELISA法测抗体依旧强阳性,可能提示IVIG并没有封闭目标抗原,而是有可能通过血小板Fcy受体竞争性抑制血小板活化。尽管体外研究预示,IVIG抑制肝素依赖的血小板活化,但是治疗效果的个体依赖的差异仍需研究进一步确认。研究观察显示,高剂量IVIG抑制肝素依赖抗体诱导血小板活化上存在剂量依赖性。
中国人群在使用丙种球蛋白冲击治疗成人ITP时,采用剂量为1.0g/kg/d,连续2天-3天[34]。对于常规治疗无效患者可选择此方法。
使用丙种球蛋白可能会增加血液粘度,对于长期制动的患者,有可能会增加血栓风险。使用过程中需警惕。
十四、是否可以插入下腔静脉过滤器?
禁止插入下腔静脉滤过器预防肺动脉栓塞。
十五、急诊室紧急处理HIT病史患者?
病史在3个月内,需要能快速识别“识别卡”。教育患者存在“肝素过敏”和“HIT诊断日期”。超过3个月无需携带识别卡。
十六、独立HIT且超声提示无血栓,是否需要抗凝?
建议低剂量非肝素抗凝直到血小板计数恢复。
除非持续存在HIT,且血小板计数未恢复时,延长抗凝至3个月。
第三部分 肝素诱导血小板减少症患者体外生命支持装置抗凝策略
1. 主动脉球囊反搏术(IABP)辅助。急性期及亚急性期HIT,采用阿加曲班抗凝,维持APTT-R 1.5-2.5(APTT 50-60秒)之间[7];HIT-Ab阴性时,可采用生理盐水冲管或枸橼酸钠抗凝。
2. 肾脏替代治疗(血液透析或超滤)时抗凝策略:急性期HIT建议首选阿加曲班作为抗凝药,其次为比伐芦定。(急性期需全身抗凝)[7];非急性期HIT建议使用枸橼酸钠抗凝(非急性期仅需局部抗凝,枸櫞酸钠仅仅有局部抗凝作用)。
3. 体外膜肺氧合(ECMO)时抗凝策略:首选阿加曲班抗凝,维持APTT 45-55秒(APTT-R 1.5-2.0),保持D-dimer不持续上升或无明显血栓。
第四部分 特殊患者合并肝素诱导血小板减少症
1. 儿科HIT管理:儿科管理与成人类似。需控制抗凝药物剂量,避免出血。
2.孕妇HIT管理:孕妇合并HIT的病例报道较少[35]。孕妇合并HIT的替代抗凝剂仅达那肝素(Danaparoid)被美国FDA批准,研究显示达那肝素在怀孕和哺乳期是安全的。但达那肝素并没有在中国上市。有研究认为使用璜达肝癸钠(Fondaparinux)是一种选择[36],璜达肝癸钠在哺乳期是安全的,但在怀孕期间的安全性仍不太清楚[37]。也有使用阿加曲班作为预防血栓的抗凝药[35],但阿加曲班在怀孕和哺乳期的安全性均不太清楚。最近研究对29周孕妇伴严重瓣膜病,并发HIT时,使用璜达肝癸钠(IC 2.5mg)联合阿司匹林(100mg)作为抗凝剂[37]。患者在分娩后6个月成功进行了二尖瓣置换和三尖瓣成形手术。
第五部分 肝素诱导血小板减少症的预后
一、HIT患者更换抗凝剂后血小板计数多长时间可恢复?
一般90%的患者7天内恢复至正常水平。经治疗超过1周血小板计数仍未回升时,判断为难治性HIT。建议采取血浆置换或高剂量丙种球蛋白冲击治疗。
二、HIT-Ab阴性时的VTE的治疗和预防
建议使用口服抗凝药治疗和预防VTE。(利伐沙班、达吡加群、磺达肝癸钠和华法林均可)。
三、既往诊断HIT患者的抗凝策略?
1.筛查HIT-Ab检测,评估患者体内是否仍然存在HIT-Ab。
2.HIT-Ab阴性时,手术时可以使用肝素;术前和术后建议使用阿加曲班抗凝。
3.HIT-Ab阳性时,选择阿加曲班抗凝,侵入性操作时选择比伐芦定抗凝。
四、HIT抗体阴性时,是否出现新发血栓?
在有可能。根据患者的血栓风险考虑是否延长抗凝时间。
第六部分 HIT的护理要求
1.所有诊断或高度疑似HIT患者,应在患者床旁给出清晰标识“禁用任何肝素”,包括留置管的肝素帽或管道肝素冲洗。
2.注意观察患者四肢皮温、肤色,紧惕深静脉血栓形成(下肢深静脉血栓较常见)。
3.注意观察所有留置管道的通畅情况(尤其是右颈内静脉置管),HIT急性期在血管有破损或血管内膜有损伤处易形成血栓。
4.注意了解患者是否存在腹部不适,肠鸣音情况。老年患者和长期卧床易发生肠系膜动、静脉血栓和缺血性肠梗阻。
5.HIT患者进行转科时,应避免交接班过程中,避免急性期或亚急性 HIT患者,肝素再接触。
注:医生在给患者办理出院时,应在出院小结中注明患者住院期间出现过肝素诱导血小板减少症,提示其他医生或医院注意使用抗凝策略,尽可能避免使用肝素。
第七部分 附 件
附件一:肝功能Child-Pugh改良分级法[38]。

附件二:血浆置换的治疗
血浆置换:指将患者血液引入血浆分离器,使血细胞与血浆分离,弃去分离出的全部血浆,按比例补充一定量的正常血浆和白蛋白或血浆代用品、电解质等生理平衡液,从而达到清除存在于患者血浆由与蛋白结合的毒物的目的。适用于血液透析、血液灌流不奏效者,以及清除与血浆蛋白结合率>60%的药物、毒物等,如催眠药、降糖药、心血管药物等。短期内可有效改善机体内环境,为受损肝细胞的修复和再生创造适宜条件。
近期国外有研究采用血浆置换的方法进行清除HIT-Ab,效果显著[39-43],尤其是难治性HIT[44]。国外血浆置换多用于肝性脑病的治疗。血流泵速度控制在(80-120)ml/min,血浆分离速度为(20-30)ml/min,血浆置换量每次为1500ml-2000ml,治疗时间70min-100min,每例患者治疗1-3次。
中国专家制定了儿童血浆置换的专家共识[45],儿童一般血浆置换量为40-60ml/kg/次,不超过儿童血浆容量的2倍。高频小容量(每次置换量约为患者血浆容量)优于低频大容量。建议每2-3天置换一次,共3次。血浆置换时管道采用阿加曲班抗凝[41]。
参考文献
Warkentin TE, Climans TH, Morin PA. Intravenous immune globulin to prevent heparin-induced thrombocytopenia [J]. The New England journal of medicine, 2018, 378(19):1845-1848. doi: 10.1056/NEJMc1801799.
范庆坤, 李玲, 陈晓英, 等. 全自动免疫分析法检测肝素诱导性血小板减少症抗体的诊断效能研究 [J]. 中华检验医学杂志, 2017, 40(2):109-113. doi: 10.3760/cma.j.issn.1009-9158.2017.02.008.
Dhakal B, Kreuziger LB, Rein L, et al. Disease burden, complication rates, and health-care costs of heparin-induced thrombocytopenia in the USA: A population-based study [J]. Lancet Haematol, 2018, 5(5):e220-e231. doi: 10.1016/S2352-3026(18)30046-2.
Greinacher A. Heparin-induced thrombocytopenia [J]. The New England journal of medicine, 2015, 373(3):252-261. doi: 10.1056/NEJMcp1411910.
Kuter DJ, Konkle BA, Hamza TH, et al. Clinical outcomes in a cohort of patients with heparin-induced thrombocytopenia [J]. American journal of hematology, 2017, 92(8):730-738. doi: 10.1002/ajh.24759.
范庆坤, 陈晓英, 刘彬, 等. 肝素诱导性血小板减少症41例临床分析 [J]. 内科急危重症杂志, 2017, 23(01):18-22, 39. doi: 10.11768/nkjwzzzz20170106.
Cuker A, Arepally GM, Chong BH, et al. American society of hematology 2018 guidelines for management of venous thromboembolism: Heparin-induced thrombocytopenia [J]. Blood Adv, 2018, 2(22): 3360-3392. doi: 10.1182/bloodadvances.2018024489.
中国医师协会心血管内科医师分会血栓防治专业委员会. 肝素诱导的血小板减少症中国专家共识(2017) [J]. 中华医学杂志, 2018, 98(6): 408-417. doi: 10.3760/cma.j.issn.0376-2491.2018.06.003.
加拿大血栓协会. Hit指南 [J]. 2017, http://thrombosiscanada.ca/wp-content/uploads/2017/02/27-Heparin-Induced-Thrombocytopenia-2017Feb02-FINAL-1.pdf(last time:2019.03.06).
范庆坤, 杜佳, 李玲, 等. Hit-ab检测对肝素诱导血小板减少症新发血栓的预测价值 [J]. 中华检验医学杂志, 2019, 42(4): 250-254.
Cuker A. Management of the multiple phases of heparin-induced thrombocytopenia [J]. Thrombosis and haemostasis, 2016, 116(5): 835-842. doi: 10.1160/TH16-02-0084.
Warkentin TE, Aird WC, Rand JH. Platelet-endothelial interactions: Sepsis, hit, and antiphospholipid syndrome [J]. Hematology / the Education Program of the American Society of Hematology American Society of Hematology Education Program, 2003, 497-519.
Warkentin TE, Greinacher A. Heparin-induced thrombocytopenia and cardiac surgery [J]. The Annals of thoracic surgery, 2003, 76(2): 638-648.
Selleng S, Malowsky B, Strobel U, et al. Early-onset and persisting thrombocytopenia in post-cardiac surgery patients is rarely due to heparin-induced thrombocytopenia, even when antibody tests are positive [J]. Journal of thrombosis and haemostasis : JTH, 2010, 8(1):30-36. doi: 10.1111/j.1538-7836.2009.03626.x.
linkins LA, Dans AL, Moores LK, et al. Treatment and prevention of heparin-induced thrombocytopenia: Antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines [J]. Chest, 2012, 141(2 Suppl):e495S-530S. doi: 10.1378/chest.11-2303.
Warkentin TE, Sheppard JA, Horsewood P, et al. Impact of the patient population on the risk for heparin-induced thrombocytopenia [J]. Blood, 2000, 96(5):1703-1708.
Kimmoun A, Oulehri W, Sonneville R, et al. Prevalence and outcome of heparin-induced thrombocytopenia diagnosed under veno-arterial extracorporeal membrane oxygenation: A retrospective nationwide study [J]. Intensive care medicine, 2018, 44(9):1460-1469. doi: 10.1007/s00134-018-5346-y.
Rouge A, Pelen F, Durand M, et al. Argatroban for an alternative anticoagulant in hit during ecmo [J]. J Intensive Care, 2017, 5(39. doi: 10.1186/s40560-017-0235-y.
Maharaj S, Chang S. Anti-pf4/heparin antibodies are increased in hospitalized patients with bacterial sepsis [J]. Thrombosis research, 2018, 171(111-113. doi: 10.1016/j.thromres.2018.09.060.
Yoshika M, Komiyama Y, Hirakawa A, et al. A difficult diagnosis case of prolonged thrombocytopenia with sepsis and disseminated intravascular coagulation [J]. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis, 2011, 17(4):410-413.
中华医学会血液学分会血栓与止血学组. 血栓性血小板减少性紫癜诊断与治疗中国专家共识(2012年版) [J]. 中华血液学杂志, 2012, 33(11): 983-984.
中华医学会血液学分会止血与血栓学组. 成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版) [J]. 中华血液学杂志, 2016, 37(2):89-93.
Kelton JG, Arnold DM, Bates SM. Nonheparin anticoagulants for heparin-induced thrombocytopenia [J]. The New England journal of medicine, 2013, 368(8):737-744. doi: 10.1056/NEJMct1206642.
范庆坤, 杨军, 张李涛, 等. 先天性心脏病术后肝素诱导性血小板减少症一例并文献复习 [J]. 解放军医药杂志, 2013, 25(12): 114-116. doi: 10.3969/j.issn.2095-140X.2013.12.032.
范庆坤, 张李涛, 杨杰, 等. 二尖瓣置换术后肝素诱导性血小板减少症的诊治体会 [J]. 内科急危重症杂志, 2014, 20(05): 349-350. doi: 10.11768/nkjwzzzz20140524.
范庆坤, 张真路. 肝素诱导性血小板减少症诊疗策略 [J]. 内科急危重症杂志, 2014, 20(06): 408-412. doi: 10.11768/nkjwzzzz20140620.
范庆坤, 张真路. 如何面对肝素诱导血小板减少症的诊断困惑 [J]. 中华检验医学杂志, 2019, 42(4): 227-231.
University of Iowa Health Care. Hit指南爱荷华大学医疗保健 [J]. 2017, https://www.healthcare.uiowa.edu/familymedicine/fpinfo/Docs/HIT%20Guide.pdf(last time: 2019.03.06).
Watson H, Davidson S, Keeling D. Guidelines on the diagnosis and management of heparin-induced thrombocytopenia: Second edition [J]. British journal of haematology, 2012, 159(5): 528-540. doi: 10.1111/bjh.12059.
Ibrahim IF, Rice L. Intravenous immunoglobulin for heparin-induced thrombocytopenia [J]. Chest, 2017, 152(4): 906-907. doi: 10.1016/j.chest.2017.05.043.
Mohanty E, Nazir S, Sheppard JI, et al. High-dose intravenous immunoglobulin to treat spontaneous heparin-induced thrombocytopenia syndrome [J]. Journal of thrombosis and haemostasis : JTH, 2019, doi: 10.1111/jth.14411.
Padmanabhan A, Jones CG, Pechauer SM, et al. Intravenous immunoglobulin for treatment of severe refractory heparin-induced thrombocytopenia [J]. Chest, 2017, doi: 10.1016/j.chest.2017.03.050.
Irani M, Siegal E, Jella A, et al. Use of intravenous immunoglobulin g to treat spontaneous heparin-induced thrombocytopenia [J]. Transfusion, 2018, doi: 10.1111/trf.15105.
中华医学会血液学分会血栓与止血学组. 成人原发免疫性血小板减少症诊断与治疗中国专家共识(2012年版) [J]. 中华血液学杂志, 2012, 33(11): 975-977.
Chaudhary RK, Nepal C, Khanal N, et al. Management and outcome of heparin-induced thrombocytopenia in pregnancy: A systematic review [J]. Cardiovascular & hematological agents in medicinal chemistry, 2015, 13(2): 92-97.
De Carolis S, di Pasquo E, Rossi E, et al. Fondaparinux in pregnancy: Could it be a safe option? A review of the literature [J]. Thrombosis research, 2015, doi: 10.1016/j.thromres.2015.04.001.
James AH. Prevention and management of thromboembolism in pregnancy when heparins are not an option [J]. Clin Obstet Gynecol, 2018, 61(2):228-234. doi: 10.1097/GRF.0000000000000357.
Child-pugh肝功能改良分级法 [J]. 中华普通外科学文献(电子版), 2013, 7(2): 153.
Warkentin TE, Sheppard JA, Chu FV, et al. Plasma exchange to remove hit antibodies: Dissociation between enzyme-immunoassay and platelet activation test reactivities [J]. Blood, 2015, 125(1):195-198. doi: 10.1182/blood-2014-07-590844.
van der Veen BS, Besseling R, Hoogendoorn M. Serial adamts13 measurements during initial plasma exchange therapy guide decisions for management of unresponsive thrombotic thrombocytopenic purpura [J]. Transfusion, 2015, 55(10): 2511-2515. doi: 10.1111/trf.13187.
Ramu B, Cogswell RJ, Reding MT, et al. Plasma exchange to remove heparin-induced thrombocytopenia antibodies and the use of heparin during cardiopulmonary bypass in critically ill cardiac patients [J]. The Journal of heart and lung transplantation : the official publication of the International Society for Heart Transplantation, 2018, 37(8):1038-1040. doi: 10.1016/j.healun.2018.04.016.
[42] Limaye K, Ravilla R, Boye B, et al. Heparin-induced thrombocytopenia in patients receiving plasma exchange [J]. The American journal of medicine, 2014, 127(12):e3-4. doi: 10.1016/j.amjmed.2014.08.004.
Poullin P, Pietri PA, Lefevre P. Heparin-induced thrombocytopenia with thrombosis: Successful treatment with plasma exchange [J]. British journal of haematology, 1998, 102(2): 630-631.
Schell AM, Petras M, Szczepiorkowski ZM, et al. Refractory heparin induced thrombocytopenia with thrombosis (hitt) treated with therapeutic plasma exchange and rituximab as adjuvant therapy [J]. Transfusion and apheresis science: official journal of the World Apheresis Association: official journal of the European Society for Haemapheresis, 2013, 49(2):185-188. doi: 10.1016/j.transci.2013.01.007.
中国医师协会儿科医师分会血液净化专业委员会. 儿童血浆置换临床应用专家共识 [J]. 中华实用儿科临床杂志, 2018, 33(15): 1128-1135.




