两种血红蛋白参考方法性能评价与比较研究
【摘要】目的 研究血红蛋白(Hb)测定参考方法,为Hb产品量值溯源提供保障。方法 按照JCTLM列表推荐的汉诺威医学院(RfB)参考方法和国际血液学标准化委员会(ICSH)推荐参考方法的要求,建立Hb参考方法,通过测定有证标准物质验证测量系统的准确性,通过测定高中低样本,进行Hb测定精密度研究,通过能力验证实验进行正确度和一致性研究,通过方法比对进行量值传递研究。结果 ICSH参考方法变异系数变化范围0.0%~0.5%,RfB参考方法变异系数变化范围0.2%~0.3%,参考物质测定结果|En|≤1,能力验证活动,两种参考方法测定结果都在等效限(±1.5%)范围内,常规检测系统溯源到参考方法后,参考系统和常规系统同时测定多例新鲜临床样本的线性相关系数r≥0.999,斜率在1.00±0.02范围内。结论 RfB参考方法更容易控制精密度和准确度,操作更稳定,常规检测系统溯源到参考方法后,进一步证明与参考方法测定结果一致。
【关键词】血红蛋白;参考方法;量值溯源
血红蛋白(Hb)是临床血常规检测的常用指标[1],为了保证检测结果的准确性,需要将血红蛋白检测结果溯源到相应的标准,目前血红蛋白可溯源的标准有推荐参考方法,比如国际血液学标准化委员会(ICSH)推荐的参考方法[2]和JCTLM列表推荐的汉诺威医学院(RfB)参考方法[3],ICSH推荐的参考方法已转化为我国卫生行业标准WS/T 341-2011《血红蛋白测定参考方法》[4],前处理方式为体积定容,放置5min后用0.22µm滤膜过滤,操作过程需要较高的体积准确度以及过滤膜质量,对人员操作要求较高。RfB推荐的参考方法,前处理过程为称重,放置90min-24h后离心,可减少因人员操作和处理过程的影响。本实验室建立了ICSH和RfB血红蛋白测定的两种参考方法,比较了两种参考方法的优缺点。为了验证参考方法用于产品溯源的可行性,对血红蛋白测定参考方法的性能进行了评价,并应用到产品的量值溯源。
一、材料与方法
1. 仪器与试剂:(1)UV-3900H分光光度计和原装比色杯(日本日立公司);(2)A级棕色硼硅酸盐容量瓶(25ml,BRAND公司);(3)外置活塞式移液器(100μl,Gilson);(4)血液分析仪(迈克生物股份有限公司);(5)氰化高铁血红蛋白试剂(即文-齐氏浓缩液)购自天津现代高科技研究院中山研究所,使用前根据说明书按比例稀释;(6)Hb参考物质购自欧洲参考物质与测量研究所(Institute of Reference Materials and Measurement,IRMM),标准号、Hb浓度和扩展不确定度(k=2):BCR-522[(800.3±1.3)mg/L]。新鲜血液样本;(7)一次性无菌滤膜(孔径0.22μm)为亚速旺公司产品;(8)一次性无菌注射器(2ml,1ml)购自成都事丰医疗器械有限公司;(9)生理盐水购自科伦药业;(10)低纤维干纸巾为金佰利产品;(11)避光锡箔纸为屋田科技产品。
2. 方法:按照ICSH和RfB推荐的参考方法进行相关实验。两种参考方法差异见表1。
表1. 参考方法差异比较

3. 重复性精密度实验:因新鲜全血样本须在短时间内测完,故本研究设计了重复性精密度实验,取高中低3个样本,ICSH参考方法,每个样本分别制备2份251倍稀释待测样本,每份待测样本在UV-3900H分光光度计上测定3次,计算6次稀释样本测定结果均值(x)、标准差(s)和变异系数(coefficient of variation,CV),结果应符合参考方法规定的CV≤0.5%的要求。RfB参考方法,每个样本制备4个稀释待测样本,保证每个稀释待测样本的吸光度在0.9±0.5范围内,每个稀释待测样本在UV-3900H分光光度计上测定3次,计算12次测定结果的均值(x)、标准差(s)和变异系数(CV),结果应符合参考方法规定的CV≤0.5%的要求[5]。
(1)正确度实验:测定有证参考物质BCR-522,测量值和参考物质证书上标示的靶值进行比较,要求|En|≤1[6]。
(2)能力验证实验:参加国际临床化学联合会(IFCC)组织的能力验证实验(RELA)和国内参考测量实验室能力验证活动,测定结果与其他实验室结果进行比较,结果应在规定的等效限范围内(等效限:±1.5%[7])。国内能力验证活动主要由国家卫健委临床检验中心(NCCL)和上海临床检验中心(SCCL)组织。
(3)产品溯源应用:用参考方法给新鲜全血样本定值,用定值的样本校准常规血液分析仪,然后用参考方法和常规血液分析仪测试多例新鲜全血样本,进行回归分析,检验常规系统溯源到参考方法后,在临床样本检测时与参考方法测量结果是否一致。
二、研究结果
1. 重复性精密度实验:3个样本的精密度实验结果,ICSH参考方法CV为0.0~0.5%,RfB参考方法CV为0.2~0.3%,均符合Hb参考方法规定的≤0.5%的要求。结果见表2。
表2. 精密度实验结果
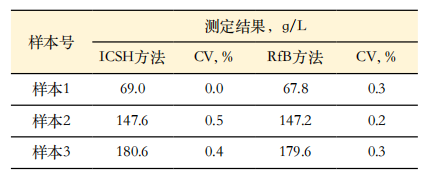
2. 正确度实验结果:测定有证标准物质BCR-522,测定结果满足|En|≤1的要求,结果见表3。
表3. 有证标准物质测定结果

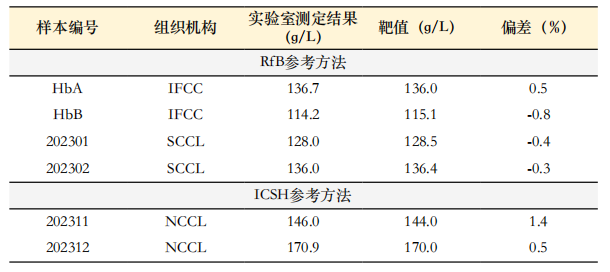
3. 能力验证结果:参加IFCC组织的能力验证实验(RELA)和国内参考测量实验室能力验证活动,结果在等效限范围内(等效限:±1.5%),符合要求。IFCC和SCCL组织的能力验证活动,靶值为:剔除在等效限外的结果,其他所有结果的均值为靶值。结果见表4。
表4. 能力验证结果
4. 产品溯源应用:常规血液分析仪测定系统溯源到参考方法后,与参考方法同时测定多例新鲜临床样本,经过线性回归分析,线性相关系数r≥0.999,斜率在1.00±0.02范围内,结果一致性很好,符合《全国临床检验操作规程》第4版上规定的Hb正确度偏倚≤±2.7%的要求[8],达到了溯源目的,结果见图1.
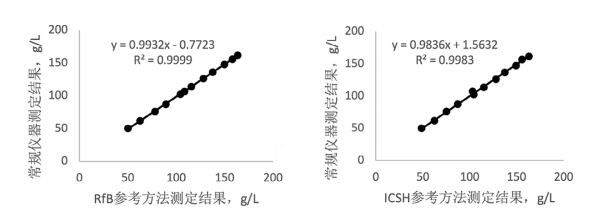
图1. 常规血液分析仪与参考方法测定结果比较
三、讨论与分析
血红蛋白是血常规检测中很重要的一项,其检测结果的准确性直接关系到患者病情的诊断[9],国际上目前推荐血红蛋白参考方法的机构有两家(RfB和ICSH),都是基于紫外可见分光光度法,两个机构推荐的Hb参考方法只是前处理方式不同,RfB参考方法是称重法,ICSH参考方法是体积法,各有优缺点。
本研究显示,U3900-H分光光度计测定国际参考物质BCR-522,测定偏差比较小,参加国际国内能力验证活动,两种参考方法检测结果都在±1.5%的控制限范围内,这说明用HiCN分光光度法进行Hb参考方法实验研究的准确度符合要求;测定高中低全血样本,两种参考方法的重复性精密度≤0.5%,但实验过程中发现ICSH参考方法对人员操作要求比较高,取样的一致性直接影响平行样本间的精密度,但RfB参考方法基本不存在取样一致性方面的影响;对于溯源体系的建立,血红蛋白两种参考方法建立所需的材料,在实验室都是比较容易实现的,对于ICSH参考方法,主要控制的关键点为移液的体积,只要保证移液器体积准确,且移液时吸头外表面擦拭干净,不残留样本,多次重复移液时一致性很好,就能获得很好的精准度,RfB参考方法控制的关键点为每次取样加入瓶中时,保证样本和稀释液能完全充分的反应,且样本的密度也要准确对应,才能得到准确的结果。本研究中发现两种参考方法都有各自比较难控制的关键点,ICSH参考方法关键点为取样体积,RfB参考方法关键点为样本密度,但目前市面上也有测定密度的仪器,比较容易解决这个问题。从经验分析,应用称重法的RfB参考方法更好实施,过程更容易控制质量。
由于血红蛋白检测的样本为新鲜全血,新鲜血只能稳定数小时[10],样本的新鲜程度、人员操作、环境温湿度控制、样本的采集和保存、样本采集后多长时间内测完、仪器设备的控制等都会影响检测结果的准确性,故要实现血红蛋白检测的量值溯源,是一项比较复杂的工作[10],需要有一定经验的人员才能完成。本实验室已建立血红蛋白检测的溯源体系,可以使血红蛋白检测项目可以溯源到参考方法,对实现该项目检测结果的一致化和结果互认具有重要意义。
本实验室的量值溯源工作主要依据ISO17511:2020标准文件[11]实施,量值溯源质量控制是一项需要持续维持和不断提升的工作,对于本研究中的一些问题,还在进一步探索中,比如加样体积准确度的深入研究、密度测试研究、参加国际国内能力验证活动等,期待通过与同行业专家的交流和不断的经验积累,把血常规的标准化工作做得更好[5]。
参考文献
彭明婷, 谷小林, 陆红, 等. 我国血细胞分析参考系统的建立[J]. 中华检验医学杂志, 2006, 29(3): 196-198.
ZWART A, VAN ASSENDELFT O W, BULL BS, et al. Recommendations for reference method for haemoglobinometry in human blood (ICSH standard 1995) and specifications for international haemiglobinocyanide standard(4th edition) [J]. J Clin Pathol, 1996, 49(4): 271-274.
Denis Grote-Koska, Rainer Klauke, Patricia Kaiser, et al. Total haemoglobin-a reference measuring system for improvement of standardization[J]. Clin Chem Lab Med 2020; aop.
WS/T 341: 2011 血红蛋白测定参考方法[S]. 北京: 中国标准出版社, 2011.
许 蕾, 王 青, 诸佩超, 等. 血红蛋白测定参考方法实验初探[J]. 检验医学, 2017, 32(8): 709-712
中国合格评定国家认可委员会. CNAS-GL002: 2018 能力验证结果的统计处理和能力评价指南[S]. 北京: 中国合格评定国家认可委员会, 2018.
The International Federation of Clinical Chemistry and Laboratory Medicine(IFCC). RELA-IFCC External Quality assessment scheme for Reference Laboratories in Laboratory Medicine. http://dgkl-rfb.de:81/4Daction/g_search_RELA/RELA2022,2024-02-23.
尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4版. 北京: 人民卫生出版社, 2015: 1015
彭明婷, 申子瑜. 血细胞分析溯源体系的建立及有关问题的探讨[J]. 中华检验医学, 2004, 27(3): 132-133
康 娟, 王会如, 孙京昇, 等. 以血细胞分析为例浅谈医学参考测量实验室的建立[J]. 检验医学, 2018, 33(2): 177-181
ISO 17511: 2020. In vitro diagnostic medical devices-Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples. Geneva: ISO, 2020.




