嗜血细胞综合征一例诊疗分析
一、病例信息
患儿女,2岁3月,其父母主诉间断发热12天,眼睑水肿8天,于2024年2月23日入院。
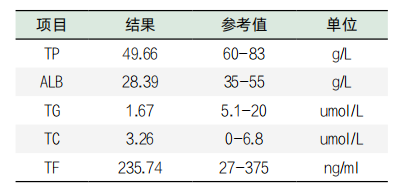
现病史:患儿于12天前无明显诱因出现发热,体温最高38.8℃,时有咳嗽,阵发性单声咳,伴皮疹以胸背部为著,全身浅表淋巴结未触及肿大。在11天前患儿出现腹泻,在8天前出现眼睑水肿。血细胞分析、血凝及炎性指标和生化检验结果分别见表1和表2。
表1. 血细胞和血凝及炎性指标检验结果
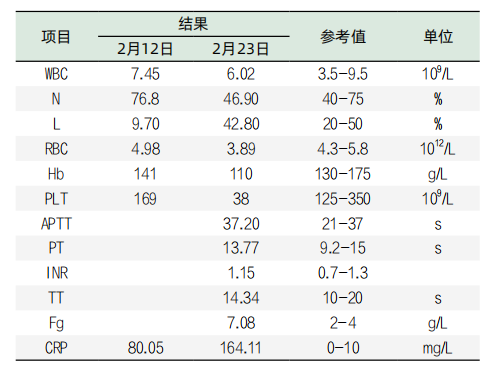
表2. 部分生化检验项结果目
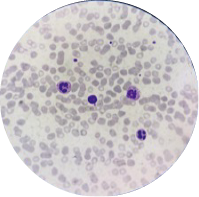
血涂片显示:中性杆状核粒细胞2%、中性分叶核粒细胞59%、嗜酸性粒细胞1%、淋巴细胞26%、单核细胞12%,成熟中性粒细胞胞浆中可见中毒颗粒和空泡,见图1。
余检验结果未见异常。
超声结果显示:腹腔游离液,肝脾大。
CT结果显示:双侧胸腔积液,胆囊壁厚,少量腹腔积液不除外。
患儿2次血细胞检验RBC和PLT有下降趋势,呈两系降低趋势,发热且脾大,符合嗜血细胞综合征的诊断线索(HPS)[1],故建议病人转院到上级医院治疗。2024年2月24日上午转邢台市人民医院治疗。
追踪邢台市人民医院结果,血细胞分析及炎性指标和生化检验结果分别见表3和表4。
表3. 血细胞和血凝及炎性检验结果(单位和正常参考值略)
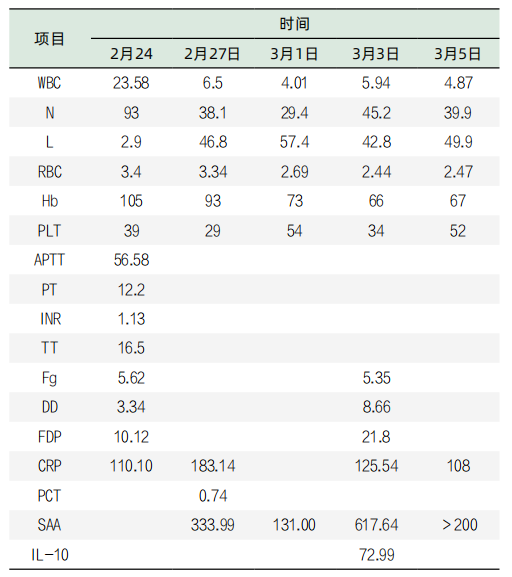
表4. 部分生化检验项结果目
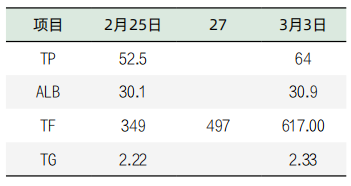
肝功其他指标、肾功能、G试验、GM试验、肥达-外斐试验、自身抗体谱、呼吸道病毒抗体阴性;EBVDNA和CMVDNA检测结果低于检测限,细环病毒和多瘤病毒均阳性;骨髓涂片显示缺铁伴粒系成熟障碍、巨核细胞成熟轻度障碍;sCD25>5000 U/ml,NK数量总数和百分比均在正常参考范围中;尿蛋白阳性。
二、诊疗分析
1. 初步诊断:本患者(1)发热12天、体温38.5℃;(2)影像学检查显示肝脾大;(3)两系血细胞减少,RBC和Hb进行性降低;2月12日RBC由4.98×1012/L降为2月23日的3.89×1012/L、Hb由140g/L降为110g/L,PLT由169×109/L降为38×109/L;(4)铁蛋白617ng/ml;(5)sCD25>5000U/ml。虽然三次检查TG呈进行性升高,未超过3mmol/L、骨髓涂片结果未找到噬血细胞、NK总数和百分比均在正常参考范围中,但该患者的病情符合HPS的诊断[2,3]。
HPS是一组因遗传性或获得性免疫异常导致的以过度炎症反应为基本特征的临床综合症。感染、肿瘤和自身免疫性疾病是HPS常见的诱因。感染相关HPS常因患者临床表现不典型甚至发展为脓毒血症/脓毒症休克掩盖临床表现和症状而被漏诊误诊导致预后不良。感染相关HPS中最常见的病原体为病毒,EBV病毒感染占一半以上,其次是疱疹病毒、巨细胞病毒腺病毒和人类微小病毒。本例患者SAA异常升高,提示SAA作为急性时相反应蛋白,快速激活和诱导了趋化因子,趋化了单核细胞、中性粒细胞、肥大细胞和T淋巴细胞迁移,加速了机体的炎症反应,并诱导了IL-10等抗炎因子[4]使IL-10升高;SAA和CRP在细菌感染时呈现同时上升趋势,但在病毒感染中,SAA的上升幅度时CRP的5-11倍[4],在3月3日时SAA/CRP的比值为4.92,细环病毒和多瘤病毒检测结果均为阳性,符合病毒性感染性疾病,故支持该患者为病毒感染相关性HPS。肿瘤相关性HPS常见于成人,淋巴瘤相关HPS是常见的类型,但该患儿无全身淋巴结肿大,故可初步排除肿瘤相关性HPS。由于患者自身抗体谱均阴性,故可排除自身免疫性疾病相关性HPS。
在疾病的急性期,由于活化的巨噬细胞分泌使血清TF升高,铁蛋白升高的即刻变化与病情变化密切相关,病情恶化时铁蛋白明显升高,好转时下降;由于活化的巨噬细胞浸润组织,产生大量炎性因子损伤组织,可引起肝功能的损害如转氨酶、LDH或/和TB升高,低蛋白血症及肾功能损害如尿蛋白阳性;由于TNF-a高表达降低脂蛋白酶活性可引起TG升高;由于巨噬细胞诱导纤溶酶原活性因子分泌增高引起纤溶酶升高,使纤维蛋白降解增加。本患者TF持续上升,提示患者病情处于急性时期;患者呈现低蛋白血症和尿蛋白阳性,这提示“炎症因子风暴”损伤肝功能和肾功能;患者Fg未降低,可能与Fg为急性时相蛋白有关,但DD和FDP异常升高,提示纤溶酶活性增加、纤溶活性增强;患者NK数量总数和百分比正常但并不表示NK细胞活性降低或完全缺如[5],需要进一步测定NK细胞活性。本患者上述指标支持HPS的诊断。
2. 鉴别诊断:(1)它与急性白血病的诊断:肝脾肿大、发热和一系或二系血细胞减少与急性白血病的临床特点有相似之处,但该患儿血涂片和骨髓涂片均未见原幼细胞,故可排除急性白血病。(2)朗格汉斯组织细胞增生症:朗格汉斯组织细胞增生症也会出现肝脾肿大、发热和全血细胞减少,但该患儿在低蛋白血症时,肝酶和总胆红素并未升高[6],骨髓涂片未见朗格汉斯组织细胞,故可排除朗格汉斯组织细胞增生症。
3. 不足之处:HPS由于触发因素不同,可分为原发性和继发性两大类。原发性HPS是一种常染色体和性染色体隐性遗传病,分为家族性HPS和免疫缺陷综合征,2岁以内发病者占90%以上。继发性HPS与各种潜在疾病有关,如感染、肿瘤和风湿性疾病启动免疫系统的活化机制而引起的一种反应性疾病。无论儿童还是成人,都存在原发性HPS的可能。由于患儿没检测二代测序,故无法确定其是否为原发性HPS。
4. 诊疗体会:HPS是一组由活化的淋巴细胞和组织细胞过度增生但免疫无效,引起多器官高炎症反应的临床综合症。其主要的发病机制为NK细胞和细胞毒性T细胞功能降低,不能及时有效低清除病毒或其他抗原而持续刺激和活化免疫细胞,导致淋巴细胞和组织细胞增殖病释放大量多种细胞因子,引起炎症因子风暴,导致多器官高炎症反应和组织损伤。由于HPS临床表现错综复杂,缺乏特异性,易漏诊和误诊,且病情进展凶险,若不能及时进行合理有效的治疗,死亡率极高,故重视对HPS的认识、提高对HPS的诊疗水平尤为重要。所以检验人员只有积极学习临床知识,提高与临床的沟通能力,才能提高诊疗水平,更好地服务好临床和患者。
参考文献
滕飞鹏, 王春森, 李玉芹, 等. 实用血细胞形态学与病例分析 [M]. 成都: 四川科学技术版社, 2015: 95-97.
王琰, 贾宏超, 吕涛. 血液病学基础与临床 [M]. 长春: 吉林科学技术出版社, 2014342-346: 252.
赵鸿, 霍娜, 李俊. 感染相关噬血细胞综合征的诊治现状 [J]. 临床血液学杂志, 2023, 46(1): 5-8.
中国妇幼保健协会临床诊断与实验医学分会. SAA单独和与CRP联合检测在儿童感染性疾病中的应用专家共识 [J]. 检验医学, 2021(36)7: 685-690.
王霄霞, 愈康. 血液系统疾病的检验诊断 (第二版) [M]. 北京: 人民卫生出版社, 2015: 465-469.
高海霞, 刘亚波, 吕成芳, 等. 血液病临床检验诊断 [M]. 北京: 中国医药科技出版社, 2021: 252.




