葡萄球菌小菌落突变株表型的检测与鉴定及临床诊断特征
【摘要】虽然现代分子方法加快和改进了微生物诊断,但表型变异仍然对其检测、鉴定和表征提出了挑战。这尤其适用于不稳定且难以检测的情况,葡萄球菌形成的小菌落突变株(或小菌落变异体,SCV)表型就是这种情况。在固体琼脂培养基上,葡萄球菌SCV的特征是具有异常菌落形态的微小菌落,它们对细胞内生活方式的适应导致了生长速度降低和基本代谢的改变,通常导致特定的营养缺陷型,例如甲萘醌、血红素或胸腺嘧啶脱氧核苷(胸苷)营养缺陷型。这些改变使SCV难以识别,并使生理、生化和其他基于生长的方法(如抗微生物药物敏感性试验,AST)不可靠或不可用,因此,诊断程序需要延长孵育时间,并在可能的情况下通过分子方法进行确认。营养缺陷型检测需要一种特殊的方法,然而,目前缺乏SCV诊断的标准化方案。如果可用,应对SCV及其预测的亲本分离株进行基因分型以确定克隆性。由于SCV的检测对感染(通常为慢性和复发性感染)的治疗有重大影响,因此应与微生物实验室和相关临床医生密切合作,对SCV检测结果进行专门报告、评论和管理。
【关键词】小菌落突变株;金黄色葡萄球菌;凝固酶阴性葡萄球菌;营养缺陷型;慢性感染
葡萄球菌和其他微生物能够形成一种独特的表型,称为小菌落突变株(SCV)表型。 大多数关于SCV的病例报告、临床研究以及体外研究都涉及金黄色葡萄球菌;然而,从临床样本中也发现了属于其他葡萄球菌的SCV,包括头状葡萄球菌(S. capitis)、表皮葡萄球菌(S. epidermidis)、路邓葡萄球菌(S. lugdunensis)等。正如“小菌落”的名称所暗示的,即使在长时间孵育后,固体琼脂培养基上的SCV菌落与正常(野生)型相比也非常小。SCV的延迟生长是基于微生物适应细胞内生活方式过程中代谢的变化,以隐藏在宿主细胞中,这似乎是感染过程的一个动态组成部分。在“非专业”吞噬细胞(如上皮细胞、内皮细胞、成纤维细胞、角质形成细胞和成骨细胞)内存活是葡萄球菌SCV的一个关键特征。虽然SCV的诊断相关表型特征似乎相当一致,但导致表型表达的潜在机制非常多样,例如,电子传递链或胸苷和脂肪酸代谢的改变和动态调节过程,由此产生的代谢变化可能会影响通常用于鉴定的其他表型性状,例如生化、生理和抗原特征,此外,还阻碍了SCV的抗微生物药物敏感性试验(AST)。本综述讨论了葡萄球菌SCV表型状态对SCV的培养、鉴定、验证和AST的意义,并考虑了分析前和分析后的因素(图1)。
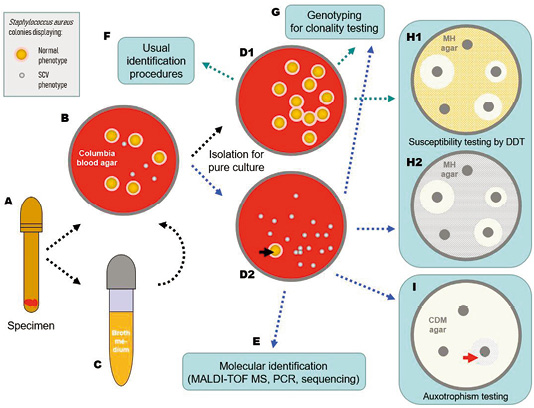
图1. 葡萄球菌SCV诊断流程图(虚线箭头,以金黄色葡萄球菌为例)
收集样本(如组织)(A)并接种到固体(B)和肉汤(C)培养基上(培养48-72h后在琼脂平板上剥离)后,应检查琼脂平板上是否存在SCV菌落形态. 在混合培养的情况下,应在固体培养基(D1、D2)上分离出显示正常表型(NP具有淡黄色色素菌落,周围有溶血环)和SCV表型(无色素沉着和溶血的菌落)的菌落,在整个诊断过程中,应注意SCV表型自发地逆转为NP(黑色箭头,D2)。NP菌落(D1)应用常规诊断程序(F),而SCV菌落(D2)应通过相应的分子方法进行鉴定(E)。两种类型的菌落都应进一步处理,以进行抗微生物药物敏感性试验(H1、H2),如纸片扩散试验(DDT),优点是可以揭示可能的逆转,并用基因分型(G)以检测不同表型的克隆性。如有可能,还应在限定化学成分培养基(CDM)琼脂平板(I)上确定SCV的营养缺陷,该平板上补充了SCV生长可能特定依赖的物质。特异性营养缺陷型表现为围绕相应圆盘的生长区(红色箭头),所有用于SCV培养的培养基应孵育48-72h。
一、为什么应该在适当的时候专门寻找葡萄球菌SCV?
第一个是由于SCV具有特定的临床意义,它们通常与慢性和复发性感染相关,因为它们通常难以治疗,所以经常会造成患者很长的痛苦历史,从几个月到几年不等;其次,由于它们在细胞内持久存在,因此可以免受(1)免疫防御机制和(2)无法穿透宿主细胞的抗生素的侵害。此外,SCV表型本身可能影响抗生素的敏感性,因此,常规的抗生素治疗可能会失效,而需要特定的抗生素方案,例如,加入利福平作为细胞内活性药物和延长治疗时间。相反,一些抗生素或其他药物也可能诱导或触发表型转换为SCV,如临床报道的在氨基糖苷类和三氯生的诱导下进行了实验,然而,关于SCV在不同类型感染中的最佳治疗方案仍缺乏系统研究;第三个原因是SCV在常规微生物诊断中很难检测到(如下文所述),因此,其真实频率和临床意义可能仍未得到充分报道。
二、在诊断中何时应特别考虑葡萄球菌SCV?
虽然尚未报道过在金黄色葡萄球菌和其他葡萄球菌引起的急性感染过程中出现SCV,但SCV通常与持续性和复发性感染患者有关,令人沮丧的病程通常持续数月至数年。关于临床样本中分离SCV的大多数研究和病例报告包括异物相关感染、皮肤和软组织感染、糖尿病足溃疡、骨髓炎和关节感染。因此,当此类病例出现慢性、复发和/或治疗无效的病程时,特别建议检测SCV。如上所述,长期暴露于氨基糖苷类药物(如用于治疗骨髓炎的庆大霉素珠)也可诱导体内SCV的形成,因此应将其纳入检测SCV决定。持续性的金黄色葡萄球菌SCV在囊性纤维化(CF)患者中非常普遍,而CF是高加索人群中最常见的遗传性疾病之一。这种常染色体隐性遗传病的特点是粘液层高度粘稠,从而影响粘液纤毛的清除,导致阻塞性呼吸道疾病的发生。在CF患者的呼吸道出现了一种年龄依赖性微生物感染模式,金黄色葡萄球菌是最早的病原体之一,并在以后的生活中被铜绿假单胞菌取代。在CF肺部环境中SCV表型的形成不仅限于一个或几个不同的克隆,而是发生在许多不同的克隆谱系中。在CF肺相关的金黄色葡萄球菌SCV中,大多数具有胸腺嘧啶营养缺陷的特征,为指导治疗和辅助管理,建议对金黄色葡萄球菌SCV进行常规监测。
三、在SCV检测的预分析中应该注意什么?
预分析的许多方面也缺乏对SCV的相应研究,有两个问题可能起作用:(i)SCV对细胞内生活方式的适应性;(ii)自发恢复正常表型的能力。来自临床样本自然产生的SCV 特别不稳定,并且在培养过程中经常恢复到正常表型,有时在固体培养基上剥离后立即恢复。虽然临床SCV的自然回复突变也可能保留SCV表型的主要蛋白质特征,但肉眼可见琼脂平板上出现的经典菌落形态。病原体在受感染组织中分布不均,因此对SCV尤为重要的是,如果可能应在疑似感染组织区域采集多个样本,以尽量减少运输损失并提高灵敏度。根据SCV表型的生理特点,需要快速将样本运送到实验室并开始培养,常用的样本运输容器即可。
四、在培养葡萄球菌SCV的过程中应该考虑什么?
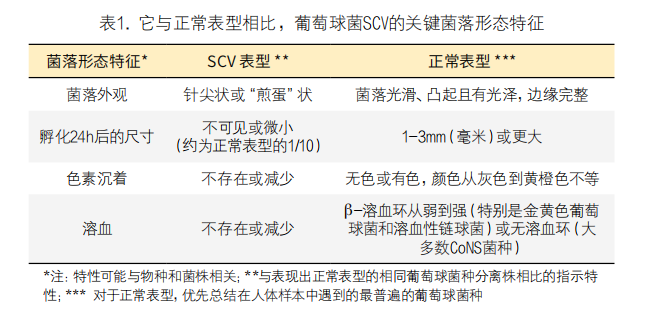
诊断的主要挑战是识别微小的菌落,并将它们视为通常以较大菌落形式生长的物种的可能代表,这对金黄色葡萄球菌尤为重要。金黄色葡萄球菌SCV被误解为共生链球菌或棒状杆菌,并且不进一步处理的情况并不少见,因为SCV菌落不溶血且无色素沉着(见图1),表1列出了葡萄球菌SCV的其他特征。也有报道同时存在不同的、克隆相同的SCV形态类型,它们的色素沉着和/或溶血的程度不同,并且是从同一患者的相同或不同样本中分离。
SCV的生长要求非常苛刻,正常的葡萄球菌表型的特征是中等大小的菌落,其直径在24h内可达1-3mm,而SCV菌落的最大尺寸为针尖大小,约为亲本菌株大小的1/10(图2)。通常经过“过夜”孵育后根本找不到菌落,需要2-3d才能看到第一批菌落,在混合菌群的情况下,特别是在富集培养中,这意味着它们也可能很快长满。
显示正常金黄色葡萄球菌表型的典型形状,其周围是一个大的溶血环(实线箭头),金黄色葡萄球菌SCV表型的典型形状是微小的、非溶血的、无色素的菌落(虚线箭头)(见图2)。
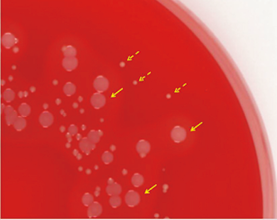
图2. 哥伦比亚血琼脂平板(含5%羊血)培养24h后的金黄色葡萄球菌
SCV在临床样本中缺失的另一个原因是这种表型的不稳定性,这意味着,在自然产生SCV的情况下,亚群可能会自发恢复到正常表型并可能使SCV过度生长。虽然这种现象在固体琼脂培养基上用肉眼相对容易识别,但在肉汤培养基中很难识别表型转换。不稳定的SCV表型导致体外产生具有稳定SCV表型的基因敲除突变体,以研究其代谢、毒力、抗性发展和其他特征。然而,这些突变仅部分反映了临床SCV的特征。相反,临床SCV的自然回复突变被证明保留了临床SCV表型的优势蛋白特征,这可能会影响用于诊断目的的生化检测。哥伦比亚血琼脂平板在常规诊断中用于培养葡萄球菌,包括SCV,然而,这些和其他常规使用的复杂培养基含有它们特别依赖的物质(营养缺陷型),如甲萘醌、血红素或胸苷,即使是微量的这些物质也可能导致恢复正常表型。然而,所需的限定化学成分培养基(CDM)尚未在市场上销售,而且本身生产起来非常费力。显色琼脂培养基或其他选择性培养基(如甘露醇盐琼脂)可能会失败,或者不会产生预期的有色菌落表型,研究中,SCV的生长通常在使用这些培养基孵育72h后才能检测到。总结与培养相关的方面,如果要将SCV纳入诊断策略,建议必须孵育至少2-3d,至少每天借助放大设备进行一次琼脂平板的检查。这些方面对微生物诊断领域刚刚实现和未来的技术发展提出了特殊的挑战。特别是自动化实验室系统必须进行编程,使其能够对琼脂平板进行较长时间的孵育,并且基于人工智能的系统必须对不同的SCV形态做出响应。
五、如何确定SCV的种类?
Kloos和Schleifer提出的用于鉴定人葡萄球菌种类的关键生化/生理特征的经典方案,以及随后开发的所有基于分离株生化特征的半自动测试系统,都被认为对于临床SCV的种类鉴定来说不可靠(表2),因为SCV生长缓慢和代谢变化,常规的生化反应严重延迟或缺失。
目前尚未有关于使用基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱(MS)鉴定葡萄球菌SCV的系统研究,但如果有足够的SCV生物量,这种方法可用于常规用途(作者自己的经验)。这可以解释为用于诊断的MS设备的光谱生成所必需的核糖体蛋白在SCV中也占主导地位。一篇日语论文表明,对于胸苷依赖型SCV,直接转移甲酸MS样本制备法和乙醇甲酸法均能产生相同的结果。一些关于非葡萄球菌SCV的病例报告也表明MALDI-TOF MS方法的适用性。由于荧光原位杂交(FISH)方法已结束实验阶段,这种方法可能是未来检测SCV感染宿主组织的有前景的工具。使用荧光标记的金黄色葡萄球菌特异性寡核苷酸探针进行16S rRNA定向原位杂交技术,检测由金黄色葡萄球菌SCV引起的脑脓肿患者的组织样本,已经证明了这种方法的普遍适用性。根据细菌载量,原则上,针对相应靶基因的所有基于核酸的方法都能够直接检测组织中葡萄球菌SCV感染或鉴定SCV菌落。然而,使用标准检测无法区分这两种表型(有关识别SCV形成诱导突变的信息,请参见下文)。目前尚未描述表型检测分子方法,但可以设想,如基于逆转录聚合酶链反应(RT-PCR)。然而,SCV表型及其潜在机制的多样性使得很难找到一种通用方法或覆盖所有变体。基于核酸的分子方法,特别是测序方法,是验证SCV分离株种类的终极工具。在一项包括葡萄球菌SCV的16S rRNA部分测序研究中,测序方法能够在物种水平上准确识别它们,而两种表型方法(API ID 32 Staph和VITEK 2)错误识别了SCV。其他通用或特定靶基因已被证明足以区分葡萄球菌的也可用于SCV的物种鉴定。
六、如何客观和表征SCV表型?
这表现出SCV表型的细菌细胞通常无法合成其生长所需的有机化合物,即其营养缺陷型,最好通过使用表面干燥(无冷凝水)CDM琼脂和空白抗微生物药敏纸片,并补充有一系列已知葡萄球菌营养缺陷型菌最常需要的物质,如血红素、甲萘醌和胸苷(图3)。如果测试结果为阴性,也可以考虑其他物质,例如油衍生物和脂肪酸(油酸、吐温80、聚乙二醇等)。值得测试不同浓度的相应物质,为了检测CO2依赖SCV,可以在有和没有5% CO2补充剂的情况下对板进行有氧孵育,然而,不可能在所有情况下都确定潜在的营养缺陷型。
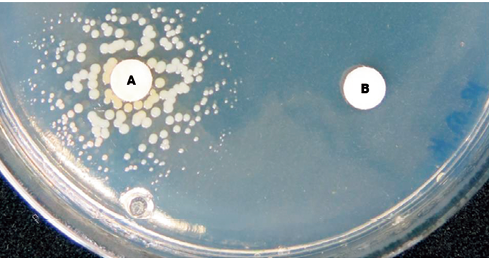
图3. 将金黄色葡萄球菌SCV与含有SCV生长特异依赖物质(A,B)的培养皿孵育48h后,用琼脂平板检测SCV的营养缺陷型。将SCV悬浮液划线在整个琼脂表面,物质A导致SCV在左侧的扩散区生长,并部分重建正常表型(注意大小和色素沉着),但在含物质B的右侧没有观察到生长
为了全面、客观地表征微生物表型,基于分子结构的表型分析方法将是理想的方法。傅立叶变换红外光谱(FT-IR)是一种非破坏性技术,可满足这些要求,并可快速表征生物分子以及宿主细胞、微生物等更复杂材料的结构特征。对于葡萄球菌SCV,FT-IR已被证明是一种实时读数工具,可用于在液体培养条件下区分不同的葡萄球菌表型。值得注意的是,不同遗传背景的SCV之间的FT-IR比其相应亲本菌株的光谱更相似,进一步突显了蛋白质组学和代谢组学研究揭示的两种表型之间的显著差异。由于FT-IR越来越多地用于医院卫生和流行病学目的的菌株分型,在这种情况下应该注意的是,尽管表型变异株与相应的野生型分离株具有相同的遗传背景,但可能会被错误分类。为了寻找不同营养缺陷型、自然发生SCV类型的遗传基础和构建显示SCV表型的稳定遗传突变体产生的SCV,已经鉴定出几个在甲萘醌、血红素和胸苷途径内发生突变的基因位点,包括menB、menD、hemA、hemB、hemG、hemH、cta和thyA。此外,已经描述了诱导SCV形成的其他几种营养缺陷型和依赖型(例如,脂肪酸和CO2)和机制(如,非蛋白质编码RNA、氧化和严格的应激反应)。过去需要花费大量的时间和精力来寻找和确定这些潜在的改变,而最近的下一代全基因组测序(WGS)工具可能会大大加快这一过程,并使其在未来用于诊断基于突变的SCV形成时更加现实。当分离出不同表型(正常和一个或多个SCV表型)时,建议对不同表型进行基因分型,以评估其克隆性。使用WGS,例如作为全基因组多位点序列分型(wgMLST),还有一个优势,即如果有亲本分离株,则可以确定基因型并对其进行比较。不过,传统的基于测序的基因分型技术,如使用管家基因的多位点序列分型(MLST)和spa分型(仅适用于金黄色葡萄球菌SCV)也同样适用。它们已经取代了更费力且更难分析的技术,例如基于条带模式的脉冲场凝胶电泳(PFGE),这些技术在前几十年的SCV研究中使用。
七、是否需要单独检测SCV以确定抗性?如何进行?
首先,有必要强调SCV的一个特殊特征:它们位于细胞内,可以抵御所有无法穿透宿主细胞膜的抗生素的作用以及这一现象所产生的治疗影响。虽然这一点不属于常规AST的范畴,但应作为实验室检查结果的一部分以提醒主治医生,由于这种类型的功能耐药,在体外测试敏感的药物可能对SCV无效。虽然SCV及其相应的正常表型在大多数抗生素的AST中显示出相似的分类,但表型转换后代谢的改变可能导致对不同抗生素(包括抗叶酸药物和氨基糖苷类药物)的敏感性发生规律性变化。细胞壁活性抗生素在SCV中的活性可能会降低,这可能是由于其生长速度低和细胞分裂减少所致。除了已知的代谢变化及其影响外,SCV分离株可能比其亲本株具有更低的耐药性。然而,基于酸性pH和液泡中氧化剂相互作用的细胞培养模型显示,细胞内的SCV对β-内酰胺类药物高度敏感。因此,应考虑SCV对抗生素敏感性和耐药性的改变,因此有必要对从临床样本中分离的SCV分离株进行单独的药物敏感性测定。遗憾的是,通常受时间和密度影响的基于培养的AST方法受到SCV表型的不同生理学的影响,尤其是受生长速率延迟的影响。目前,尚无人工检测或(半)自动化检测程序的标准化方案。核酸扩增试验(例如分子甲氧西林耐药性检测)相对容易实施。PCR或等温扩增方法还需要大幅增加菌落数量(或测量DNA浓度以进行精确的测试调整),使用抗PBP2a玻片乳胶凝集试验所需的菌落数也是如此。基于培养的常规AST方法是针对快速生长的细菌开发的,因此很难或无法对SCV进行检测和解释。SCV可通过琼脂扩散法或梯度测试(Etests)等基于琼脂的技术进行检测。与通常的程序不同,SCV应在琼脂平板上培养数天,直到它们清晰可见,用CO2孵育可能是有益的。然而,琼脂平板的读数往往具有挑战性,结果也往往模糊不清,基于肉汤的方法可能会造成表型自发恢复到正常表型而被忽视的风险。未来,宿主细胞(如单核细胞和非专业吞噬细胞)中SCV的细胞内AST可能成为一种更好地反映体内状况的替代方法,并且已经开发出有前景的细胞培养模型。
八、应如何报告、评论和管理SCV?
除了CF患者的呼吸道样本,SCV在常规微生物诊断中很少被报道,因此,临床医生通常很少知道或不知道。因此,不应在没有进一步评论的情况下报告SCV的鉴定和相应的AST结果。最好再次致电主治医生,以避免忽略或误解这一特殊发现,应避免这种情况,因为如上所述,由于SCV的特定特征和细胞内位置,检测SCV可能导致特定的治疗后果。因此,对于SCV发现,给临床医生的评论应包括以下陈述:(i)其本质是使葡萄球菌成为细胞内病原体的表型;(ii)其与慢性和复发性感染的典型关联;(iii)进行的非标准化抗生素检测和SCV功能性耐药的影响以及(iv)可能出现的感染处理偏差。最后,慢性和复发性感染、难以检测和治疗的局限性这些灾难性因素结合在一起,需要临床医生、微生物学家和其他学科(如药剂师和病理学家)采取协调一致的方法,成功治疗SCV相关感染。正如其他文章所建议的,由抗菌药物感染预防和诊断管理组成的综合管理模式可以满足这些要求。
编译节选自:《Antibiotics (basel)》. 2023 Sep; 12(9): 1446.




