高灵敏度流式细胞术在常规实验室环境中对免疫细胞分析的验证与评价
【摘要】由于担心结果的可靠性和可重复性,高灵敏度流式细胞术(HSFC)在常规实验室环境中的应用一直进展缓慢。验证是进行检测的必要前提,而CLSI指南的实施却令人困惑,这主要是因为许多方面尚未确立。我们的目的是在真实的实验室环境中验证HSFC检测滤泡辅助性T(Tfh)细胞的方案。根据CLSI H62指南,通过严格的测试(包括精密度、稳定性、携带污染和灵敏度的评估)确保Tfh细胞panel(组合)的分析有效性。我们发现,通过HSFC可以充分检测血液中数量极少的Tfh细胞,通过系统验证可以解决真实实验室检测结果的可靠性和可重复性的顾虑。确定定量下限(LLOQ)是HSFC评估的关键步骤。通过选择合适的样本,例如,在我们的实验中收集CD4分离的剩余细胞并将其用作低水平样本,可以准确地建立LLOQ。即使资源有限,流式细胞仪panel的战略性验证也可以促进HSFC在临床实验室的应用。
【关键词】高灵敏度流式细胞术;CLSI H26;滤泡辅助性T细胞
高灵敏度流式细胞术(HSFC)已成为生物医学研究中的重要工具,因为它可以检测罕见事件并量化细胞群的微小变化,HSFC可以测量占总细胞群不到0.1%的细胞群。尽管具有优势,但在常规实验室环境中应用HSFC一直进展缓慢,部分原因是对结果的可靠性和可重复性的担忧。然而,HSFC的使用越来越多,这凸显了标准化验证方法的必要性。鉴于实验室开发的检测方法通常用于流式细胞术,CLSI H62似乎与最近对这些检测方法的监管变化相一致。尽管验证是进行检测的前提,但在临床实验室中实施CLSI指南却令人困惑,主要是因为许多方面尚未确立。此外,由于临床实验室的人员和资源有限,要想满足CLSI指南提出的所有条件,就必须制定切实可行的基本项目指南。本文报告了在真实实验室环境中验证验证HSFC检测滤泡辅助性T(Tfh)细胞的经验。
Tfh细胞是辅助性T细胞的一个独特亚群,通过调节生发中心B细胞分化信号对免疫调节、癌症发生起着重要作用。血液中Tfh细胞的百分比取决于不同的因素,例如年龄、健康状况和免疫反应,在健康成人中,Tfh细胞通常约占循环CD4+ T细胞的1%-3%。根据真实实验室环境所需的最低类别对Tfh细胞panel进行了验证。根据CLSI H62指南和以前的文献,通过严格的测试确保了Tfh细胞panel的分析有效性,包括精确度、稳定性、携带污染和灵敏度的评估。该研究于2021年12月7日至2022年1月20日进行。为了排除基质效应,使用在峨山医疗中心进行全血细胞计数后获得的剩余外周血(PB)样验证本(N=17)进行验证研究(韩国首尔)。
鉴于PB样本中Tfh细胞的稀少和不稳定性,我们通过将每份PB样本与TransFix(UK)混合来稳定和固定这些细胞。为了提高检测样本中Tfh细胞的比例,检测前使用EasySep Isolation Kit(Canada)分离CD4+ T细胞。我们选择的用于分析Tfh细胞及其亚型的多色试剂组合是基于之前的研究,包括以下抗体(均来自BD Biosciences):抗CD45-RA BV510、抗CD3-APC-H7、抗CD4-BV421、抗CXCR5-PerCP -Cy5.5、抗CCR6-PE、抗CXCR3-FITC、抗PD-1-PE-CF594和抗ICOS-Alexa Fluor 647。Tfh细胞定义为CD3+/CD4+/CXCR5+细胞,Tfh亚型根据CCR6和CXCR3表达模式进行分类:1型滤泡辅助性T细胞(Tfh1;CXCR3+/CCR6-)、2型滤泡辅助性T细胞(Tfh2;CXCR3-/CCR6-)和Tfh17(CXCR3-/CCR6+)。验证研究的主要焦点是Tfh细胞,而不是它们的亚型。在每次分析运行之前,制备同型对照,并用抗CD45-RA BV510、CD3-APC-H7、CD4-BV421、CXCR5 IgG-PerCP-Cy5.5、CCR6 IgG-PE和CXCR3 IgG-FITC抗体进行染色。Tfh细胞计数使用Navios流式细胞仪(USA),总细胞的最小计数设置为105,Tfh细胞频率的期望CV为10%。Tfh群由实验室技术人员和医疗主管根据预定义的门控策略手动门控(见图1),并对结果进行一致性比较。该研究方案得到了峨山医疗中心机构审查委员会的批准。
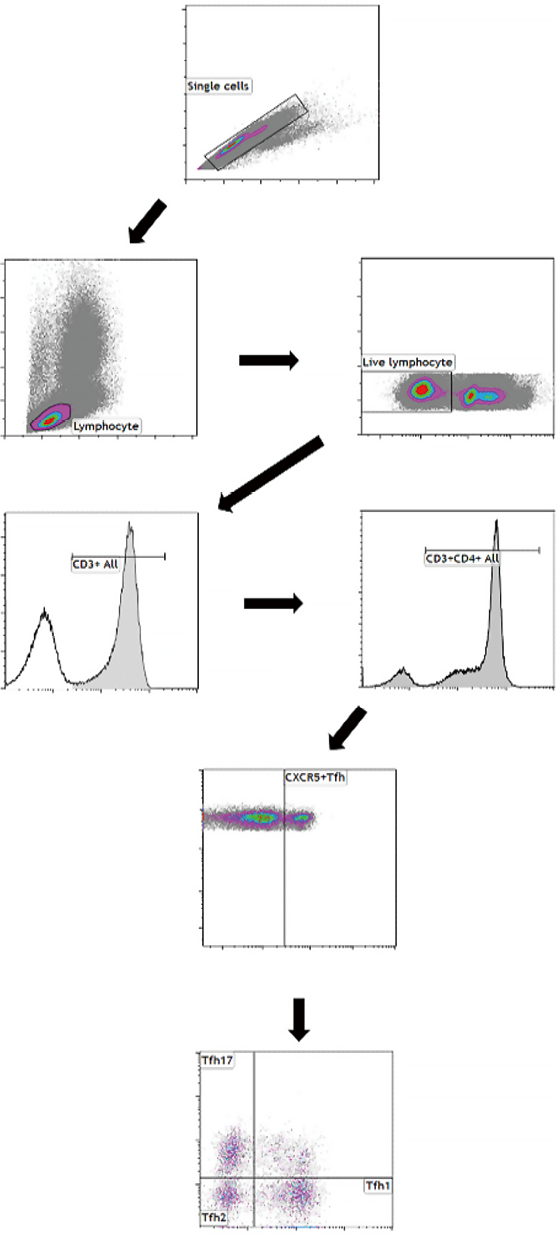
图1. Tfh细胞及其亚型的门控策略
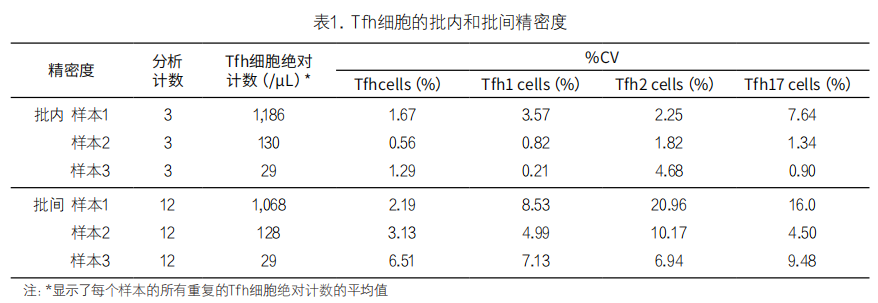
采用两种方法评价精密度:批内精密度和批间精密度。批内精密度通过在一次运行中测量每个样本的3个重复来确定,而批间精密度通过在4次不同运行中测量每个样本的3个重复来确定。Tfh检测法是为研究目的设计的,可以用至少3个样本进行验证。但对于患者检测,由于低水平样本的预期变异性较高,因此至少需要6个样本才能进行精密度验证。批内精密度表示为每个样本的可报告结果的%CV,而批间精密度表示为每个样本的所有结果的平均%CV。关于可接受的精密度标准,CV值应在10%以内,范围在25%以内均可接受。不过,根据CLSI H62,检测罕见细胞事件时,CV范围在30%-35%之间也是可以接受的,因此,我们采用了30%-35% CV的可接受精密度范围。关于批内精密度,Tfh细胞及其亚型的所有%CV均小于10%。尽管Tfh亚型的某些%CV高于10%,但大多数Tfh结果显示出较高的批间精密度(见表1)。
对样本稳定性进行评估,以评价TransFix(Cytomark Ltd.)混合和样本延迟时间的影响。一名患者的样本被分为两组:一组与TransFix混合,另一组不进行处理,两者都是基于CD4分离制备的。样本在室温(20-22℃)下保存,并在制备后的五个时间点(0、4、24、28和48h)进行分析。在每个时间点计算总淋巴细胞(包括Tfh细胞及其亚型)的比例,计算每个时间点的结果与细胞处理后立即获得的基线结果之间的相对差异。相对差异小于20%表示样本稳定。对未处理样本稳定性的分析表明,4h后Tfh亚型的相对差异有显著变化。然而,无论是否混合TransFix,Tfh细胞在48h内都保持稳定。正如我们实验室所进行的那样,样本采集后立即进行检测的做法可以减少稳定性问题,然而,如果发生延误,应确认至少3个样本的稳定性,包括评估储存/运输过程中标记物或细胞子集的变化,以考虑潜在的损失或改变。
为了验证携带污染,高水平Tfh样本(样本A)取自患有自身免疫性疾病的患者,而低水平Tfh样本(样本B)取自在体检期间未接受CXCR5染色的健康个体。按以下顺序交替分析样本3次:A1、B1、A2、B2、A3和B3。使用公式(1)计算:
携带污染(%)=([B1-B3])/([A3-B3])×100(1)
每个样本Tfh测量值在各重复间一致,使用公式(1)评估携带污染,确定为-0.017%,未观察到残留。
通过评价空白限(LOB)、检测限(LOD)、定量下限(LLOQ)和线性等关键参数评价该方法的灵敏度。 LOB和LOD根据使用同型对照获得的结果进行验证。由于同型对照未用CXCR5染色,因此它可以用作荧光减一对照,分析了所有验证的10个结果。LOB的计算方法为均值+1.645 SD,而LOD的计算方法为LOB+1.645 SD低水平样本。检测低水平的Tfh细胞可能具有挑战性,因为即使是健康的个体也可能表现出不同水平的Tfh细胞,这取决于其生理状态。为了解决这一问题,我们使用CD4分离后的剩余细胞(去除Tfh细胞)作为低水平样本。将CD4分离样本与低水平样本混合,并连续稀释2倍,为每种样本创建5个水平。每个浓度水平均以一式三份进行分析,并计算出浓度值高于LOD重复的平均值、SD和%CV。以最低水平的平均值计算LLOQ。用最能代表检测性能的LLOQ数据来评估线性。由于本研究使用的半定量方法不适合正式的线性验证,线性回归后使用R2计算进行线性评估。经计算,LOB为0.03%,LOD为0.05%。LLOQ确定为Tfh细胞的相对百分比(0.11%)。线性关系的R2值为0.9970,表明线性关系非常好(图2)。
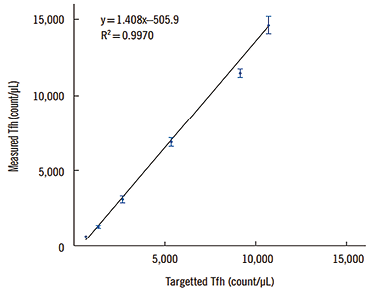
图2. 不同系列稀释样品的滤泡辅助性T细胞测量范围的线性
本研究证实了HSFC在血液样本中检测Tfh细胞的能力,即使Tfh细胞数量非常少。研究有一些局限性,由于我们的目的是在有限的实验室资源下提出在真实环境中可行的HSFC验证计划,因此进行了有限的测试。在资源有限的真实实验室环境中,采用系统验证方法,以最少的样本量评估必要的验证项目,可有效解决结果可靠性和可重复性的问题。建立LLOQ是评价HSFC的关键步骤,选择合适的样本,如收集CD4分离的剩余细胞作为低水平样本,可以准确、精确地确定LLOQ。总之,即使在资源有限的情况下,实施一种验证流式细胞术检测组合的方法也可以加快临床实验室采用HSFC。
编译节选自: Ann Lab Med, 2023 Jun 30; 43(6): 620-624




