系统性血管炎相关自身抗体谱实验室检测与临床应用面临的挑战

李永哲,研究员、教授、博士/博士后研究生导师。现任中国医学科学院北京协和医院检验科副主任,主要从事自身免疫性疾病发病机制及实验诊断技术临床应用等研究工作,对国内自身免疫病实验诊断新技术临床应用、推广普及及规范检测作出贡献。在国内率先将多项新自身抗体应用于临床;在全国开展针对自身抗体等风湿免疫病实验诊断技术的检测方法、质量保证、临床意义和临床应用等的“风湿免疫病实验诊断技术全国培训项目”系列巡讲百场。以课题负责人承担国家自然科学基金项目8项、国家重点研发计划重点专项1项、首都卫生发展科研专项重点攻关项目1项、北京科委项目1项。获发明专利15项。以第一作者或通讯作者发表SCI 论文120余篇(总IF>500分,单篇最高IF 70分),中文核心期刊100 余篇。以第一完成人获中华医学会中华医学科技奖、北京市科学技术奖、中国医疗保健促进会华夏医学科技奖等奖励。现任中国医师协会检验医师分会常委、中国免疫学会临床免疫分会常委、中华医学会检验分会委员、中华检验医学杂志等多种核心期刊编委等。

吴子燕,中国医学科学院北京协和医院检验科,医学博士,师从李永哲教授。近年来一直在从事自身免疫性疾病的发病机制及实验室诊断等研究工作。主持一项国家自然科学青年基金(81801631)。近年来,以第一作者或共同第一作者发表SCI 论著19篇。
系统性血管炎是一组原因不明的,以非感染性炎症和坏死性血管炎为基本病理改变的结缔组织疾病。目前临床常规中广泛应用的系统性血管炎相关自身抗体谱,主要包括ANCA谱,抗内皮细胞抗体,抗GBM抗体等。实验室检查、其他诊断试验和活检在ANCA相关血管炎(ANCA associated vasculitis,AAV)诊断中的价值因具体临床情况而异。抗PR3抗体及抗MPO抗体是2022年ACR/EULAR新的AAV分类诊断标准之一,对不同AAV的诊断价值各异。2017年,学界重新更新了ANCA检测国际共识。目前对于需要检测ANCA的目标人群—AAV患者,尤其是GPA和MPA患者,首先可以通过特异性的ELISA法或化学发光法检测抗PR3抗体、抗MPO抗体;如有需要,方使用通过另一种检测方法检测相关的自身抗体。后续的EGPA中ANCA检测共识指出,当患者怀疑为EGPA时,ANCA检测策略和2017年共识相同。2020年ANCA在非系统性血管炎中应用共识指出:对于高度怀疑的AAV患者、抗GBM病、特发性间质性肺病、感染性心内膜炎合并肾脏受累者,需要使用特异性的ELISA法或化学发光法检测抗PR3抗体、抗MPO抗体。除了前述几种疾病者,专家并不推荐将ANCA谱作为常规检测项目。目前学界对ANCA的滴度变化是否可以预测病情活动程度的变化一直存在争议。专家们普遍认为只有合并临床表现的ANCA滴度变化才是具有实际意义。一些研究也报道了一些新的自身抗体,但是目前这些新的自身抗体都处于科研阶段,未来需要更多的大样本的多中心研究来进一步验证新的自身抗体的诊断及预测价值。
一、系统性血管炎概述
系统性血管炎是一组原因不明的,以非感染性炎症和坏死性血管炎为基本病理改变的结缔组织疾病,在临床上常表现为乏力、皮肤损害、关节炎,多系统侵犯和多脏器功能衰竭。系统性血管炎的发病并不少见,在西方其发病率高于系统性红斑狼疮(systemic lupus erythematosus,SLE),与类风湿关节炎(rheumatoid arthritis,RA)相近。其在我国发病率也不低,但尚无大规模的流行病学调查。其临床表现因受累血管的类型、大小、部位及病理特点不同而不同。根据受累血管不同,其可分为累及大血管的大动脉炎、巨细胞动脉炎等;累及中等血管的结节性多动脉炎等;累及小血管的ANCA相关血管炎等;累及非特异性血管的白塞病等[1]。ANCA相关血管炎(ANCA associated vasculitis,AAV)是一组以血清中能够检测到自身抗体--抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody, ANCA)为突出特点的系统性小血管炎,主要累及小血管,但也可有中等大小动脉受累,是临床上最常见的一类系统性小血管炎。经典的AAV包括肉芽肿性多血管炎(granulomatosis with polyangitis, GPA)、显微镜下多血管炎(microscopic polyangitis,MPA)和嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangitis,EGPA)。虽然GPA、MPA、EGPA都被称为AAV,但这三种AAV在临床表现和发病机制上存在一定差异,其中GPA和MPA在发病机制、临床表现和治疗上的相似度较高,与EGPA存在一定差别[2]。
二、系统性血管炎相关自身抗体谱
系统性血管炎相关自身抗体谱主要包括ANCA,抗内皮细胞抗体,抗GBM抗体等。目前,系统性血管炎中只有AAV有诊断特异性的自身抗体,故本文将重点阐述AAV中的相关自身抗体谱的临床应用。
1. ANCA:ANCA是一组针对中性粒细胞和单核细胞许多胞浆成分抗原所产生的自身抗体,其靶抗原实际为胞浆中的颗粒蛋白酶,主要位于中性粒细胞胞浆的嗜天青颗粒和单核细胞胞浆的溶菌酶中,少部分位于中性粒细胞胞浆的特异性颗粒、胞质和核质中[3-5]。目前为止,已有十余种中性粒细胞胞浆成分被证实为ANCA的靶抗原。1982年,Davies等在8例节段性坏死性肾小球肾炎患者血清中首次发现了ANCA[6]。1985年,Van der Wouder等首先报告GPA患者血清中存在ANCA,并认为其对GPA诊断具有特异性,且同疾病活动性密切相关[7]。间接免疫荧光法(indirect immunoflurescence,IIF)是检测ANCA最早使用的方法,应用乙醇固定的中性粒细胞制备的抗原底物片,主要表现为两种阳性荧光染色型:胞浆型ANCA(cytoplasmic ANCA,cANCA),其靶抗原主要是蛋白酶3(proteinase 3,PR3);核周型ANCA(perinuclear ANCA,pANCA),其靶抗原主要是髓过氧化物酶(myeloperoxidase,MPO)。ELISA法、化学发光法、多重免疫微珠法、液相芯片法等可检测特异性的ANCA。其靶抗原主要包括:抗PR3抗体、抗MPO抗体、抗弹性蛋白酶抗体、抗组织蛋白酶G抗体、抗溶菌酶抗体、抗乳铁蛋白抗体、抗杀菌性通透性增高蛋白抗体。常规检测中,亦可出现非典型ANCA(xANCA),目前该种核型的临床意义尚不清晰。
PR3于1989年被Goldschmeding R等证实为cANCA的主要靶抗原,约占cANCA的80-90%[8]。PR3是由228个氨基酸多肽构成的弱阳离子蛋白,属胰蛋白酶族中的丝氨酸蛋白酶。其在AAV的发病中可能起重要作用。抗PR3抗体在临床上与GPA密切相关。其是GPA的较为敏感和特异的指标,大约2/3的GPA患者在疾病早期就出现了抗PR3抗体,95%以上的疾病活跃期患者可检测出抗PR3抗体;抗PR3抗体也可见于MPA或EGPA患者(阳性率5%-20%)、SLE、系统性硬化症及一些感染性疾病患者,如结核病、麻风病等[9, 10]。1988年,Falk等报告MPO为pANCA的主要靶抗原[11]。MPO为细胞毒过程中产生毒性氧自由基的主要酶,在中性粒细胞的氧爆炸或产生超氧阴离子的过程中发挥重要作用,并因此可作为抗生素杀死吞噬的微生物。抗MPO抗体主要与MPA、EGPA、坏死性新月体性肾小球肾炎等相关。抗MPO抗体还可见于其他一些疾病,如抗肾小球基底膜疾病、GPA、SLE、RA和Felty综合征等[12, 13]。其他五种靶抗原,主要见于溃疡性结肠炎和克罗恩病等疾病。但其阳性率较低,特异性较差,目前并未在临床实验室广泛开展和应用[14]。
2. 抗内皮细胞抗体:抗内皮细胞抗体(anti-endothelial cell antibodies,AECA)的靶抗原位于血管内皮细胞或内皮细胞表面的一簇异质性蛋白质,不同疾病可能存在不同的分子量的靶抗原。该抗体为血管受损和血管炎的标志物,主要见于原发或继发性血管炎等疾病,尤其是系统性血管炎、SLE、皮肌炎、多发性肌炎、系统性硬化症等,且与疾病病情活动呈正相关,对疾病病情判断、诊断和治疗的监测等都具有重要的意义。AECA有IgG、IgM及IgA多种亚型,目前临床上多以检测IgG型为主。AECA有多种检测方法,采用人脐内皮细胞作为底物,可用ELISA、免疫荧光法、流式细胞仪、免疫印迹法及补体介导的细胞毒试验等检测。但是由于其诊断特异性较差,对于系统性血管炎诊治的临床意义稍逊于ANCA检测[14]。
3. 抗GBM抗体:抗肾小球基底膜(anti-glomerular basement membrane, anti-GBM)病是一种罕见的小血管炎,累及肾小球毛细血管、肺毛细血管或两者。大多数患者表现为快速进展性(新月体性)肾小球肾炎。此病常与重度肾损伤有关,如果不予治疗,会迅速进展为终末期肾病。约1/3患者体内可检测出抗GBM抗体。抗GBM抗体的主要靶点是Ⅳ型胶原α-3链 [α-3(Ⅳ)链] 的NC1结构域,α-3(Ⅳ)链是在基底膜胶原中发现的6种遗传独特性基因产物之一。动物实验已证实抗GBM抗体的致病作用。向动物注入从抗GBM病患者血浆或肾小球中洗脱的抗体,可引起动物的肾小球肾炎[15]。
4. 抗C1q抗体:低补体血症性荨麻疹性血管炎综合征(hypocomplementemic urticarial vasculitis syndrome,HUVS)是一种免疫复合物介导的罕见小血管炎。大多数HUVS患者都存在抗C1q胶原样区域的自身抗体。由于狼疮肾炎中也可检出抗C1q抗体及C1q水平降低,因此,尚未确定抗C1q抗体及C1q水平降低是否是诊断HUVS的必要条件[16]。
三、临床应用面临的挑战
1. 检测项目选择与实验诊断路径:实验室检查、其他诊断试验和活检在AAV诊断中的价值因具体临床情况而异。ANCA是支持GPA、MPA和EGPA分类和诊断的独特标记物。抗PR3抗体及抗MPO抗体是2022年美国风湿病学会(ACR)及欧洲风湿病学会(EULAR)的AAV分类标准之一,对不同AAV的诊断价值各异[17-19]。所有疑似AAV的患者均应筛选ANCA,如:肾小球肾炎,尤其是快速进展的肾小球肾炎、肺出血,尤其是肺-肾综合征、皮肤血管炎、多发性肺结节、上呼吸道慢性破坏性疾病、慢性鼻窦炎或中耳炎、声门下气管狭窄、多发性单神经炎、眼球后肿物及虹膜炎等[20]。1999年版的国际共识指出推荐的检测策略是先使用IIF法筛检ANCA,随后可使用ELISA特异性方法检测抗PR3抗体及抗MPO抗体(图1)[21]。随着抗原提纯及试剂盒生产工艺的提升,IIF法是否能作为ANCA的检测筛选方法,一直处于争议之中。2003年专家们对1999年的ANCA检测共识进行了补充,细化要求ANCA常规检测中的质控要求[22]。2017年,欧洲血管炎研究组织进行了一项大样本量的多中心的临床研究,最终研究发现高质量的特异性ANCA检测方法对GPA和MPA的诊断效能和IIF法相当,甚至更优于IIF[23]。至此,2017年,学界重新更新了ANCA检测国际共识,主要的变更之处在于,目前对于需要检测ANCA的目标人群—AAV患者,尤其是GPA和MPA患者,首先可以通过特异性的ELISA法或化学发光法检测抗PR3抗体、抗MPO抗体;如有需要,方使用通过另一种检测方法检测相关的自身抗体(图2)[20]。鉴于EGPA的罕见性,同时EGPA中ANCA阳性率较低(30-40%),2017年共识并未包括EGPA患者。2020年EGPA中ANCA检测共识指出,当患者怀疑为EGPA时,ANCA检测策略和2017年共识相同[24]。因为其他自身免疫性疾病、感染、肿瘤等也可出现ANCA阳性,故2020年国内外专家就ANCA在非系统性血管炎中的应用,亦发布了一项共识。其指出:对于高度怀疑的AAV患者(包括EGPA)、抗GBM病、特发性间质性肺病、感染性心内膜炎合并肾脏受累者,需要使用特异性的ELISA法或化学发光法检测抗PR3抗体、抗MPO抗体。除了前述几种疾病者,专家并不推荐进行常规的ANCA检测[25]。后续来自不同国家和人群的多个研究均支持2017年检测共识对于ANCA检测策略的变更,即IIF法不再作为ANCA检测的筛选方法,可使用高质量的特异性自身抗体试剂进行检测[26-29]。对于I型自身免疫性肝炎(autoimmune hepatitis,AIH)或是炎症性肠病(inflammatory bowel disease,IBD)患者,共识认为仅在此类患者未能检出经典的具有诊断价值的自身抗体时,方才检测ANCA。由于ANCA在此类疾病中的具体靶抗原尚不清晰,故共识推荐可使用IIF法进行检测[25]。抗平滑肌抗体,尤其抗F-肌动蛋白抗体与AIH关系密切,为AIH特异性自身抗体。抗可溶性肝抗原抗体,为AIH高度特异性自身抗体。另外,抗肝-肾微粒体抗体和抗肝细胞胞浆抗原1型抗体是II型AIH的标记性自身抗体。检测这四种自身抗体比ANCA对AIH诊断、分型更具有实用价值[30]。IBD包括溃疡性结肠炎和克罗恩病。抗酿酒酵母抗体、抗胰腺腺泡抗体均是克罗恩病特异性的抗体。同时,也有研究发现抗PR3抗体在溃疡性结肠炎中的阳性率高于其克罗恩病中(29.2% vs. 2.7%),差异具有统计学意义[31]。IIF法检测ANCA,从方法学上而言并不特异,其次IIF法检测ANCA始终难以标准化。该方法操作复杂,利用荧光显微镜主观判断结果,实验结果具有很强的主观性。首先,常规检测中难以排除抗核抗体的干扰,多数商业化的试剂盒都缺乏作为区分的淋巴细胞。其次,多数商业化的试剂盒也缺少嗜酸性粒细胞,根据ANCA荧光亮度与嗜酸性粒细胞的天然荧光相比较,其可帮助判断ANCA的荧光强度[32],因此ANCA阴阳性及滴度的判定极具主观性。最后,针对抗PR3抗体及抗MPO抗体均有有证参考物质,可统一溯源,以便于各个实验室检测抗PR3抗体及抗MPO抗体的标准化及规范化[33, 34]。但是IIF检测ANCA一直没有国际公认的标准化物质。因此,笔者认为使用高质量的特异性抗PR3抗体、抗MPO抗体试剂盒检测相关自身抗体,足以满足日常的临床需要,也将会是未来各个实验室检测ANCA的主流方法。
2. 是否可以反映AAV的疾病活动程度:目前学界对ANCA的滴度变化是否可以预测病情活动程度的变化一直存在争议。2012年的一项meta分析发现AAV缓解期的ANCA滴度升高对未来病情复发提示作用有限[35]。因此,ANCA对AAV病人的病情活动程度的预测价值有限。研究提示ANCA滴度变化可用于预测AAV肾脏受累程度,但对于AAV非肾脏受累的预测价值有限[36]。也有研究认为尽管ANCA滴度变化可能提示AAV患者病情变化情况,但是专家们普遍认为只有合并临床表现的ANCA滴度变化才是具有实际意义的[14]。
四、新的自身抗体概述
抗人溶酶体相关膜蛋白2(anti-lysosomal-associated membrane protein-2,anti-LAMP-2)抗体在初治的三个中心的AAV病人中检出率为89%、91%、80%,而且和疾病活动程度相关[37]。但是后续研究未能重复这一结果[38]。也有研究发现抗组织纤维蛋白溶酶原抗体(anti-tissue plasminogen autoantibody)和抗MPO抗体阳性率相关,对于肾脏损伤的预测价值可能更优[39]。学者报道了大动脉炎患者及巨细胞动脉炎患者的血清中检测出抗ferritin抗体[40, 41]。国内学者在大动脉炎患者中发现八种自身抗体作为潜在的大动脉炎特异性诊断生物标志物,包括抗SPATA7、QDPR、SLC25A2、PRH2、DIXDC1、IL17RB、ZFAND4和NOLC1抗体[42]。国内学者使用高通量蛋白芯片技术研究白塞病相关自身抗体,筛选并鉴定了白塞病相关抗CTDP1抗体[43]。HABP2蛋白是白塞病合并血管受累的潜在生物标志物之一[44]。目前这些新的自身抗体都处于科研阶段,未来需要更多的大样本的多中心研究来进一步验证新的自身抗体的诊断及预测价值。
对于需要检测ANCA的目标人群,尤其是GPA和MPA患者,首先推荐使用高质量的免疫试剂盒进行特异性抗体的检测。对高度怀疑AAV诊断,但第一次特异性自身抗体检测阴性时,方可使用另一种免疫试剂再一次检测或是IIF法检测。对第一次出现弱阳性的样本,为提高诊断灵敏度,可使用另一种免疫试剂或是IIF法检测。AAV:ANCA相关血管炎,GPA:肉芽肿性多血管炎,MPA:显微镜下多血管炎,IIF:间接免疫荧光法。
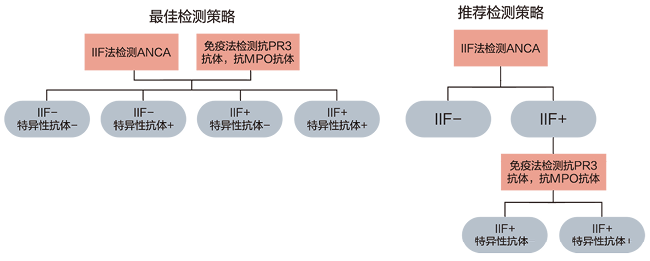
图1. 1999年ANCA检测共识提出的最佳检测策略和推荐检测策略[21]:间接免疫荧光法是ANCA检测的筛选方法。IIF:间接免疫荧光法
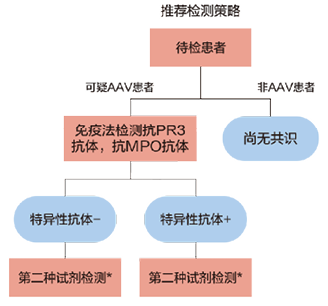
图2. 2017年ANCA检测共识检测提出的最佳检测策略[20]
参考文献
粟占国. 凯利风湿病学. 第10版: 北京: 北京大学医学出版社; 2020.
张奉春. 中华医学百科全书—风湿病学: 北京: 中国协和医科大学出版社; 2017.
李永哲. 自身抗体免疫荧光图谱: 北京: 人民卫生出版社; 2014.
中国免疫学会临床免疫分会. 自身抗体检测在自身免疫病中的临床应用专家建议. 中华风湿病学杂志. 2014; 18: 437-43. doi: 10.3760/cma.j.issn.1007-7480.2014.07.002.
中国免疫学会临床免疫分会专家组. 自身免疫病诊断中抗体检测方法的推荐意见. 中华检验医学杂志. 2020; 43: 878-88. doi: 10.3760/cma.j.cn114452-20191225-00750.
Davies DJ, Moran JE, Niall JF, Ryan GB. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology? British medical journal (Clinical research ed.). 1982; 285: 606. doi: 10.1136/bmj.285.6342.606.
van der Woude FJ, Rasmussen N, Lobatto S, Wiik A, Permin H, van Es LA, et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis a nd marker of disease activity in Wegener's granulomatosis. Lancet (London, England). 1985; 1: 425-9. doi: 10.1016/s0140-6736(85)91147-x.
Goldschmeding R, van der Schoot CE, Ten Bokkel Huinink D, Hack CE, van den Ende ME, Kallenberg CG, et al. Wegener's granulomatosis autoantibodies identify a novel diisopropylfl uorophosphate-binding protein in the lysosomes of normal human neutrop hils. The Journal of clinical investigation. 1989;84:1577-87. doi: 10.1172/JCI114335.
Folci M, Ramponi G, Solitano V, Brunetta E. Serum ANCA as Disease Biomarkers: Clinical Implications Beyond Vasculitis. Clin Rev Allergy Immunol. 2022; 63:107-23. doi: 10.1007/s12016-021-08887-w.
Damoiseaux J. ANCA Testing in Clinical Practice: From Implementation to Quality Control and Harmonization. Frontiers in Immunology. 2021; 12. doi: 10.3389/fimmu.2021.656796.
Falk RJ, Jennette JC. Anti-neutrophil cytoplasmic autoantibodies with specificity for myelop eroxidase in patients with systemic vasculitis and idiopathic necrotiz ing and crescentic glomerulonephritis. The New England journal of medicine. 1988; 318:1651-7. doi: 10.1056/NEJM198806233182504.
Bond M, Fagni F, Vaglio A. ANCA testing: where are we now? Internal and Emergency Medicine. 2021;16:269-71. doi: 10.1007/s11739-020-02584-w.
Ramponi G, Folci M, De Santis M, Damoiseaux J, Selmi C, Brunetta E. The biology, pathogenetic role, clinical implications, and open issues of serum anti-neutrophil cytoplasmic antibodies. AUTOIMMUNITY REVIEWS. 2021;20:102759. doi: 10.1016/j.autrev.2021.102759.
Csernok E. The Diagnostic and Clinical Utility of Autoantibodies in Systemic Vasculitis. Antibodies. 2019; 8: 31. doi: 10.3390/antib8020031.
McAdoo SP, Pusey CD. Anti-Glomerular basement Membrane Disease. Clinical journal of the American Society of Nephrology : CJASN. 2017; 12: 1162-72. doi: 10.2215/CJN.01380217.
Kallenberg CGM. Anti-C1q autoantibodies. AUTOIMMUNITY REVIEWS. 2008; 7: 612-5. doi: 10.1016/j.autrev.2008.06.006.
Robson JC, Grayson PC, Ponte C, Suppiah R, Craven A, Judge A, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. ANNALS OF THE RHEUMATIC DISEASES. 2022; 81: 315-20. doi: 10.1136/annrheumdis-2021-221795.
Suppiah R, Robson JC, Grayson PC, Ponte C, Craven A, Khalid S, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. ANNALS OF THE RHEUMATIC DISEASES. 2022; 81: 321-6. doi: 10.1136/annrheumdis-2021-221796.
Grayson PC, Ponte C, Suppiah R, Robson JC, Craven A, Judge A, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis with Polyangiitis. ANNALS OF THE RHEUMATIC DISEASES. 2022;81:309-14. doi: 10.1136/annrheumdis-2021-221794.
Bossuyt X, Cohen Tervaert J, Arimura Y, Blockmans D, Flores-Suárez LF, Guillevin L, et al. Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nature Reviews Rheumatology. 2017; 13: 683-92. doi: 10.1038/nrrheum.2017.140.
SAVIGE J, GILLIS D, POLLOCK W, PUSEY C, SAVAGE COS, SILVESTRINI R, et al. International consensus statement on testing and reporting of antineutrophil cytoplasmic antibodies (ANCA). AMERICAN JOURNAL OF CLINICAL PATHOLOGY. 1999; 111: 507-13. doi: 10.1093/ajcp/111.4.507.
Savige J, Dimech W, Fritzler M, Goeken J, Hagen EC, Jennette JC, et al. Addendum to the International Consensus Statement on testing and repor ting of antineutrophil cytoplasmic antibodies. Quality control guideli nes, comments, and recommendations for testing in other autoimmune dis eases. AMERICAN JOURNAL OF CLINICAL PATHOLOGY. 2003; 120: 312-8. doi: 10.1309/WAEP-ADW0-K4LP-UHFN.
Damoiseaux J, Csernok E, Rasmussen N, Moosig F, van Paassen P, Baslund B, et al. Detection of antineutrophil cytoplasmic antibodies (ANCAs): a multicen tre European Vasculitis Study Group (EUVAS) evaluation of the value of indirect immunofluorescence (IIF) versus antigen-specific immunoassay s. ANNALS OF THE RHEUMATIC DISEASES. 2017; 76: 647-53. doi: 10.1136/annrheumdis-2016-209507.
Damoiseaux J, Csernok E, Rasmussen N, Moosig F, van Paassen P, Baslund B, et al. Detection of antineutrophil cytoplasmic antibodies (ANCAs): a multicen tre European Vasculitis Study Group (EUVAS) evaluation of the value of indirect immunofluorescence (IIF) versus antigen-specific immunoassay s. ANNALS OF THE RHEUMATIC DISEASES. 2020; 76: 647-53. doi: 10.1136/annrheumdis-2016-209507.
Moiseev S, Cohen TJ, Arimura Y, Bogdanos DP, Csernok E, Damoiseaux J, et al. 2020 international consensus on ANCA testing beyond systemic vasculitis. AUTOIMMUNITY REVIEWS. 2020; 19: 102618. doi: 10.1016/j.autrev.2020.102618.
Walker BS, Peterson LK, Koening C, White SK, Schmidt RL, Tebo AE. Performance of MPO-ANCA and PR3-ANCA immunoassays for the stratification of specific ANCA-associated vasculitis: A systematic review and meta-analysis. AUTOIMMUNITY REVIEWS. 2022; 21: 103100. doi: 10.1016/j.autrev.2022.103100.
Zhang W, Zheng Z, Jia R, Li X, Zuo X, Wu L, et al. evaluation of 12 different assays for detecting ANCA in Chinese patien ts with GPA and MPA: a multicenter study in China. CLINICAL RHEUMATOLOGY. 2019; 38: 3477-83. doi: 10.1007/s10067-019-04736-6.
Damoiseaux J, Csernok E, Rasmussen N, Cohen Tervaert J, Bossuyt X. Antineutrophil cytoplasmic antibodies: reporting and diagnostic strate gies. ANNALS OF THE RHEUMATIC DISEASES. 2017; 76: e39. doi: 10.1136/annrheumdis-2017-211171.
Damoiseaux J, Csernok E, Rasmussen N, Cohen Tervaert J, Bossuyt X. Antineutrophil cytoplasmic antibodies: appropriate use and interpretat ion. ANNALS OF THE RHEUMATIC DISEASES. 2017; 76: e24. doi: 10.1136/annrheumdis-2016-210908.
Mieli-Vergani G, Vergani D, Czaja AJ, Manns MP, Krawitt EL, Vierling JM, et al. Autoimmune hepatitis. Nature reviews. Disease primers. 2018; 4: 18017. doi: 10.1038/nrdp.2018.17.
Arias-Loste MT, Bonilla G, Moraleja I, Mahler M, Mieses MA, Castro B, et al. Presence of anti-proteinase 3 antineutrophil cytoplasmic antibodies (a nti-PR3 ANCA) as serologic markers in inflammatory bowel disease. CLINICAL REVIEWS IN ALLERGY & IMMUNOLOGY. 2013; 45:109-16. doi: 10.1007/s12016-012-8349-4.
Morris AD, Rowbottom AW, Martin FL, Woywodt A, Dhaygude AP. Biomarkers in ANCA-Associated Vasculitis: Potential Pitfalls and Future Prospects. Kidney360. 2021; 2: 586-97. doi: 10.34067/KID.0006432020.
Monogioudi E, Hutu DP, Martos G, Sheldon J, Schimmel H, Meroni PL, et al. Development of a Certified Reference Material for myeloperoxidase-anti -neutrophil cytoplasmic autoantibodies (MPO-ANCA). Clinica chimica acta; international journal of clinical chemistry. 2017; 467: 48-50. doi: 10.1016/j.cca.2016.05.031.
Monogioudi E, Sheldon J, Meroni PL, Hutu DP, Schimmel H, Zegers I, et al. Certified reference material against PR3 ANCA IgG autoantibodies. From development to certification. CLINICAL CHEMISTRY AND LABORATORY MEDICINE. 2019; 57: 1197-206. doi: 10.1515/cclm-2018-1095.
Tomasson G, Grayson PC, Mahr AD, Lavalley M, Merkel PA. Value of ANCA measurements during remission to predict a relapse of AN CA-associated vasculitis--a meta-analysis. Rheumatology (Oxford, England). 2012; 51: 100-9. doi: 10.1093/rheumatology/ker280.
Kemna MJ, Damoiseaux J, Austen J, Winkens B, Peters J, van Paassen P, et al. ANCA as a predictor of relapse: useful in patients with renal involvem ent but not in patients with nonrenal disease. Journal of the American Society of Nephrology : JASN. 2015; 26: 537-42. doi: 10.1681/ASN.2013111233.
Kain R, Tadema H, McKinney EF, Benharkou A, Brandes R, Peschel A, et al. High prevalence of autoantibodies to hLAMP-2 in anti-neutrophil cytopl asmic antibody-associated vasculitis. Journal of the American Society of Nephrology : JASN. 2012; 23: 556-66. doi: 10.1681/ASN.2011090920.
Kain R, Rees AJ. What is the evidence for antibodies to LAMP-2 in the pathogenesis of A NCA associated small vessel vasculitis? CURRENT OPINION IN RHEUMATOLOGY. 2013; 25: 26-34. doi: 10.1097/BOR.0b013e32835b4f8f.
Berden AE, Nolan SL, Morris HL, Bertina RM, Erasmus DD, Hagen EC, et al. Anti-plasminogen antibodies compromise fibrinolysis and associate with renal histology in ANCA-associated vasculitis. Journal of the American Society of Nephrology : JASN. 2010; 21: 2169-79. doi: 10.1681/ASN.2010030274.
Baerlecken NT, Linnemann A, Gross WL, Moosig F, Vazquez-Rodriguez TR, Gonzalez-Gay MA, et al. Association of ferritin autoantibodies with giant cell arteritis/polym yalgia rheumatica. ANNALS OF THE RHEUMATIC DISEASES. 2012; 71: 943-7. doi: 10.1136/annrheumdis-2011-200413.
Große K, Witte T, Moosig F, Hoyer BF, Lansche C, Schmidt RE, et al. Association of ferritin antibodies with Takayasu arteritis. CLINICAL RHEUMATOLOGY. 2014; 33: 1523-6. doi: 10.1007/s10067-014-2764-2.
Wen X, Song G, Hu C, Pan J, Wu Z, Li L, et al. Identification of Novel Serological Autoantibodies in Takayasu Arterit is Patients Using HuProt Arrays. Molecular & cellular proteomics: MCP. 2021; 20: 100036. doi: 10.1074/mcp.RA120.002119.
Hu C, Pan J, Song G, Wen X, Wu Z, Chen S, et al. Identification of Novel Biomarkers for Behcet Disease Diagnosis Using Human Proteome Microarray Approach. Molecular & cellular proteomics : MCP. 2017; 16: 147-56. doi: 10.1074/mcp.M116.061002.
Cheng L, Wang D, Wang Z, Li H, Wang G, Wu Z, et al. Proteomic landscape mapping of organ-resolved Behçet's syndrome using in-depth plasma proteomics for identifying HABP2 expression associated with vascular involvement. Arthritis & rheumatology (Hoboken, N.J.). 2022: 10-1002. doi: 10.1002/art.42348.




