临床血液体液学室内质量控制的策划

付兆强,现任高博医学(血液病)上海研究中心/上海闸新中西医结合医院检验中心质量主管、MICM平台形态学主管。2011年-2012年在长海医院血液内科实验室进修骨髓涂片细胞形态学检查。2015年在华山医院检验科进修学习ISO15189相关管理工作。从事检验工作20年,曾涉及检验科各亚专业的相关工作,热衷于细胞形态学检验及ISO15189等质量管理相关工作。参编著作1部,先后发表数篇专业文章及微信推文,获得数个血液及体液细胞形态学病例大赛奖项。
社会兼职:中国中西医结合学会检验医学专业委员会第一届形态学分析诊断专家委员会青年委员、中国老年保健医学研究会肿瘤防治分会第一届委员会血液肿瘤实验诊断专业委员、中国医药质量管理协会医学检验质量管理专业委员会血液病实验诊断质量管理学组第一届委员、血细胞形态学轻松入门系列讲座第一届讲课老师、上海市社会医疗机构协会检验医学分会委员。
2005年发布的中华人民共和国卫生行业标准WS/T 250-2005《临床实验室质量保证的要求》中提到:临床实验室必须建立并遵守质量保证(QA)的政策和程序,用所建立的QA政策和程序来监测和评价整个检验过程(分析前、分析中、分析后)的质量。2006年发布的中华人民共和国国家标准GB/T 20468-2006《临床实验室定量测定室内质量控制指南》中提到:质量控制方法是用来监测检验方法的分析性能,警告检验人员存在的问题。质量控制一般通过检测质控品来实行,根据统计量来判断检验结果的质量,是否需要做系统的纠正,患者检验结果是否可接受。此外,ISO 15189和上海市临床检验中心制定的上海市医疗机构临床实验室质量管理规范中都有检验结果质量保证的内容,通过实验室设计的质量控制程序以验证达到预期的结果质量。2018年中华人民共和国卫生行业标准WS/T 641-2018《临床检验定量测定室内质量控制》规定了对临床检验定量测定项目室内质量控制(以下简称室内质控)的目的、方法的设计、实际操作、数据的管理、基于患者数据质量控制方法以及室内质控数据实验室间比对。其中室内质控提出通过统计学规律推断和评价本批次测量结果的可靠程度,也包含了许多策略。例如一个血常规WBC结果为6.5x109/L,这个结果我们不能认为它一定正确,只有通过质控品的检测,质控结果在控后再去推断这个结果才是可靠的。因此IQC是确保患者检验结果是否准确的程序之一。
一、把正确IQC做正确
不是简单地检测质控品就能控制好实验室检测的质量,又或者是重测、重测、再重测——直到得到幸运的质控结果。只有在实施了正确的IQC程序,而且每次检测质控品的常规操作均被正确执行,这才是真正做到了室内质控。做正确的IQC需要由质量负责人或专业组长选择质控品,制定室内质控的操作程序,至少包括制定各检测项目的质量目标、控制方案(规则、检测频次、IQC统计软件、计算及设置质控图)、具体实施、检查实施情况,数据统计分析和形成评估报告、汇总结果的审核。把IQC做正确需要由操作该系统的所有检测人员负责常规质控品的准备、检测、解释、文件记录等。因此,实验室所有人员都有责任把正确的IQC做正确,只是管理层和检验人员各自承担着不同的责任。
2012年中华人民共和国卫生行业标准WS/T406-2012《临床血液学检验常规项目分析质量要求》中提到了血常规的日间精密度,包括上海市临检中心质量管理规范附录里的各专业质量控制允许误差范围(包含临床血液体液室间质量评价误差范围)。CLIA’88要求对于所有非手工凝血检测系统,实验室每操作8小时及每更换1次试剂均须检测2个水平的质控品。另外上海市医疗机构临床实验室质量管理规范中要求实验室应制定室内质控SOP,定量检测项目可参照相关标准进行室内质控,应根据检验样品数量、仪器运行时间、试剂和质控品的稳定性等情况定期实施室内质控,检测当天至少1次,宜每8小时运行1次质控。失控应纠正,并进一步查找原因,采取纠正措施和/或预防措施,填写失控分析报告,并对失控前所报告检验结果的可靠性进行验证。
上海临床检验中心管理规范中明确了累计均值及设定控制限的详细方法。ISO 15189在临床血液学检验领域的应用说明里提到质控频度根据检验样品量定期实施,检测当天至少1次,至少使用2个浓度水平(正常和异常水平)的质控物。应规定质控规则,全血细胞计数至少使用13s和22s规则。ISO 15189在临床体液学检验领域的应用说明提到尿液有形成分分析仪红细胞、白细胞计数检验项目,可参照GB/T 20468-2006《临床实验室定量测定室内质量控制指南》进行室内质控。应至少使用2个浓度水平(正常和异常)的质控物,每检测日至少检测1次,应至少使用13s、22s失控规则。定性体液学检验项目应至少使用阴性和阳性质控物进行室内质控,每工作日至少检测1次,偏差不超过1个等级,且阴性不可为阳性,阳性不可为阴性。
WS/T 641-2018《临床检验定量测定室内质量控制》中指出,对于稳定性较长的质控品,在开始室内质控时,首先要设定质控品的均值。各实验室应对新批号的质控品的各个测定项目自行确定均值。均值必须在实验室内使用自己现行的检验程序进行确定。定值质控品的标定值只能作为确定均值的参考。为了确定暂定均值新批号的质控品应与当前使用的质控品一起进行测定。根据20或更多独立批获得的至少20次质控测定结果(剔除异常值或离群值),计算出平均数,作为暂定均值。以此暂定均值作为下一个月室内质控图的中心线进行室内质控,一个月结束后,将该月的在控结果与前20个质控测定结果汇集在一起,计算累计平均数(第一个月),以此累计的平均数作为下一个月质控图的均值。重复上述操作过程,连续三至五个月,或逐月不断进行累积。
稳定性较短的质控品在3~4天内,每天分析每水平质控品3-4瓶(注每天开1瓶较切合实际),每瓶进行2~3次重复。收集数据后,计算平均数、标准差和变异系数,对数据进行异常值检验。如果发现异常值,需重新计算余下数据的平均数和标准差。以此均值作为质控图的中心线。对新批号质控品需要设定控制限,控制限通常以标准差倍数表示。稳定性较短的标准差可以用以前累积变异系数(CV)来估计新的标准差,也可以采用加权平均的不精密度(CV%)来计算该批号合适的标准差(s)。待此一个月结束后,将该月在控结果与前面建立的质控图的质控结果汇集在一起,计算累计平均值和标准差。以此累计的平均数作为下一个月质控图的均值。重复上述操作过程,并进行逐月累积。控制限的设定通常是以标准差的倍数表示。临床实验室不同项目(定量测定)的控制限的设定要根据其采用的质控规则来决定。拟更换新批号的质控品时,应在“旧”批号质控品使用结束前,新批号质控品应与“旧”批号质控品一起测定,重复以上的过程,设立新批号质控品的均值和控制限。日常工作中一般是在“旧”批号快过期前的3~4天与新批号一起进行平行检测,再来统计新批号的均值和SD。建议保留打印或电子的原始质控记录。
这么多规范性文件、行业标准和指南,检验科需要制定本科室的室内质控程序,临检组也要制定临检组室内质控操作程序。职责明确,组长负责质控数据的汇集、分析和统计;临检组各岗位工作人员负责该检测项目每日质控的执行。组长需针对每个定量检测项目制定质量目标,包括允许总误差(TEa%)、偏倚(B%)、不精密度(室内质控CV%)。质量目标的制定依据是按已出版的质量指标制定质量目标,如WS/T 406-2012《临床血液学检验常规项目分析质量要求》;室间质评计划中规定的允许总误差(TEa%),并以1/2TEa作为偏倚(B%)及1/3TEa作为不精密度(室内质控CV%),如:上海市临床检验中心、全国卫生部临检中心室间质评的标准、CLIA’88等;基于本实验室目前技术水平制定质量目标,如附表《临检组检验项目质量控制目标》。还有室内质控品的订购、接收和保存,都需要详细地写在程序当中。
室内质控品检测要求是,所有检测项目的质控品都必须与病人标本一样对待,由当天检测该项目的检测人员完成。所有检测项目都必须按要求做室内质控,间隔24小时后必须重做质控。定量项目每次必须做两个浓度的质控。定性项目必须做阴性、阳性质控,报告弱阳性的应加做弱阳性的质控。所有室内质控通过后方能检测标本和发出报告。定量项目的靶值范围的设定(如血液常规):质控品宜在每天不同时段至少检测3-4天,至少使用10个检测结果的均值计算靶值,靶值应落在厂商提供的范围内;定性项目的靶值范围的设定(如尿液定性项目):阳性质控结果不能为阴性,阴性质控结果不能为阳性,其余结果在均值上下1+,比重不能超过0.005。手工复核试剂及染色项目,每批(或新配置)试剂及染色液必须进行有效性评估并记录等等。
每次完成质控,由该项目的检测者把数据输入电脑,并按Westgard多规则原则,分析质控结果或曲线,用SD、CV评价质控可接受范围,定性项目的质控阴、阳性结果必须符合。每次失控必须分析原因,纠正失控后才能检测标本。如果在失控之前已经检测病人标本,需要评估这个结果是否可靠,如果不可靠还需要重新检测后再发出正确的结果。填写《室内质控失控分析报告》表,记录处理过程并签名。失控记录夹入指定的文件夹内保存,保存期为两年。每月组长需进行质控数据的分析并且签名,所有室内质控记录夹入指定的文件夹内保存,保存期为两年。同时对全体工作人员进行《室内质控操作程序》培训并记录。
形态组的室内质控应对首次开瓶使用的染色液或在有效期内已开瓶使用超过6个月的染色液进行有效性(染色效果)评估。每周第一个工作日对日常使用的瑞氏-吉姆萨染色液及铁染色液进行一次评估;对不常用的特殊染色液(如过氧化物酶染色、氯醋酸酯酶染色、糖原染色等)应在每次使用时进行评估。最好由两名资历较深的形态学检验人员查看染色效果,合格的染色效果应具备背景清晰干净,各类细胞呈现出该有的染色特性。
例如瑞氏-姬姆萨染色效果(或有效性)评估的方法:开瓶后试剂盒在有效期内的染色液建议在开封后6个月内使用完,每次使用后应及时拧紧瓶盖,以免挥发或变质。应对首次开瓶使用的染色液或在有效期内已开瓶使用超过6个月的染色液进行有效性(染色效果)评估,同时在每周第一个工作日进行一次有效性评估。最好由两名资历较深的形态学检验人员查看血涂片的染色效果,合格的染色效果应具备背景清晰干净,涂片中红细胞呈粉红色,白细胞细胞核染紫红色、胞浆中颗粒(尤其嗜酸、嗜碱颗粒)清楚,血小板呈淡蓝色或淡紫红色,并记录于《瑞氏-姬姆萨染色液有效性评估记录》。在做POX、DCE和PAS等染色前需要看是否有正常的中性粒细胞,中性粒细胞可以作为内对照;非特异性酯酶也是一样。碱性磷酸酶染色需要做一个外对照,碱性磷酸酶染色用于骨髓增殖性疾病的判断,同时需要取正常人外周血推片做染色对照,这样才能看到患者的碱性磷酸酶积分偏高还是减低。
二、失控后措施
操作者在测定质控品时,如发现质控数据违背了控制规则,应填写失控报告单,上交专业室主管(组长),由专业室主管(组长)做出是否发出与测定质控品相关的那批患者样品检验报告的决定。提示失控时受多种因素的影响,这些因素包括操作上的失误,试剂、校准物、质控品的失效,仪器维护不良以及采用的质控规则、控制限范围,一次测定的质控品数等。提示失控时就意味着与测定质控品相关的那批患者样品报告可能作废。此时,首先要尽量查明导致失控的原因,然后再随机挑选出一定比例的患者样品进行重新测定,最后根据预先设定标准判断先前测定结果是否可接受,对失控做出恰当的判断。对判断为真失控的情况,应该在重做质控结果在控以后,对相应的失控患者标本进行重新测定。如失控信号被判断为假失控时,常规测定报告可以按原先测定结果发出,不必重做。当提示失控时,可采取的分析步骤为:应首先确定失控类型、分析查找原因、针对原因采取纠正措施、验证纠正措施的有效性、验证措施有效后恢复检验、评估最后一次成功质量控制活动后患者样品的检验结果、填写失控报告。对失控的最佳处理是确认问题的原因,发现问题并提出妥善解决的办法,消除失控的原因,并防止以后再次发生。实验室应建立制度,在出现质控失控时,有相应措施验证患者检测结果。查找失控原因时,应改掉坏习惯,不要直接重复检测质控品或尝试一瓶新的质控品。而应养成好习惯,检查质控图违反的规则以确定误差类型;根据误差类型确定潜在原因;考虑多项检测系统上的共性因素;与近期改变关联的原因;验证解决方案并记录纠正措施;建立故障排查指南。
检测系统包括人、机、料、法、环。人员方面排查近期操作人员是否有变更;操作员工是否按照SOP进行操作;操作员工对关键的操作步骤是否掌握。分析仪器方面排查近期使用情况是否正常;近期是否进行了维护和保养;缓冲液和冲洗液是否配置正确。试剂耗材要看是否更换批号,配套试剂及辅助试剂是否更换批号,若有更换,新批号试剂是否有内容(使用要求)的变更,更换试剂批号后是否有重新定标;试剂是否过期,开瓶时间是否过长,配套试剂及辅助试剂是否在有效期内;保存是否正确,冰箱温度是否有变化,试剂是否有明显变质;试剂(配套试剂及辅助试剂)是否有放错位置;不同瓶试剂是否有合并使用,不同批号试剂是否有混合使用。定标品及定标查看是否更换批号,若有更换,新批号定标品是否有内容(使用要求)的变更,新批号定标品设定值是否正确;定标品是否过期,开瓶时间是否过长,是否反复使用;定标品保存是否正确,冰箱温度是否有变化,定标品是否有明显变质;定标品与试剂是否配套;定标值(读数值)是否有明显的变化;更换新试剂批号后是否有重新定标;定标时限是否过期或设定过长。质控品是否更换批号,若有更换,新批号质控品的靶值是否重新设立;质控品是否过期,开瓶时间是否过长,是否多次使用;保存是否正确,冰箱温度是否有变化,质控品是否有明显变质;质控品使用前处理是否正确。操作程序是否有变更;操作程序是否进行员工培训;操作程序内容是否完善并通俗易懂。环境和配套设施中实验室温度、湿度是否在控;实验室用水是否符合要求;电压是否有波动,是否使用UPS。最好制定一个失控排查图(如图1),确定误差类型,系统误差容易发现与纠正,随机误差更难查找原因与防范。最后填写《室内质控失控分析报告》,并对失控范围进行验证,必要时对患者标本进行重测,最终发出准确的报告。
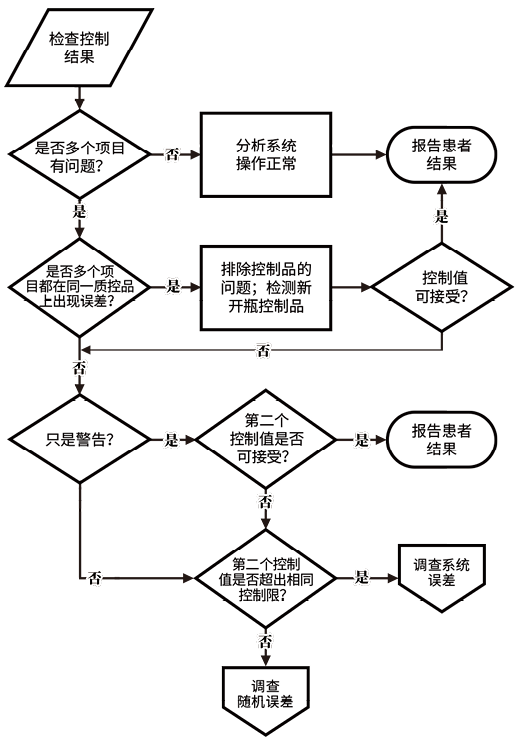
图1. 失控排查图
三、案例分享
1. 案例1:血常规的室内质控结果会随着质控品的贮存时间发生改变,其中HCT、MCV结果会越来越高,MCHC结果会越来越低,甚至都偏向一侧或失控。2021年发表的一篇《血细胞分析仪室内质控方案的设定及分析》中建议,3d10点质控值均值作为L-J质控图中的WBC、RBC、HB、PLT、MCH中心线质控结果稳定,而时间曲线拟合定值法可以良好地制订MCV、HCT、MCHC质控图中心线,符合全血细胞分析质控品特性,可以有效避免假失控,能更好地监测仪器稳定性。全血质控品既要考虑全血标本保存周期,又要保证全血细胞成分具有一定的活性,因此全血质控品只能半固定,稳定性较差,保存时间不会太长。全血质控品随着放置时间延长,细胞会出现变形,影响质控结果。若质控品不够稳定,红细胞经过细胞固定剂的作用后,随着固定时间延长,细胞膜越硬,刚性指数越大,不易变形,其体积越来越大。质控品临近有效期时,MCV随时间延长会逐渐增加,偏离设定靶值,出现较多假失控现象。昆涞质控软件支持通过浮动/累计均值、累积SD对MCV、HCT、MCHC进行监测。质控品的稳定性会发生漂移,但检测系统的稳定性比较好,符合相关的行业标准。
2. 案例2:在使用sysmax CS2000i凝血分析仪做凝血项目室内质控时,室内质控品说明书建议每瓶质控品复溶后当天使用。本实验室改进质控品的贮存方法,将一瓶质控品复溶后分装成3份,第一天做1份,剩余2份置-20℃冻存,分别在后续两天里各取1份置37℃速溶后检测,发现纤维蛋白原结果呈趋势性下降。经整理说明书发现,FIB的缓冲液(Owern’s Veronal Buffer,OVB)开瓶后在2~8℃可以保存8周,但是该仪器的OVB是放在常温试剂仓中,所以实验室应根据每天的样本量添加适量的FIB缓冲液(本实验室每天更换添加4ml),并在仪器常温试剂仓盖子上贴上标识,同时提示试剂仓内的PT试剂每6小时取出摇匀一次,更换D-二聚体试剂时,必须同时更换四瓶试剂。通过改进凝血质控品的贮存方式及试剂的添加方法,凝血项目的质控结果均符合质量目标。
3. 案例3:患者,女,80岁,住院期间2018年2月27日的D-二聚体13.04ug/ml、PT 10.0s、APTT 18.4s、TT 17.9s、FIB 3.12g/L。检验人员猜测为高凝患者,经复查结果一致便审核发出。2月28日再次送检标本复查,结果为D-二聚体0.65ug/ml、PT 11.0s、APTT 24.7s、TT 17.7s、FIB 3.32g/L。立即与临床医生沟通,沟通得知27日夜班医生开始没有申请凝血检查,补申请后,护士为了不让患者再扎针采血,未遵照标本采集要求规范采集标本,将常规生化管(红盖)标本倒入凝血检查管(蓝盖)中,发生肉眼不可见血凝,从而导致结果异常。
4. 案例4:一患者6月20日第一次检测尿常规的白细胞酯酶++、尿蛋白弱阳性、隐血++;6月21日第二次检测尿常规的白细胞酯酶弱阳性、尿蛋白++、隐血+。本实验室规定尿蛋白若为阳性,应进行磺基水杨酸手工试剂复核,因考虑两次结果差别不大(或者标本留取时间不一致),尿蛋白复核符合后将结果发出。后患者将两次报告拿来询问,经门诊调取监控,发现两个不同的患者用同一张医保卡进行检测,因此两次结果存在明显的差异,这种检验前的质控环节是检验人员较难把控的。
5. 案例5:患者,男,68岁,高血压病3级、高血压性肾病、慢性肾脏病5期、脑梗塞后遗症、2型糖尿病、痛风,于2017年3月4日收入肾内科,住院期间凝血检查结果如下:3月4日:PT 13.7s、PT-INR 1.17、APTT 24.3s、TT 15.1s、FIB 4.4g/L、DD 10.06ug/ml;3月20日:PT 150.6s、PT-INR 13.2、APTT 127.2s、TT 16.9s、FIB 9g/L、DD 3.0ug/ml;3月21日:PT 148.6s、PT-INR 13.03、APTT 126.3s、TT 18.9s、FIB 9.01g/L。3月22日:PT 18.7s、PT-INR 1.61、APTT 42.1s、TT 19.2s、FIB 8.79g/L,复查后与临床沟通,发现患者在3月20日静推头孢哌酮/舒巴坦,从而导致凝血功能异常。头孢哌酮钠舒巴坦钠是临床应用较多的第三代头孢类广谱抗生素,目前认为该药导致凝血功能异常的机制主要是头孢哌酮结构中的N-甲基硫代四唑基团在体内代谢时可直接抑制肝脏微粒体羧化酶或维生素K氧化还原酶,从而导致体内维生素K缺乏。另一方面,头孢哌酮主要经胆道排泄,可抑制肠道正常菌群,影响维生素K吸收,从而导致食物来源的维生素K缺乏。凝血因子Ⅱ、Ⅶ、IX、X是维生素K依赖性凝血因子。维生素K缺乏时,这些凝血因子不能羧化,失去凝血活性,导致维生素K依赖性凝血功能障碍,表现为PT、APTT延长及出血倾向。发现异常时立即停药或补充维生素K1,及时采取相应的措施。
因此案例3、4、5需要用到差值检查法来控制患者的结果,从而保证检验结果的准确性。对某一具体的患者来说,若其情况稳定,则患者前后试验结果也应基本稳定。因此,在患者情况稳定时,患者连续试验结果之间的差值,即Δ(delta)值应该很小。如果△值很大并超过预先规定的界限,则表明存在下列三种可能情况之一:(1)患者样品的试验结果确实有了变化;(2)标本标记错误或混乱;(3)计算△值的两个结果值之一有误差。通常以下列两种方式之一来计算Δ值:Δ(实验单位)=第二次结果-第一次结果,Δ(%)=100x(第二次结果-第一次结果)/第二次结果。Δ值如果很大就需要复查,必要时重新采集标本进行检测,并跟临床医生进行沟通。
6. 案例6:患者,女,82岁,2017年3月15日就诊于急诊科,血常规:WBC 3.39x109/L,RBC 3.33X1012/L,HGB 102g/L,PLT 147x109/L,NEUT% 68.1%。凝血检查:PT 15.4秒,PT-INR:1.32,APTT 49.9秒,TT超出检测上限(>160秒),FIB 3.5g/L,DD 0.42ug/ml。急诊生化:ALT 89.9U/L,AST 43.0U/L,GLU 10.4mmol/L,TP 55.8g/L,ALB 33.8g/L,CA 2.01mmol/L,CK 25U/L。复查TT后并与临床医生沟通,得知该患者是一名房颤患者,一直在使用达比加群,文献报道达比加群会致使TT超出仪器检测上限,2010年10月达比加群酯被美国食品和药品管理局(FDA)批准用于预防房颤患者的脑卒中,成为继华法林之后50年来首个被批准用于房颤抗凝治疗的药物。凝血酶时间(TT)直接反映血浆凝血酶活性,作为判断达比加群酯是否存在抗凝活性的定性指标,用药者TT值延长明显,甚至与未用药者的TT比值可达15倍之多,且当血药浓度>600ng/ml时,TT通常会超过血凝仪器可测量范围的上限。
7. 案例7:本院同事帮朋友咨询外院血常规检测结果,其结果显示RBC 2.70X1012/L,HGB 163g/L,HCT 22.4,MCV 82.8fL,MCH 60.4pg,MCHC 729g/L,高度怀疑为冷凝集,告知同事让其朋友叫该医院检验科工作人员将标本放置37℃半个小时候后(或重新采集标本)立即上机检测,重测后上述项目的结果基本正常。因此建议检验老师们必须参照国际血液学推荐的41条复检规则,对自动化全血细胞计数的异常结果进行复查(核),发现MCHC大于380g/L时,需怀疑存在冷凝集可能,将标本置37℃水浴箱温育后立即上机进行检测。
四、IQC的数据管理
每月或规定时间内进行室内质控数据统计处理。如果实行了室内质控室间化的话,还需要上报到相应的质量控制组织机构。上海市所有参加上海市临床检验中心室内质控的医院,每个月将质控结果上报给上海市临床检验中心。每个月的质控数据最好打印出来(如L-J图和柱状图),并进行综合分析,评估CV是否符合质量目标。昆涞的质控软件能打印L-J图及柱状图,能一目了然的看到每月及累积的均值、CV便于评估分析。室内质控数据实验室间的比对计划,上海市临床检验中心会根据各实验室使用的仪器和质控品进行分组统计,各医院检验科需要评估质控项目所在组里的偏倚是否符合本实验室制定的标准,查看组CV是否可靠,当组CV较大时,说明离散度较大,组均值结果可能不太可靠。上述各类记录分析并签名后归档保存两年。
五、持续改进
将经典的Westgard多规则逻辑判断图和6σ结合建立西格玛规则图(如图2、3)。计算西格玛度量值可描述测量程序的精密度和正确度与质量要求之间的关系,同时可计算医学重要的临界系统误差,然后根据临界系统误差和质量控制方法的性能,选择适当的质控规则和每批质控测定值个数,度量值可以由下列公式计算:σ=【(TEa-丨bias丨)/CV】,其中Tea为允许总误差,bias和CV表示检验程序观测的偏倚和不精密度(变异系数)。
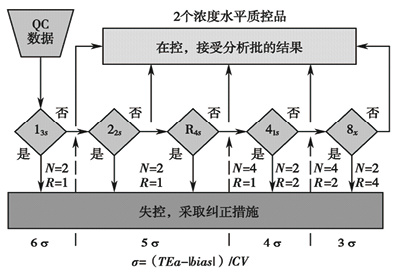
图2. 两个浓度水平质控品的西格玛规则
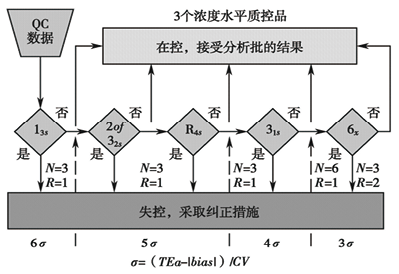
图3. 三个浓度水平质控品的西格玛规则
六、小结
全程的质量管理需要进行室内质控的策划,参照相关的指南及行业标准制定质量目标,按照质量目标进行性能验证,制定操作程序,进行检验的质量控制,对质量指标进行质量评估,根据西格玛值进行持续改进,最后基于风险管理形成一个循环的质量控制。即使在质量控制合格的情况下,还会出现其他(如分析前、中、后)原因致使检验结果不符,因此必要时要善于利用患者差值检查法进行质量控制,从而保证患者结果的准确可靠。





