载脂蛋白B转换工具用于临床诊疗决策的研究
【摘要】背景 尽管最近的大规模多中心研究明确表明,动脉粥样硬化性心血管疾病(ASCVD)风险与载脂蛋白B(ApoB)的相关性高于与低密度脂蛋白胆固醇(LDL-C)的相关性,但后者仍然是美国指导降脂治疗决策的推荐指标。究其原因,改变的一个主要障碍是缺乏指南推荐的ApoB治疗指标。笔者研究开发了一种简单的方法,将ApoB值“转换”为人群等量的LDL-C单位,以允许使用LDL-C做出基于ApoB的治疗决策。方法 收集的人群样本进行标准血脂检测和ApoB免疫测定,排除甘油三酯高于1000mg/dL的人群,纳入了15153人的研究队列。结果 计算出的LDL-C值与百分位等量ApoB值进行线性回归,得到了将ApoB转换为百分位等量LDL-C单位的方程:[LDL-C等量=1.38(ApoB)-29](R2=0.999)。在LDL-C相似的亚组中检测LDL-C和ApoB之间的不一致程度,范围从极低(55-70mg/dL)到极高(175-190mg/dL)。在LDL-C极低的患者中,40%患者ApoB不一致升高,表明ASCVD风险较高;在LDL-C极高的患者中,49%患者ApoB不一致降低;在整个范围内,少数患者(25%-40%)的ApoB水平一致,证实这些生物标志物之间的不一致性非常普遍,ApoB和非高密度脂蛋白胆固醇(non-HDL-C)之间的不一致性分析也发现了类似的结果。结论 提供LDL-C、非HDL-C和ApoB之间差异的比较应有助于促进更快、更广泛地采用ApoB来管理ASCVD风险。
【关键词】载脂蛋白B;LDL-C;胆固醇;血脂;动脉粥样硬化性心血管疾病
目前有确凿证据表明,载脂蛋白B(ApoB)作为他汀类药物治疗患者的残余动脉粥样硬化性心血管疾病(ASCVD)风险标志物优于低密度脂蛋白胆固醇(LDL-C)和非高密度脂蛋白胆固醇(non-HDL-C)。最令人信服的是,临床多中心研究证据表明,ApoB水平高于或低于LDL-C的患者,其ASCVD风险分别高于或低于LDL-C所指示的风险。ApoB和非HDL-C不一致的患者也是如此。尽管有这些发现,临床实践指南继续推荐LDL-C作为指导降脂治疗决策的主要指标,因此,临床医生熟悉LDL-C的治疗指标和阈值,但通常不熟悉如何应用ApoB检测结果。在这里笔者描述一个简单的工具,将检测到的ApoB值“转换”为人群等量的LDL-C值,使临床医生能够继续应用熟悉的LDL-C决策阈值,同时实际上做出基于ApoB的治疗决策。临床实验室可以很容易地自动化这一转换过程,以常规的质量浓度单位以及转化的LDL-C等量单位(ApoB LDL-CEq)报告ApoB。通过Friedewald、Sampson或Martin/Hopkins方程计算,将后者与LDL-C一起报告,将明确哪些患者ApoB水平不一致(高于或低于LDL-C),从而可以相应地优化治疗决策。在过去,成功地使用了类似的转换方法,通过将HbA1c百分比转换为估计的平均血糖值以促进HbA1c在评估血糖状态方面的初步临床应用。
一、对象与方法
本研究使用了最初用于常规诊断项目的临床实验室结果,该结果来自一个包括禁食和非禁食患者的大队列(n=15174)。这项研究中的工作被认为是非干预性研究,不受美国国立卫生研究院机构审查委员会的审查。标准脂质组参数(总胆固醇[TC]、甘油三酯[TG]和高密度脂蛋白胆固醇[HDL-C]),在美国控股实验室公司使用Roche Cobas®8000 c701分析仪进行检测,ApoB在罗氏/日立Cobas®c501/502平台上检测。LDL-C使用Sampson(SLDL-C)、Martin/Hopkins(MLDL-C)和Friedewald(FLDL-C)方程计算,排除TG大于1000mg/dL(11mmol/L)的样本,共有15153名患者。对随机患者样本(n=13567)进行了单独大队列的血脂检测和NMR LipoProfile®分析,后者提供了ApoB、LDL颗粒大小和脂蛋白胰岛素抵抗指数的检测,该指数由与胰岛素抵抗、糖尿病和ASCVD风险相关的6种脂蛋白亚类和大小参数计算得出。我们根据15mg/dL的LDL-C或非HDL-C浓度范围对人群进行了分类。不一致性定义为ApoB LDL-C等量或ApoB非HDL-C等量超出此范围。使用Microsoft Excel进行统计分析。
二、结果
对15153例随机患者样本的脂质组、载脂蛋白B值与普通人群的预期值一致分析。根据Sampson、Friedewald和Martin/Hopkins方程计算的LDL-C的中位数(四分位间距;SI单位)分别为100mg/dL(77-124mg/dL;2.6mmol/L)、98mg/dL(74-122mg/dL;2.5mmol/L)和100mg/dL(77-123mg/dL;2.6mmol/L),ApoB为93mg/dL(77-110mg/dL;0.93g/L)。确定了队列中LDL-C和ApoB结果范围的百分位值,LDL-C对百分位等量ApoB值的线性回归提供了将ApoB结果转换为人群等量LDL-C值的方程式,称为ApoB LDL-CEq。图1显示了SLDL-C的回归图和“平移”回归方程:[ApoB SLDL-CEq=1.38(ApoB)-29](mg/dL);[ApoB SLDL-CEq=3.58(ApoB)-0.76](mmol/L)。图1中给出了MLDL-C和FLDL-C的相应信息。
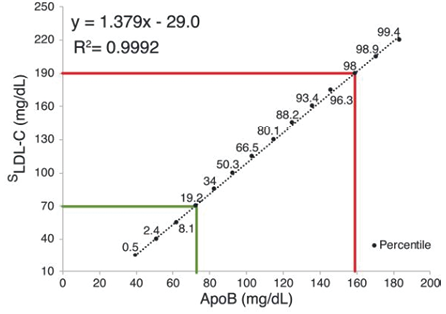
图1. SLDL-C对百分位等量ApoB的线性回归。回归得到了一个将ApoB结果转换为人群等量LDL-C值的方程,称为ApoB LDL-CEq。指示了每个数据点的百分位数
图2显示了9个SLDL-C水平相似的群体亚组的ApoB值(以SLDL-C等量表示)的直方图[在15mg/dL(0.4mmol/L)内],从极低的[55-70mg/dL(1.4-1.8mmol/L)]到极高的[175-190mg/dL(4.5-4.9mmol/L)],还显示了每个亚组中ApoB水平与SLDL-C一致或不一致(在两个方向上)的患者百分比。对于SLDL-C极低(55-70mg/dL)的群体,40%的患者ApoB浓度不一致的升高,表明ASCVD风险高于SLDL-C所提示的风险,这类患者可能治疗不足,可以从更积极的降脂治疗中获益。另一方面,12%的患者具有的ApoB水平,推测ASCVD风险低于LDL-C提示的风险。随着SLDL-C水平的增加,在相反的方向上出现了更多的不一致,更多的患者被评估为比LDL-C所提示的风险更低或更高。在极高LDL-CS亚组(175-190mg/dL)中,49%的ApoB不一致降低,只有20%的ApoB较高,如图2所示,无论用于估计LDL-C的方程如何,ApoB和LDL-C之间不一致的程度和大小是相似的。
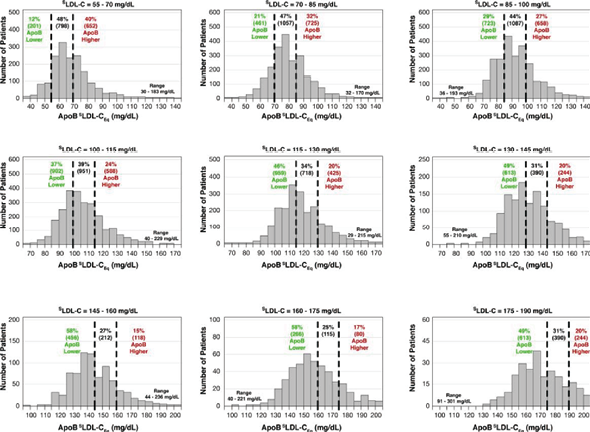
图2. SLDL-C浓度范围较窄的亚组ApoB LDL-CEq值的直方图
直方图显示了具有相似LDL-C浓度的患者亚组中ApoB的高度可变性。这显示了与SLDL-C相比,ApoB不一致低、ApoB一致和ApoB不一致高的患者百分比。当使用其他LDL-C方程时,也注意到类似程度的不一致。
然后使用另一个大数据集(n=13567)评估载脂蛋白B不一致高于或低于LDL-C患者亚组的脂蛋白特征,通过核磁共振分析获得LDL颗粒大小和脂蛋白胰岛素抵抗指数的测量值(表1)。该发现与先前认知一致,即高TG会导致胆固醇耗竭、TG富集和LDL重塑为更小的颗粒。也就是说,必须存在更高数量的胆固醇耗竭颗粒,以维持与正常组成的LDL颗粒中相同的胆固醇含量。由于肝脂肪酶的作用,这些颗粒趋于较小。因此,如表1所示,更大程度的ApoB>LDL-C不一致与更高的TG平均水平、更低的HDL-C和更小尺寸的LDL颗粒(每个颗粒含有更少的胆固醇)有关。LDL-C>ApoB不一致现象则相反。通过脂蛋白胰岛素抵抗指数评分评估的胰岛素抵抗在ApoB>LDL-C不一致的人群中最高,在LDL-C超过ApoB的幅度最大的人群中最低。
表1. 根据LDL-C和ApoB LDL-CEq水平的差异的个体特征
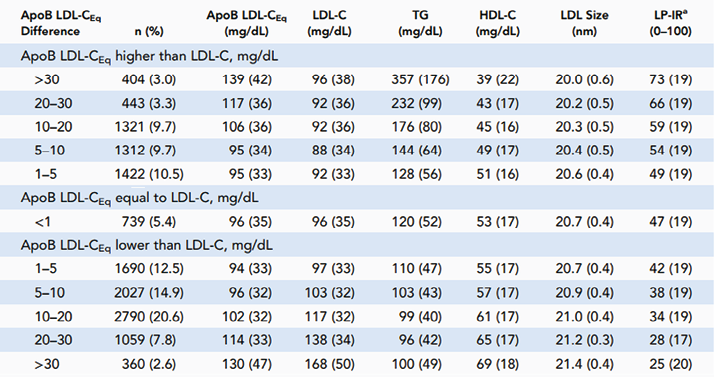
除非另有说明,否则值为平均值(±SD)。该数据集包括13567个随机患者样本,用于检测血脂和核磁共振脂质谱参数(ApoB、LDL大小、LP-IR)。使用Sampson方程计算LDL-C。ApoB LDL-C等量(ApoB LDL-CEq)值使用以下关系式计算:ApoB(1.38)-29。SI单位换算:胆固醇×0.02586;TG×0.01129。a脂蛋白胰岛素抵抗指数。
与ApoB相同,作为治疗靶标非HDL-C被公认为优于LDL-C,并且与ApoB一样列入致动脉粥样硬化的富含甘油三酯的脂蛋白。因此,存在一种普遍的误解,认为非HDL-C和ApoB作为残留ASCVD风险的临床标志物高度一致且在应用上等效。因此,我们用非HDL-C替代LDL-C进行了类似的ApoB转换分析,非HDL-C对百分位等量ApoB值的线性回归提供了方程式[ApoB非HDL-CEq=1.52(ApoB)-21](mg/dL)。图3显示3个非HDL-C水平相对较低的窄范围个体亚组的ApoB非HDL-C等量直方图。ApoB和非HDL-C之间的不一致程度略低于LDL-C,但尽管如此,每个亚组中只有大约50%的个体具有一致的ApoB范围。
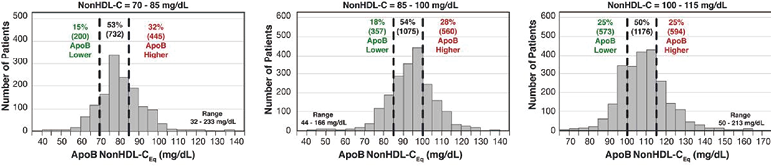
图3. 窄范围非HDL-C浓度亚组ApoB非HDL-Ceq值的直方图
图3显示,在非HDL-C浓度相似的3个亚组患者中,ApoB存在显著差异,与非HDL-C相比,ApoB不一致低、ApoB一致和ApoB不一致高的患者百分比显示。
三、讨论与分析
目前ASCVD指南建议在高危人群中使用他汀类药物实现LDL-C达标,如果达到他汀类药物的最大耐受剂量而没有达标,则可使用非他汀类药物治疗,如依折麦布或前蛋白转化酶枯草杆菌蛋白酶/kexin9型抑制剂。这些降脂疗法在不同程度上也会影响其他致动脉粥样硬化脂蛋白的浓度,如富含甘油三酯的脂蛋白和脂蛋白(a),前者在LDL-C检测中不存在。此外,当去除胆固醇的小LDL颗粒占主导时,例如在肥胖、高甘油三酯血症、胰岛素抵抗、代谢综合征和糖尿病患者中,LDL-C测定值未充分代表致动脉粥样硬化颗粒的数量,而这是ASCVD风险的最佳基于脂质的决定因素。相反,当富含胆固醇的大LDL颗粒丰富时,LDL-C可能会高估残余风险。考虑到LDL-C作为生物标志物的这些局限性,需要注意的是,在宣传精准医学在个体化患者管理指导方面益处的同时,不精确的LDL-C生物标志物仍然是治疗决策的参考标准,特别是在开具昂贵的前蛋白转化酶枯草杆菌蛋白酶/kexin9型抑制剂时。
ApoB检测现在已经相对标准化、自动化且价格低廉。医疗保险的覆盖范围越来越广泛,尤其是对于心血管疾病高危患者,而在自动化生化分析仪上获得ApoB结果的实际成本仅为通常收费的一小部分(2021年美国老年医疗保险和医疗补助保险服务中心对ApoB的报销金额为21.09美元)。然而,许多临床实验室不提供ApoB检测,改善临床实践的一个可靠途径是实验室将载脂蛋白B作为常规“扩展”血脂检测组合的一部分。然而,这本身不太可能克服数十年来仅根据LDL-C确定心血管疾病残余风险和选择降脂治疗方案带来的实际障碍,我们认为,至少在一段过渡时期内,通过采用上述ApoB向更熟悉的LDL-C单位的转换,可以促进从LDL-C到ApoB指导决策的转变。临床实验室可以在逐渐扩大ApoB临床应用方面发挥重要作用,从而避免临床实践的突然改变,这将需要临床医生教育和就ApoB治疗目标达成共识。
在每个临床实验室都可以使用所描述适用的LDL-C计算方法的转换方程或者针对他们服务的特定患者群体开发自己的百分位数等效转换,通过自动化实验室信息系统将使LDL-C的常规报告与ApoB LDL-CEq结果并列成为可能,这将使ApoB和LDL-C之间的差异更加明显。这些差异在整个LDL-C值范围内都会发生,导致无论使用哪种LDL-C计算方法,都会低估或高估残余风险。同样,当实验室定期报告非HDL-C值时,ApoB和非HDL-C之间的差异将凸显出来。
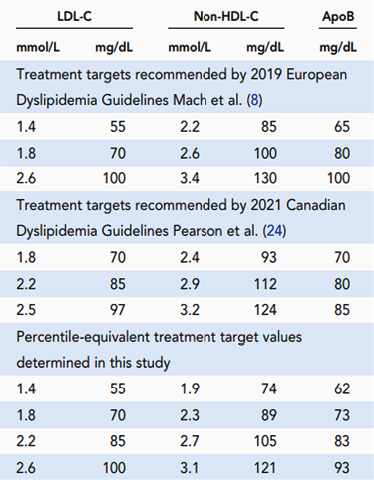
虽然2018年发布的最新美国指南承认有证据表明非HDL-C和ApoB在指导降脂治疗决策方面均优于LDL-C,但他们并未针对这些标志物推荐特定的基于风险的治疗指标或阈值。相比之下,如表2中所总结,最近的欧洲和加拿大指南确实提供了非HDL-C和ApoB指标作为LDL-C阈值的替代方案。欧洲非HDL-C均高于相应的LDL-C值30mg/dL(0.8mmol/L),ApoB不基于人群等效性。另一方面,加拿大指南确实使用人群等效性来推导他们的治疗指标建议,对于非HDL-C和ApoB,这些建议均低于相应的欧洲指南推荐值。表2中还包括我们在本研究中计算的ApoB和非HDL-C值,以通过百分位等量值匹配LDL-C阈值,所有这些值与加拿大指南中给出的值非常一致。
表2. 将欧洲和加拿大指南中推荐的治疗指标与本研究中确定的百分位等量值进行比较
总之,本文描述了一种工具,可以对获得ApoB结果的血脂异常患者产生立竿见影的积极影响。在治疗决策中考虑ApoB价值将优化P4医学所有4项原则(即个性化、预测、预防和参与)中的ASCVD风险管理。通过描述的方程将ApoB转换为人群等效的LDL-C单位很容易执行,并且可以很容易地通过临床实验室信息系统实现。最终,该工具可以促进未来ApoB检测的常规实施并为其使用提供更广泛的指南支持,既可以作为治疗管理工具,也可以作为ASCVD一级预防的筛查检测。




