感染性疾病核酸床旁检测技术临床应用与亟待解决的问题


胡继红,国家卫生健康委临床检验中心微生物室主任,主任技师。负责全国临床及疾控中心微生物室间质评、临床微生物检验标准化、实验室生物安全培训等工作。研究方向:临床微生物检验质量控制及病原诊断和药敏方法学、病原微生物基因诊断标准化、细菌感染所致RNA氧化及作用机制研究。主持完成3项临床检验行业标准;国家“863”、“十二五”重大传染病防治专项分课题负责人。兼任中国微生物学会临床微生物学专委会副主委、中国医院协会临床微生物实验室专委会副主委、中国医疗保健国际交流促进会临床微生物与感染分会副主委;国家病原微生物实验室生物安全专委会 委员;中华医学会检验分会临床微生物学组副组长;《中国抗生素杂志》编委等。

汤一苇,复旦大学上海医学院医学学士、流行病学硕士、美国范德堡大学微生物学和免疫学博士、美国微生物学院院士、美国传染病协会会士、美国微生物学会新冠病料馆馆员。《Journal of Clinical Microbiology》共同主编、《Journal of Molecular Diagnostics》和《Emerging Microbes and Infection》副主编。现任丹纳赫集团/赛沛中国首席医学官、美国临床和实验室标准研究所分子诊断专家组委员。曾是美国疾病控制中心访问学者、梅约医学中心住院医师、范德堡大学医学院教授、美国纪念斯隆凯特琳肿瘤医院主任医师和临床微生物科主任、康奈尔大学医学院教授、海外华人微生物学会主席、美国食品和药品管理局医疗器械咨询委员会委员。发表相关科研论文、综述和专著近400篇。
【摘要】病原学诊断是感染性疾病诊断中最重要的一环,其中分子诊断成为病原学诊断中新兴的、快速发展的方向。核酸床旁检测是指将分子生物学技术用于床旁检测,在实现“提取-扩增-检测”整合一体化的同时,还兼具操作简单、全密闭化、便携、快速等适用于多种场景的特点。与传统核酸检测相比,核酸床旁检测具有流程简化、精确度高、生物安全性风险低和缓解人力资源紧张等优势,部分种类的仪器还实现了样本随到随检,不需要样本等待时间;可适用于急诊、发热门诊,常规实验室、临床实验室及基层医疗机构等多种应用场景。本文从核酸床旁检测技术、应用场景、管理规范/技术要求、性能验证/质量控制、结果分析/报告审核等方面进行综述。
【关键词】感染性疾病;病原体检测;核酸即时检测;质量控制;结果报告
感染性疾病是临床常见的疾病类型之一,可分为细菌病、病毒病、真菌病、寄生虫病等。病原学诊断是感染性疾病诊断中最重要的一环,其中分子诊断技术是病原学诊断中新兴的、发展速度最快的方法。随着现代分子生物学技术的发展,出现了很多分子诊断方法,如聚合酶链式反应(PCR)技术、核酸探针杂交技术、荧光定量PCR技术和环介导等温扩增(LAMP)技术等[1]。这些技术的发展促进了临床病原体检测的精准化,在常见感染的诊断方面发挥了巨大的作用,但对于一些起病急、进展快的感染性疾病,在发热门诊、急诊手术等场景下,要求核酸检测随到随检、快速报告,因此,病原体核酸床旁检测技术应运而生[2]。
床旁检测(Point of Care Testing,POCT),又称“即时检测”或“近患检验”,是指在患者附近或其所在地进行的、其结果可能导致患者的处置发生改变的检验[3]。而核酸床旁检测(Nucleic acid-based POCT,NA-POCT)则是指将分子生物学技术与POCT结合,在实现“提取-扩增-检测”整合一体化的同时,还兼具操作简单、全密闭化、便携、快速等适用于多种场景的特点[4]。也可将其称为分子POCT[4]或封闭式全自动一体化系统[5]。
NA-POCT与传统核酸检测相比,NA-POCT具有流程简化、精确度高、生物安全风险低和操作简便等优势,部分种类的仪器还实现了样本随到随检,不需要样本等待时间[5];可适用于急诊、发热门诊,常规实验室、临床实验室及基层医疗机构等多种应用场景。然而NA-POCT系统的应用也给临床实验室带来了一些新的问题和困惑[5],如是否需要在生物二级安全实验室开展检测、是否需要专业人员操作、如何进行性能验证和质量控制、如何进行复检等。为解决部分疑问及困惑,本文针对NA-POCT检测技术、应用场景、管理规范/技术要求、性能验证/质量控制、结果分析/报告审核等方面的内容进行论述。
一、NA-POCT概念
目前NA-POCT没有明确的定义,但是不同学术组织都提到过NA-POCT的概念。中国医学装备协会基因检测分会等发表的《新型冠状病毒核酸快速检测临床规范化应用专家共识》对理想的NA-POCT检测应具备的特性进行了阐述:可以实现采样后,直接在同一封闭的便携式、一体化仪器上完成检测,操作简便,且样本检测全过程所需的时间明显短于常规新冠核酸检测[6]。上海市医学会分子诊断专科分会等发表的《病原体核酸即时检测质量管理要求专家共识》对于NA-POCT的描述为“分子生物学技术和POCT的结合,在实现“提取-扩增-检测”整合一体化的同时,还兼具便携、操作简易、快速、密闭、适用于多种场景的特点”[2]。江苏省医学会检验学分会发表的《新型冠状病毒核酸全自动PCR检测系统临床应用江苏专家共识》定义了新型冠状病毒核酸全自动PCR检测系统是指样本识别和转移、核酸提取和纯化、体系构建、基因扩增和检测全流程自动化的核酸检测系统[5];并分为一体化随机处理式、一体化批处理式和组合型批处理式系统。
二、感染性疾病NA-POCT产品和应用场景
根据待检测病原体类型和预期用途,感染性疾病NA-POCT最常见应用于细菌耐药基因鉴定、病毒定性和定量检测、性传播疾病病原体感染筛查等领域。
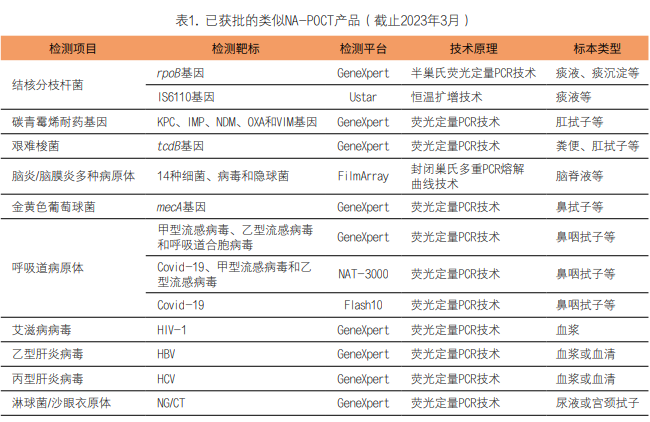
1.国内已获批类似NA-POCT产品情况:截止2023年3月,国家药监局(NMPA)已经批准十余款可作为NA-POCT的检测产品(见表1)。
2. NA-POCT应用场景:上海市医学会分子诊断专科分会等发表的《病原体核酸即时检测质量管理要求专家共识》中将病原体NA-POCT应用场景描述为急诊、发热门诊、儿科门急诊、检验科/第三方检验所、特定病区等[2](见表2)。
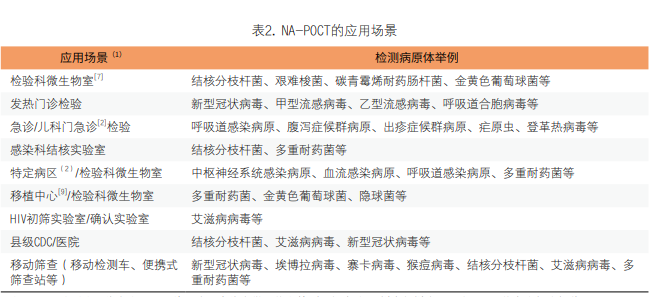
注:(1)除所注明临床应用场景外,均适合临床微生物室检测,标本处理/样本加样步骤需在II级生物安全柜中操作。
(2)特定病区指医院特殊防控要求的病区,例如定点收治医院闭环管理的传染病病区、重症监护室等。
三、NA-POCT管理规范及技术要求
(一)管理规范及要求
1. NA-POCT临床应用管理规范:NA-POCT临床应用管理规范目前国内并无明确的文件规定,既不同于传统手工PCR繁琐操作和气溶胶污染风险,也不同于血液理化指标的POCT技术要求。NA-POCT在实现POCT化的同时并未对检测指标的灵敏度和特异性产生影响,因此其对于产品出厂的设计要求、质控要求更高;这也使得NA-POCT产品的临床应用管理不同于传统的核酸检测项目,目前各地已陆续有相关专家共识报道[2-7]。
NA-POCT应在符合国家和地方生物安全法规,以及医院感染管理条例的前提下开展病原体NA-POCT[10-12]。NA-POCT系统为整合一体化封闭系统,其样本处理、核酸提取及扩增检测均在封闭空间中进行,可有效防止生物样本及其遗传物质污染环境。因此NA-POCT的检测环节对检测人员构成的风险较小,但是在标本采集及标本加入试剂盒环节,操作者会直接接触样本,仍存在病原体暴露风险,除了严格按照产品说明书操作,为降低气溶胶的形成、溢出和暴露风险,检测区域应至少具备II级生物安全柜等二级生物安全实验室必须设备[2],保证有传染风险的标本前处理(例如痰的液化处理、标本分装等)符合生物安全防护要求。
中国医院协会临床微生物实验室专业委员会等[7]《中国临床微生物实验室应对重大传染病疫情能力建设指导原则》提出我国临床微生物实验室迫切需要加强分子生物学平台建设,建筑空间允许的医疗机构可在微生物实验室内建立标准的PCR试验区[8],没有建筑空间的医疗机构可优先选配“样本进、结果出”的自动化分子检测设备,以及针对特殊病原体检测的小型床旁即时分子检测设备(如一体化多重PCR检测仪、微流控芯片检测仪)等。中国医师协会器官移植医师分会等[9]《中国实体器官移植手术部位感染管理专家共识(2022版)》建议各移植中心根据自身条件,采用以mNGS和POCT为代表的新型诊断技术,以早期、快速和准确地对手术感染部位病原体进行诊断。江苏省医学会检验学分会等[5]《新型冠状病毒核酸全自动PCR检测系统临床应用江苏专家共识》提出“采用全自动一体化检测系统进行新冠病毒核酸检测时,实验室可进行区域的适当合并;如果该系统与传统新冠病毒核酸检测系统并存,则应单独分区,且试剂和耗材应储存在清洁区”。
2.NA-POCT的操作人员要求:尽管POCT的性质决定其可以在非临床检验中心/检验科的实验室开展,非专业人士经过简单培训即可操作,但鉴于核酸检测技术的特性及对报告的结果解释,操作NA-POCT仍需要具有临床检验资质的检验技术人员,经培训合格后方可上岗检测并出具检验报告[2]。也有专家[5]认为:任何病原体NA-POCT均需由同时具有临床检验资质和临床基因扩增上岗证的技术人员完成。
3. 国外对NA-POCT的管理规范:美国食品和药品管理局(FDA)发布的临床实验室改进修正案(CLIA)[13]将检测产品的复杂程度由低到高分为三个等级:豁免(最简单), 中度复杂和高度复杂。在审核产品的510K或者PMA的时候,FDA会对体外诊断检测进行CLIA分类。FDA通过审核产品的说明书来决定产品的复杂程度,并采用记分卡标准进行评分。FDA将体外诊断产品分为豁免的前提是:产品使用操作简单,并且提供错误信息的可能性小,或者在操作错误的情况下产生伤害的概率低。通过FDA许可或批准的家用或非处方产品一般会被自动分为豁免等级。2013年世界卫生组织WHO发布的《结核病实验室手册》中将使用自动化核酸扩增检测试剂盒进行标本前处理过程的Xpert MTB/RIF技术评估为低风险[14];2019年,WHO对HIV POCT病毒载量检测和婴儿早期诊断的质控提出了要求。2021年颁布了新版的HIV预防、婴幼诊疗和检测的指南更新建议HIV POCT核酸检测应用于诊断18个月以下婴儿和儿童,并表示当专业人员能力有限时,应与非实验室人员分担标本采集和POCT监测的任务[15]。
(二)NA-POCT技术要求
长期以来,大多数人认为NA-POCT技术在兼顾便携、快速等特点时,降低了检测试剂的灵敏度和特异性,但实际本文所述的NA-POCT技术均是以保证等效或优于传统PCR检测的性能,为此对于NA-POCT试剂盒和设备的要求则更高,技术集中度、过程可控化及相关生产能力提出了新的要求。
1.试剂及仪器集成化:NA-POCT理想状态下应该实现“现场、即时、简单”,这主要受制于标本类型、检测方法和仪器平台等的限制[16],可见NA-POCT系统主要应用于没有专业实验室的一般检验场景,为保证实验室检测结果质量和效率,必须尽可能将NA-POCT进行试剂集成化和仪器集成化,这是因为NA-POCT产品通常由没有经过专业培训的实验室人员来负责操作,在某些情况下,实验技师因为缺乏足够的专业培训时间和实验室经验,可能引发样本污染和不当操作,而导致最终诊断错误。因此选择简单无需专业技师复杂操作的NA-POCT诊断系统不仅可以保证结果可靠性,还可以减轻工作人员的压力与暴露风险。
为了改进仪器的便携性,许多检测方法将反应过程和体系改进为集成性更好的微流控平台,反应盒中的试剂以冻干或玻璃化的状态保存在不同舱室,以便做到常温运输和储存,使之更适合于目标场景中(例如社区医院、急诊室、重症监护室床旁等)[16]使用。
2. 过程可控化:NA-POCT需要充分考虑检验前、检验中和检验后全流程的自动化控制,以及根据技术特性在不同的节点设置相关的数据监测点,以保证结果的可靠性。例如样品体积不符合检测要求、抑制物影响、仪器故障、检测试剂盒失效等应有相关检查及质控要求。
四、NA-POCT性能验证及质量控制
1.NA-POCT系统的性能验证:NA-POCT系统在检验程序常规应用之前或任何严重影响检验程序分析性能的情况发生后,应在检验程序重新启用前对受影响的性能进行验证。性能验证样品的选择应满足可溯源性、适用性、均质性特点[17], 定性检测的验证内容包括:符合率验证、检测限(LOD)验证和交叉反应。定量检测的验证内容包括:正确度、精密度、线性区间和定量限(LOQ)验证[17]。
2. 室内质量控制:实验室应进行室内质量控制,以监控检测过程的稳定性。应制定室内质量控制程序,程序中应有针对核酸检测中防污染的具体措施。
NA-P0CT检测通常每个样本都包含一个内部对照(内标),而外部质控品(应包括阳性和阴性)作为单独的样本运行。内标在控表明正确提取了患者样本,这是获得正确结果的必要步骤。外部质控品则评估检测系统是否提供正确结果。完整的室内质控程序可以控制检测过程、评价检测系统性能,提供质量保证[2]。
内建完整质控体系的分子检测项目适用的相关规范为“个性化质量控制计划”(Individualized Quality Control Plan,IQCP),IQCP允许实验室根据测试方法和用途、环境和人员能力来制定其质量控制计划,同时提供等效的质量测试,具体质控流程及质控频率可参考产品说明书或根据实际情况制定。
3. 室间质量评价:实验室应按时参加国家临床检验中心或省/市相关机构组织的室间质量评价活动,以监控检测过程的准确性。实验室对不合格的室间质评结果应进行分析并采取纠正措施,并记录。对暂无室间质评的P0CT检测项目,应至少每年2次通过与其他实验室比对的方式,判定检测结果的可接受性[2]。
五、NA-POCT结果分析和报告审核
NA-POCT的结果判读规则应在实验室性能满足要求的基础上,参考检测试剂说明书进行。结果的输出、阅读和解释(即检验后流程)应该清晰明了,不需要进一步解释,例如“检测到/未检测到病原体”或“存在/不存在突变”。而更复杂的结果解释(例如多重PCR的结果)最佳的方式是由临床医师、专门从事微生物学的检验医师等组成多学科诊疗团队(multi-disciplinary team,MDT)共同解读。如果NA-POCT在实验室以外进行检测,分析结果可立即自动传输到实验室信息系统,以整合患者的临床病史资料,联合血常规、感染相关标志物、微生物培养等其他实验室检测项目结果,进行综合解释[18]。
无论系统是否设置自动报告程序,均需经人工判断和审核后报告,仪器结果判读阈值线应始终与说明书保持一致,且不支持随意手动调整,对于检测结果不确认或无效的样本立即启动实验室复检规则,符合结果报告要求后方能报告。
六、小结
核酸床旁检测结合了分子检测的高灵敏度和POCT的快速、简便的特点,在感染性疾病诊疗现场的检测和高危人群的筛查方面有较好的应用价值。本文综述了当下NA-POCT在感染性疾病领域的应用场景、获批产品以及国内外相关的规范标准,同时对NA-POCT技术要求进行了提炼,对于检测结果的质量保证措施及结果分析审核发放进行了整理。NA-POCT技术作为分子检测领域的新兴技术,在解决感染性疾病快速检测、应对突发疫情等场景具有“现场、即时、简单”的优势。但也受限于法律法规的不完善,临床在应用NA-POCT解决实际问题时,仍然面临着诸多困境,希望本文综述内容能够起到一定的指引作用。随着检测技术的成熟、NA-POCT仪器和试剂等检测成本的进一步下降以及分级诊疗的开展,有望在门急诊等医院科室或基层医疗机构快速搭建病原体核酸检测平台,有助于感染性疾病的快速、精准防控和诊疗。
参考文献
Geller Gail. “Genomics and infectious disease: a call to identify the ethical, legal and social implications for public health and clinical practice.” Genome medicine vol. 6, 11 106. 18 Nov. 2014, doi:10.1186/s13073-014-0106-2.
上海市医学会分子诊断专科分会, 上海市医学会检验医学专科分会, 上海市微生物学会临床微生物学专业委员会, 上海市临床检验中心. 病原体核酸即时检测质量管理要求专家共识[J]. 中华检验医学杂志, 2021, 44(11): 1021-1028. DOI:10.3760/cma.j.cn114452-20210712-00428.
ISO 22870: 2016 Point-of-care testing (POCT)-Requirements for quality and competence. https://www.iso.org/standard/71119.html.
Larkin PMK, Garner OB. Molecular point-of-care testing in clinical laboratories. Clinical Laboratory News. 2020. https://www.aacc.org/cln/articles/2020/july/molecular-point-of-care-testing-in-clinical-laboratories.
江苏省医学会检验学分会, 江苏省临床检验中心. 新型冠状病毒核酸全自动PCR检测系统临床应用江苏专家共识[J]. 临床检验杂志, 2022, 40(11): 801-807. DOI:10.13602/j.cnki.jcls.2022.11.01.
中国医学装备协会基因检测分会, 中国医学装备协会现场快速检测(POCT)装备技术分会,国家医学检验临床医学研究中心, 国家卫生健康委能力建设和继续教育中心检验医学专家委员会分子学组, 北京市医学检验质量控制和改进中心. 新型冠状病毒核酸快速检测临床规范化应用专家共识[J]. 中华检验医学杂志, 2021, 44(8): 698-702. DOI:10.3760/cma.j.cn114452-20210425-00266.
中国医院协会临床微生物实验室专业委员会. 中国临床微生物实验室应对重大传染病疫情能力建设指导原则[J]. 中国医院, 2020, 24(8): 18-22. DOI:10.19660/j.issn.1671-0592.2020.08.06.
卫生部办公厅. 医疗机构临床基因扩增检验实验室管理办法. 卫办医政发[2010]194号. 2010-12-06.
中国医师协会器官移植医师分会, 中华医学会器官移植学分会. 中国实体器官移植手术部位感染管理专家共识(2022版)[J]. 器官移植, 2023, 14(1): 11-23, 48. DOI:10.3969/j.issn.1674-7445.2023.01.002.
中华人民共和国卫生行业标准. 病原微生物实验室生物安全通用准则(WS233-2017) (2017-7-24). http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXxgk.htm?id=fe13dab151cd42f18ee546c380fe7292.
中华人民共和国国务院. 中华人民共和国生物安全法 ( 2013-06-29). http://www.nhc.gov.cn/fzs/s3576/201808/6d00c15884f42c5bcf94993bffa665a.shtml.
中华人民共和国国务院. 病原微生物实验室生物安全管理条例(国务院令第424号. http://www.gov.cn/zhengce/content/2008-03/28/content_6264.htm.
Clinical Laboratory Improvement Amendments(CLIA). https://www.fda.gov/medical-devices/ivd-regulatory-assistance/clinical-laboratory-improvement-amendments-clia.
世界卫生组织.《结核病实验室手册》2013版. http://www.who.int/about/licensing/copyright_form/en/index.html
World Health Organization 2021 Guidelines HIV prevention, infant diagnosis, antiretroviral initiation and monitoring. https://www.who.int/news-room/fact-sheets/detail/hiv-aids.
张嘉威, 欧启水. POCT分子诊断检测技术在感染性疾病诊断中的应用与临床应用范围. 临床实验室. 2022. 3. 37-38.
中华人民共和国卫生行业标准. 临床微生物培养、鉴定和药敏检测系统的性能验证(WS/T807-2022).
吴晓翠, 马坚, 汤一苇, 余方友. 分子诊断床旁检测技术在感染性疾病中的临床应用. 临床实验室. 2022. 3. 41-42.




