气单胞菌属致病性与实验室分子诊断新技术临床应用


朱庆义,主任技师、教授,享受国务院政府特殊津贴。曾任山西省儿童医院分子微生物学研究室主任。从医近70年间,承担和完成WHO、UNICEF、国自然、卫生部和省科委等30多项科研项目,获省部级科技进步奖共28项,主编和参与编著《军团菌和军团菌病》、《妇产科感染与病原学诊断》、《口腔微生物学》、《小儿腹泻病学》等专著10部,发表科研论文300余篇,SCI论文30多篇,2019年在国际系统与进化微生物学杂志发表《中国分离庆义军团菌新种》(Legionella qingyii sp. nov., isolated from water samples in China)一篇,在小儿腹泻病原学和军团菌快速诊断研制方面做出重要贡献。

苏珍萍,主管检验师,毕业于兰州大学医学检验专业,主要从事临床生化检验、血液细胞形态学工作,有实验室全程质量管理的经验。现任深圳金域医学检验实验室副经理,负责实验室全面质量体系运营与管理工作。主要社会兼职:中国医学装备协会医疗器械行业协会POCT分会委员;中国医药质量管理协会医学检验专业委员会质量与能力认可认证学组第一届委员、流式与细胞鉴定质量管理学组第四届委员。
【摘要】气单胞菌普遍存在水生环境和食品中,是一种重要的水生、人畜共患病新发病原菌。目前已知有36个种,与人类疾病有关的主要是嗜水气单胞菌、豚鼠气单胞菌和维氏气单胞菌。本文简要的概述了气单胞菌属的生物学特性,致病性,及其实验室诊断新技术。采用常规细菌分离培养和16S rRNA基因测序鉴定,成本高、技术难度大,又费时。采用荧光定量PCR和MALDI-TOF MS诊断新技术,对气单胞菌种属水平鉴定95%以上可取得准确结果,这对预防和控制气单胞菌属感染病的病原学诊断,指导临床正确用药治疗具有重要指导意义。
【关键词】气单胞菌属;致病性;诊断新技术
气单胞菌属(Aeromonas species)根据16S rRNA和5S rRNA基因序列分析和DNA杂交归属气单胞菌科(Aeromonadacae),目前已知有36个种,按生长特征和生化成分分3个群,包括嗜水气单胞菌(A. hydrophila), 豚鼠气单胞菌(A. caviae)和温和气单胞菌(A. sobria)。模式菌为嗜水气单胞菌,有5个亚种,包括嗜水气单胞菌嗜水亚种(A. hydrophila subsp. hydrophila),嗜水气单胞菌无气亚种(A. hydrophila subsp. anaerogenes),嗜水气单胞菌德氏亚种(A. hydrophila subsp. dhakensis),嗜水气单胞菌解蛋白亚种(A. hydrophila subsp. proteolytico)和嗜水气单胞菌蛙亚种(A. hydrophila subsp. ranaed);杀鲑气单胞菌(A. salmonicida)也有5个亚种,而斑点气单胞菌(A. punctata)只有2个亚种[1, 2]。与人类疾病有关的主要是嗜水气单胞菌(A. hydrophila)、豚鼠气单胞菌(A. caviae)、简氏气单胞菌(A. jandaei)、舒氏气单胞菌(A. schubertii)、肠棕气单胞菌(A. trota)和维氏气单胞菌(A. veronii),后者包括维氏气单胞菌维氏亚种(A. veronii subsp. veronii)和维氏气单胞菌温和亚种(A. veronii subsp. sobria)[3, 4]。
一、致病性
嗜水气单胞菌普遍存在水生环境和食品中,是一种重要的水生、人畜共患病新发病原菌[5, 6]。在人类中,嗜水气单胞菌不仅会引起胃肠炎和皮肤感染,而且还会引起多系统性疾病,如腹膜炎、败血症、脑膜炎、胆道、泌尿生殖道疾病、溶血性尿毒症综合征和坏死性筋膜炎[7]。其致病性与其毒力基因所产生的细胞毒素,菌体的分泌系统,以及细菌对宿主的粘附性和侵袭性等致病因素密切相关,该菌主要的毒力因子是肠毒素[8],包括类霍乱毒素(CT)和类大肠埃希菌不耐热毒素(LT)等。
1.毒力基因和毒素:嗜水气单胞菌产生多种毒力基因,包括气溶素基因(aerA)、溶血素基因(hlyA)和丝氨酸蛋白酶基因(ahpA)等,这些是致病性嗜水气单胞菌的主要毒力基因,均可成为引起腹泻的致病因素。嗜水气单胞菌所产生的毒力因子,目前发现的有外毒素、蛋白酶、S层、菌毛、转铁蛋白和外膜蛋白等。其中外毒素是重要的致病因子,已确定的外毒素有气溶素(aerolysin)、溶血素(hemolysin)、溶血毒素(hemolytic toxin)和细胞毒性肠毒素(cytolytic enterotoxin)、 组织毒素(histotoxin)、坏死毒素(necrotoxin)、肠毒素(enterotoxin)和蛋白酶(protease)等[9]。国内,涂小林等取嗜水气单胞菌产生的溶血素(hemolysin)、肠毒素(enterotoxin)和细胞毒素(cytotoxin)3个英文词的第一字母,命名为HEC毒素[10]。国际上公认的外毒素名称为气溶素(Aer毒素)。Aer毒素是单个分子的多肽,分子量约为52.5kDa,具有溶血性、肠毒素毒性和细胞毒性,抗胰酶,不耐热,与霍乱抗毒素不产生交叉作用,对Vero-细胞Hela-细胞有明显的毒性。
嗜水气单胞菌的5种主要毒力基因,包括气溶素(aerolysin,aer)、溶血素(haemolysin,hly)、丝氨酸蛋白酶(serine protease,ahp)、耐热性细胞肠毒素(heat-stable cytotonic enterotoxin,ast)和不耐热细胞肠毒素(heat-labile cytotonic enterotoxin,alt)等[11],通过比较其毒力基因的分布与其对鱼类的致病性试验,发现aerA、ahpA为嗜水气单胞菌致病的主要毒力因子,astA与致病力存在一定相关性,但不是主要毒力因子,hlyA、altA与致病性相关。
2. 粘附性和侵袭性:嗜水气单胞菌引起的感染性腹泻,与其对宿主上皮细胞的粘附性和侵袭性密切相关。Aer毒素结合到肠上皮细胞膜上的腺苷酸环化酶,导致细胞内AT转化为cAMP,致使肠道水电介质平衡失调,肠黏膜分泌大量水和电解质,引起水样便腹泻。细菌通过肠道的感染力取决于菌体对肠道组织粘附力的强弱,并且与菌株种类有关,通常具有高粘附力的嗜水气单胞菌株才能产生毒性很强的外毒素。
3. 分泌系统:嗜水气单胞菌具有Ⅱ型、Ⅲ型、Ⅳ型和Ⅵ型分泌系统(分别为T2SS、T3SS、T4SS和T6SS)以及外毒素和内毒素等多种毒力因子[12]。此外,该菌产生生物膜的能力也威胁到食品工业的安全[13]。在致病性德氏气单胞菌(Aeromonas dhakensis)中发现了首个能够自我剪切的T6SS效应蛋白TseI,通过多种生化和遗传突变实验,发现TseI表达时能够自剪切为3个片段(N、Rhs和C)。C端是一个核酸酶毒素,N端和Rhs在剪切后能够作为伴侣蛋白与C端毒素非共价结合,在N端和Rhs的辅助作用下,C端毒素能够通过T6SS分泌到受体细胞内至其死亡,现把TseI及其同源蛋白定义为一类新型的含分子内伴侣的自剪切效应蛋白。
二、发病机制
嗜水气单胞菌的致病性和发病机制具有复杂性和多因素性,包括O抗原、荚膜、脂多糖(LPS),表面层蛋白(S-layer),横向诱导菌毛和铁结合系统(iron-binding systems);细胞外毒素包括溶血素和肠毒素,如细胞毒性肠毒素,Ⅱ型分泌系统(T2SS)和酶类,包括蛋白酶、淀粉酶、脂酶,ADP-核糖聚合酶(ADP-rRNases)和DNA酶(DNases);菌细胞还具有Ⅲ型分泌系统(T3SS),可将4个效应蛋白导入目标宿主细胞,以及Ⅵ型分泌系统(T6SS)相关的毒力因子,可促进细菌毒性的分泌器官[14]。
嗜水气单胞菌致病作用分两步:第一步细菌先在小肠黏膜细胞上粘附,并在其表面定居、繁殖,这阶段主由细菌的特殊菌毛完成;第2步产生肠毒素:一种不耐热毒素(LT),其结构、致病机制和免疫学性质与霍乱毒素相似。已知有A、B两个亚单位,其中B能连接小肠上皮细胞GM(神经节苷脂),便于亚单位A进入细胞发挥其生物学作用:活化细胞上的腺苷酸环化酶,使ATP转化为cAMP,导致细胞内cAMP明显增高,引起肠道水分和氯化物分泌过多,并抑制钠的再吸收,肠液分泌过多,肠蠕动增剧,而泻出大量水样便[15]。另一种为耐热毒素,其活性部分分为STa和STb,刺激鸟苷环化酶,使GTB转化为cGMP,细胞内cGMP增高,氯化物吸收减少,引致肠液分泌增多。
嗜水气单胞菌的致病机制是Aer毒素的肠毒性机制,与霍乱毒素相似,Aer毒素结合到肠上皮细胞膜上的腺苷酸环化酶,导致细胞内ATP转化为cAMP,致使肠道水电解质平衡失调,肠腔积液。此外,嗜水气单胞菌II型分泌性肠毒素Act,具有溶血活性和破坏小肠上皮细胞两种细胞毒肠毒素(Alt和Ast),各种溶血素AerA,HlyA,Ahhl,Aasl可增加cAMP分泌。首先是内毒素与上皮细胞刷状缘上的受体结合,继而激活了肠黏膜细胞内的腺苷环化酶,使细胞内第二信使cAMP、cGMP和钙离子增加,使细胞内水与氯向肠腔内分泌增加,每小时可达1~2L。大量的液体不能被小肠及大肠黏膜吸收,则必然导致腹泻。
三、临床表现
嗜水气单胞菌引起的感染类型与弧菌属细菌相似,常见的是胃肠炎,多发于儿童,是夏季腹泻的常见病原菌。临床上有轻度的腹泻,也有严重的痢疾样腹泻(血样便),成人多表现为慢性感染。其主要致病物质为细胞毒素和溶血毒素,肠道外感染主要为伤口感染和菌血症[16],90%以上的菌血症由嗜水气单胞菌和维氏气单胞菌所引起,多发生于免疫力低下的人群。
1. 嗜水气单胞菌感染性疾病的4大特点:(1)感染谱广,能够引起淡水鱼细菌性败血症,蛙类红腿病,甲鱼红脖子病、红底斑病、穿孔病、洞穴病、腐皮病等,人感染后可引起腹泻。(2)流行范围广,遍及大江南北等多个省市, 且有扩大蔓延的趋势。(3)发病季节长,从4月一直持续到11月, 夏季为高峰期。(4)死亡率比较高[17]。该病传染迅速, 若不及时控制, 可造成毁灭性的损失。
2. 急性胃肠炎:潜伏期约1~2日,症状多较轻,低热或不发热,腹泻呈水样稀便,有腹痛而无里急后重,个别患者腹泻严重类似霍乱[18]。2岁以下儿童可表现为痢疾样症状,大部分病例经2~5日自愈,重症可持续1~2周。虽然胃肠道是迄今为止气单胞菌最常见的病变,但作为人类细菌性腹泻的病因及其相对重要性,在很大程度上为急性细菌性胃肠炎的常见病因所证实。
3. 血源性感染:气单胞菌属的典型侵袭性疾病是败血症。Conn(1964)等首先报告1例拉埃内克氏肝硬化(Laennec cirrhosis)引发嗜水气单胞菌败血症和腹膜炎。随后,von Graevenitz(1968)等报告了2例患有胆汁性肝硬化的成人气单胞菌感染败血症[19]。关于气单胞菌败血症,在培养证实的脓毒症病例中,除了嗜水气单胞菌,还有简氏气单胞菌、维氏气单胞菌和舒氏气单胞菌成为感染病原体。
4. 皮肤和软组织感染:气单胞菌感染与多种皮肤和软组织感染有关,从轻微的局部感染如脓疱损害到严重或危及生命的感染。常见的皮下组织感染(蜂窝织炎),可累及皮肤深层和皮下组织,并沿筋膜平面扩散(坏死性筋膜炎),造成严重的肌肉组织损伤(肌坏死)[20]。坏死性筋膜炎或肌坏死继发性后遗症,包括关节和骨骼炎症和播散性侵袭性疾病引起感染性休克。
5. 腹腔感染:腹腔内感染是指感染从起始的空腔内脏扩散到腹膜腔,这些感染包括胰腺炎、急性胆管炎、肝脓肿以及腹膜炎。大多数腹腔内感染是社区获得性的,多见于有一种或多种潜在疾病的中年男性[21]。原发性腹膜炎比较少见,它是由于血液或淋巴液感染扩散到腹膜引起的;继发性腹膜炎是最常见的形式,原因是胆道或胃肠道感染的扩展,最常见于肝病患者和菌血症患者,100%腹水培养为单菌种。继发性腹膜炎,腹膜培养是多菌性的,通常涉及其他G-菌,如大肠埃希菌和肺炎克雷伯菌,原发性和继发性病例的归因死亡率分别为23%和15%。
6. 其他感染:气单胞菌偶尔会在各种住院患者中出现呼吸道感染,在痰液或其他呼吸道分泌物中,分离到气单胞菌。此外,气单胞菌引起泌尿生殖道感染UTIs),Hsueh等报告维氏气单胞菌和波氏气单胞菌引起的尿道感染,通常与更换导尿管有关,尿液培养检出波氏气单胞菌[22]。气单胞菌眼部感染可引起眼内炎、角膜炎和角膜溃疡等眼部疾病,与戴隐形眼镜有关。
四、实验室诊断
1. 常规检验:细菌涂片染色,镜检,观察细菌形态为G-,单个菌排列,杆状,具单极鞭毛,能运动。(1)分离培养与鉴定:腹泻患者采集粪便或肛拭子,置运送培养基送检,肠道外感染采集血液、脓液等。(2)分离培养:急性腹泻患者粪便及脓液标本可直接接种血平板或麦康凯平板,于35℃培养。除豚鼠气单胞菌外,大多数致病性菌株在血平板中有β溶血现象,菌落较大、圆形、凸起、不透明。含菌量较少的标本可用碱性蛋白胨水增菌后再分离培养。
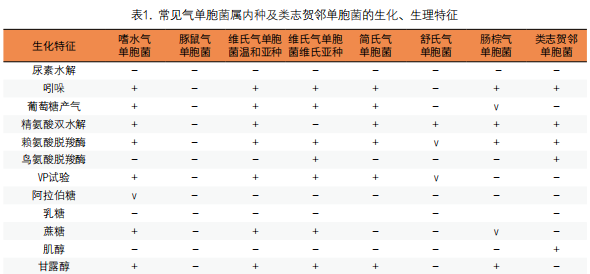
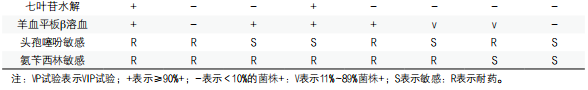
2. 生化鉴定:氧化酶和触酶阳性,发酵葡萄糖和其他碳水化合物,产酸或产酸产气,还原硝酸盐,在无盐培养基上生长可与弧菌属相鉴别,常见气单胞菌属内种及类志贺邻单胞菌的生化、生理特征见表1[23]。临床常见的嗜水气单胞菌和豚鼠气单胞菌能发酵阿拉伯糖,而其他气单胞菌均为阴性,前者VP试验和赖氨酸脱羧酶试验阳性,而后者均为阴性。维氏气单胞菌维氏生物亚种的特点是鸟氨酸脱羧酶和赖氨酸脱羧酶均为阳性。
3. 分子诊断
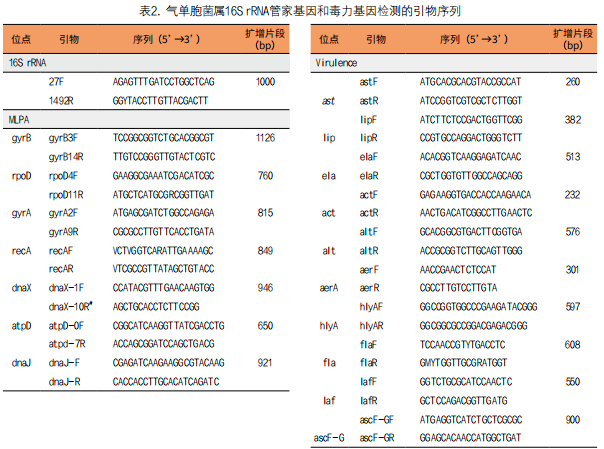
(1)多位点系统发育分析检测毒力因子:采用多位点序列分型(Multilocus sequence typing,MLST)是一种基于核酸序列测定的细菌分型方法[24, 25],通过PCR扩增多个管家基因内部片段,测定其序列,分析菌株的变异,从而进行分型,具有操作简单,快速,用于多种细菌的流行病学监测和进化研究,成为细菌分子流行病学研究的一种重要方法。Roger[26]等报告采用MLPA法研究有关气单胞菌种的种内和种间系统发育,包括7个单基因片段(gyrB,rpoD,recA,dnaJ,gyrA,dnaX和atpD)的独立分析,引物序列见表2,作常规PCR扩增反应。PCR扩增反应体系总体积为40µL,其中Taq PCR MasterMix(2倍)20µL,引物1µL 10µmol/L,DNA模板1µL(~30-40ng),dd·H2O 17µL,置PCR扩增仪。反应条件:首先于95℃ 5min变性,随后进入循环:95℃ 30s→ 55℃~60℃ 30s→72℃ 1min,共30个循环,最后72℃延伸7min,对PCR产物进行测序鉴定,以进一步确认。
国内周妍妍等报告[26],于2017年,4~10月,在肠道门诊腹泻患者采集粪便标本进行气单胞菌分离培养,以非腹泻粪便标本作为正常对照,对气单胞菌进行MLPA分型。结果在2,038份急性腹泻标本检出气单胞菌163例,分离率为8.0%。气单胞菌经MLPA分8个种,以维氏气单胞菌和豚鼠气单胞菌为主,分别为52.8%和38.0%。该研究表明北京地区与腹泻相关的气单胞菌主要是维氏气单胞菌和豚鼠气单胞菌,嗜水气单胞菌在腹泻病人粪便分离率较低。运用MLPA对气单胞菌进行分型,有助于预防和控制气单胞菌相关性腹泻发生及流行。
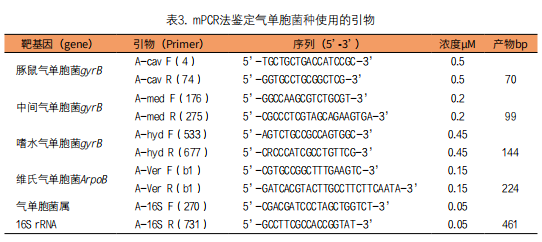
(2)多重PCR分型鉴定单胞菌种属:多重PCR(multiplex PCR,mPCR)是在同一PCR反应体系中加多条引物,可同时扩增出多个核酸片段,主要用于多种病原微生物同时检测或对某些病原微生物进行分型鉴定,以提高其检出率,并同时鉴定其型别和基因突变菌株。Persson等应用mPCR法,针对gyrB和rpoB基因,设计了4对引物鉴定嗜水气单胞菌,中间气单胞菌,维氏气单胞菌和豚鼠气单胞菌等4个气单胞菌种,另设一对通用引物鉴定气单胞菌属(见表3)[27]。该法对腹泻患者分离的51株气单胞菌,取其培养物在10% Chelex 100-10mmol/L Tris-HCl和1mM EDTA(pH8)缓冲液中煮沸10min,提取DNA作PCR扩增检测gyrB和rpoB基因。PCR扩增在25µL反应混合物中含1.5µL模板,4×dNTP(各0.2mmol/L),2.0mmol/L MgCl2和1.25 U Platinum Taq DNA聚合酶;引物浓度如表1所示。mPCR程序:预变性95℃ 2min,进行预扩增(94℃ 40s→67℃ 50s→72℃ 40s)×6,然后再扩增(94℃ 40s→65℃ 50s→72℃ 40s)×30,扩增产物作凝胶电泳分型鉴定。
Wang等采用mPCR法检测嗜水气单胞菌、维氏单胞菌和温和气单胞菌的溶血素基因和气溶素基因[28]。对121株临床分离的气单胞菌和7株参比菌株,根据mPCR检测结果,分为5个基因型:分别为ahh1基因1型,asa1基因2型,同时携带ahh1和asa1基因的3型,携带ahh1基因和嗜水气单胞菌aerA(溶血素)基因的4型,未检测到溶血素基因的5型。在所有检测的气单胞菌分离株中,最常见的单一溶血素基因是ahh1, 128个分离株中有99个(77%)。这些分离株在Vero细胞培养中具有更强的细胞毒性。采用mPCR进行气单胞菌种属鉴定对临床和流行病学调查提供了一种简单、精确而实用的方法,对这类感染性疾病的监测,早期诊断和预防至关重要。Algammal等采用mPCR法检测维氏单胞菌的毒力基因(aerA、ser、act、alt、ahp、nuc和ompAII)以及抗生素耐药基因(blaTEM,blaSHV、blaCTX-M、aadA1、sul1和tetA)[29],对临床采取有效抗生素治疗,合理用药具有重要指导作用。国内张静等报告优化mPCR反应体系检测嗜水气单胞菌16S rRNA、ast、alt、aerA、act 5个毒力基因[30],引物浓度最优配比为1:2:2:3:4。DNA提取采用单菌落煮沸冷冻离心法。利用菌落多重PCR可以不通过试剂盒抽提获DNA模板,简便、快速、直观地检测嗜水气单胞菌及其毒力基因,具有良好的特异性。
(3)实时荧光定量PCR(Quantitative Real-time PCR,rt-PCR):是一种在DNA扩增反应中,通过荧光信号,对PCR产物进行实时检测。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,而成为定量检测的依据。王蓉等报告利用rt-PCR技术,建立一种快速、特异、灵敏、定量检测嗜水气单胞菌的方法,用于检测病人腹泻物或水产品病变部位的气单胞菌[31]。该法以GenBank中嗜水气单胞菌WP3溶血素基因(hlyA)为靶序列,设计引物与TaqMan探针(表4),并对模板DNA制备方法,PCR反应时间和温度进行优化,以嗜水气单胞菌ATCC 7966和20株相关细菌考核检测体系的特异性、灵敏性和重复性。结果显示,该法检测时间仅需30min,定量线性范围5.4×103~5.4×108cfu/mL,它与20株常见肠道细菌均无反应,这显示其良好的敏感性和特异性。高建忠等以嗜水气单胞菌气溶素(aerolysin)基因为待检靶基因,设计引物和MGB探针,建立并优化了检测嗜水气单胞菌Aero基因的rt-PCR法[32],可检测最低细菌数1.25×100cfu/µL,为致病性嗜水气单胞菌提供了一种简便、快速的检测法。Wong等报告检测嗜水气单胞菌β-溶血毒素hlyA、aerA毒力基因[33]。

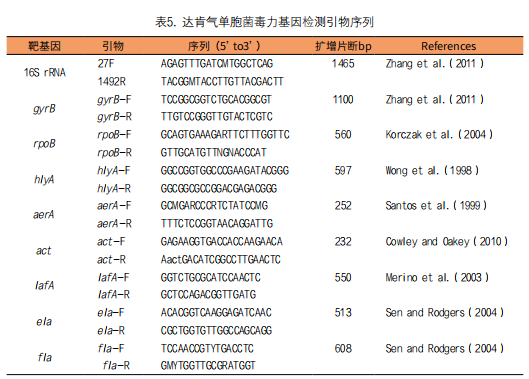
Jin等报告[34],从一只死于细菌感染引起败血症的海狮(Zalophus California anus)器官组织中分离到一株气单胞菌新种,经形态学、生化表型和分子鉴定,确定病原菌为达肯气单胞菌(A. dhakensis)。该菌株含有hlyA、aerA、act、lafA、ela、fla等6个毒力基因。根据16S rRNA基因结构建立PCR试验方法(表5),检测gyrB等6个毒力基因。这是首例与鳍足类败血症相关的达肯气单胞菌报道,它在水生环境中的存在对海洋哺乳动物构成了潜在的威胁。
(4)dRAA-CRISPR/Cas12a检测致病性嗜水气单胞菌毒力基因:Lin等报告嗜水气单胞菌作为一种新型水源性和食源性病原体,严重威胁人类健康、食品安全和水产养殖[33]。为此,建立了一种使用双链dRAA和CRISPR/Cas12a系统检测致病性嗜水气单胞菌aerA和hlyA毒力基因的新方法,可用于诊断致病性嗜水气单胞菌感染。
dRAA-CRISPR/Cas12a检测法采用双链重组酶辅助扩增(dualplex recombinase-assisted amplification,dRAA)和CRISPR/Cas12a系统来检测致病性嗜水气单胞菌aerA和/或hlyA毒力基因。设计了两对DNA扩增引物:aerA F:5’-AAGACGGCCATCAAGGTCAG-3’,R:5’-ACGAAGGTGTGGTTCCAGT-3’;hlyAF:5’-CCGGCATCTCTTTTGATGCG-3’,R:5’-GGATGTTGACCGAGGAGTC G-3’,用于扩增嗜水气单胞菌aerA和hlyA毒力基因,PCR产物经GENEWIZ(China)测序鉴定。
试验方法:基因组DNA提取,使用MiniBEST细菌基因组DNA提取试剂盒Ver.3.0,提取患者血液,粪便或水产物中DNA作模板。单重(sRAA)检测:在反应管中含缓冲液25µL、纯净水16.5µL、引物F和R(10µmol/L)各2µL,乙酸镁2.5µL、基因组DNA 2µL,置37℃水浴孵育20min。双重(dRAA)检测使用Phanta®Max Super-Fidelity DNA聚合酶,在50µL反应混合物中,含25µL 2×Phanta Max缓冲液,1µL 10µmol/L正向和反向引物(共4µL)、dNTP Mix(各10mmol/L)1µL、Phanta Max Super-Fidelity DNA聚合酶1U、基因组DNA 2µL、H2O 17µL。双重(dRAA)试验过程与sRAA相似。dRAA检测法无需复杂仪器,且灵敏度高,可快速准确检测(优化条件后约45min)致病性嗜水气单胞菌,并对3种致病性嗜水气单胞菌(aerA+ hlyA-,aerA- hlyA+和aerA+ hlyA+)具有高特异性。此外,dRAA-CRISPR/Cas12a方法可直接检测感染人血、粪便和鱼类样品中的嗜水气单胞菌,是一种诊断人嗜水气单胞菌感染及食品和水产养殖业中用于快速检测嗜水气单胞菌的新技术方法。
(5)应用生物素-链霉亲和素时间分辨荧光免疫法(BAS-TRFIA)检测嗜水气单胞菌:林鹏等报告建立了生物素-链霉亲和素时间分辨荧光免疫分析(BAS-TRFIA)高灵敏检测嗜水气单胞菌的新方法[34]。以兔抗IgG包被微孔板,加入嗜水气单胞菌菌株B18和生物素化IgG,生成夹心复合物用Eu3+-链霉亲和素作为示踪物,Eu3+可与离解增强液形成时间分辨荧光(TRF),通过TRF值对病原菌定量。该法的检测限为1.0×102cfu/mL,在1.0×101~1.0×106cfu/mL范围内线性良好,相关系数0.9716。用该法检测时,不同来源的嗜水气单胞菌以及其它气单胞菌均呈阴性,板内和板间的变异系数分别小于5.0%和9.0%。所有相关检测试剂37℃恒温放置6d后,检测性能无明显改变。对60份人工感染的美洲鳗鲡组织样品,包括肝、肾、肠、鳃和肌肉等组织进行检测,阳性检测率为98.33%。结果表明BAS-TRFIA法检测嗜水气单胞菌,灵敏度高、特异性好、操作简便,为水产养殖病原菌检测提供了新的技术。
国内张静等优化mPCR反应体系检测嗜水气单胞菌 16S rRNA、ast、alt、aerA、act这5个基因,初步判定嗜水气单胞菌和其他可培养菌的菌落形态,对其富集程度进行可视化辨别。张静等报告多重PCR反应体系优化结果显示,利用菌落mPCR检测嗜水气单胞菌及其毒力基因,具有简便、直观、特异性强之优点。
(6)MALDI-TOF MS鉴定气单胞菌:基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术在微生物鉴定方面具有快速、灵敏、准确度高的特点。每种微生物都由自身独特的肽/蛋白质组成,通过MALDI-TOF MS检测微生物的肽/蛋白质指纹图谱,经软件处理并与微生物数据库进行比对分析,可在几分钟之内完成对微生物种、属水平的鉴定[35]。作为新兴微生物快速鉴定法,国家标准委发布了《基质辅助激光解吸电离飞行时间质谱鉴别微生物方法通则》(GB/T 33682-2017)标准文本,并于2017年12月1日实施。据国内蒋颜等报告,采用MALDI-TOF MS法[36],对患者血液、痰液、分泌物和尿液分离的426株临床常见细菌(G+球菌76株,G-杆菌350株),进行快速鉴定。先用Vitek系统将细菌鉴定到种,PCR扩增细菌16S rDNA基因并作测序鉴定,对检测结果进行比较分析。所有G+球菌和G-杆菌Vitek系统检测和MALDI-TOF MS检测,两者鉴定结果完全符合。指出MALDI-TOF MS可快速、准确地对细菌进行鉴定,并且具有良好的重复性。王成彬等用MALDI-TOF MS[37]对临床分离的46株常见病原菌,包括粪肠球菌、屎肠球菌、金黄色葡萄球菌、肺炎链球菌、化脓性链球菌、无乳链球菌、产单核细胞李斯特菌等鉴定结果,其中95%得到准确鉴定,而产单核细胞李斯特菌仅有76%(34/55)鉴定至种水平。对其他临床常见菌G+菌,包括肠球菌、凝固酶阴性葡萄球菌、链球菌及其他属的细菌(包括缺陷乏氧菌、草绿色链球菌、杰氏棒状杆菌、阴道加德纳菌、乳酸球菌、黄色微球菌、罗氏菌)分别以97%、96%、82%、90%鉴定至种水平。
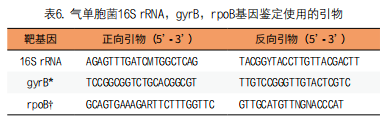
Kitagawa等采用MALDI-TOF-MS和管家基因(rpoB)测序结合系统发育分析,对58株患者分离的气单胞菌作比较鉴定[38]。结果显示rpoB测序方法最为准确,在属水平上正确鉴定了58个(100%)分离株,在种水平上正确鉴定了34个(58.6%)分离株。两者在属水平上准确地鉴定了分离株,但在种鉴定的准确性上存在差异。由于其低成本和易于分析,使得MALDI-TOF-MS法能在临床实验室得到广泛使用。Pérez-Sancho等采用MALDI-TOF-MS分析法鉴定151株来自病鱼分离的嗜水气单胞菌、兽气单胞菌(A. bestiarum)、杀鲑气单胞菌、维氏气单胞菌和温和气单胞菌[39]。MALDI-TOF-MS能在属水平上正确鉴定所有分离菌株,但根据种的不同,正确鉴定分离株的百分比有明显差异。对鉴定兽气单胞菌、嗜水气单胞菌、杀鲑气单胞菌、维氏气单胞菌和温和气单胞菌的鉴定效果好,准确鉴定结果可达95%以上。Shin等报告气单胞菌属可引起人类感染的主要有24种,其中嗜水气单胞菌、豚鼠气单胞菌和维氏气单胞菌温和变种(A. veronii biovar sobria),被认为是最重要的人类病原体[40]。常规法在种属水平上准确鉴定气单胞菌较困难,DNA-DNA杂交作为气单胞菌鉴定的金标准,但由于其成本高,所需时间长,在临床实验室中应用并不广泛。该研究使用MALDI-TOF MS在种属水平准确鉴定气单胞菌属,并且与16S rRNA和管家基因(如gyrB、rpoD)测序(表6),以及常规生化鉴定等4种方法作比较。对韩国某医院内患者分离的65株气单胞菌,采用上述4种方法进行检测。 结果显示,常规生化法和16S rRNA测序在属水平上对气单胞菌的鉴定较为准确,但在种水平上的鉴定不理想。MALDI-TOF质谱系统在种水平正确鉴定出60株(92.3%),但在属水平正确鉴定出只有4株(6.2%)。总之,管家基因测序与系统发育分析在物种水平上准确地鉴别气单胞菌(表7)。结论,管家基因测序是检测气单胞菌种级最准确的方法,但其成本、技术难度大,临床实验室采用MALDI-TOF MS可在种水平正确鉴定气单胞菌。

小结:气单胞菌是一种重要的水生、人畜共患病新发病原菌。目前已知有36个种,它与人类疾病有关的主要是嗜水气单胞菌、豚鼠气单胞菌和维氏气单胞菌。关于气单胞菌的实验室诊断,常规方法多采用细菌分离培养和16S rRNA基因测序鉴定,成本高、技术难度大,又费时。近年来采用荧光定量PCR和MALDI-TOF MS对气单胞菌种属水平95%以上可获得准确鉴定,对预防和控制气单胞菌属感染性疾病的病原学诊断具有重要意义。
参考文献
Janda JM, Abbott SL. The genus Aeromonas: taxonomy, pathogenicity, and infection. Clin Microbiol Rev 2010; 23:35–73.
Awan F, Dong Y, Liu J, et al. Comparative genome analysis provides deep insights into Aeromonas hydrophila taxonomy and virulence-related factors. BMC Genomics. 2018, 19(1):712.
Citterio B, Francesca B. Aeromonas hydrophila virulence. Virulence. 2015; 6(5): 417-8.
胡萌, 潘子豪, 陆承平,等. 嗜水气单胞菌流行菌株的生物学特性[J]. 中国兽医科学, 2013, 043(005): 441-445. 万颖, 陈晓, 余斐, 等. 2009~2013年189株嗜水气单胞菌的临床分布与耐药性[J]. 中国老年学杂志, 2016, v.36(04): 961-962.
Chun Au-Yeung, Kit-Ling Lam, Ka-Wai Chan, et al. Uses of Antibiotics in Ornamental Fish in Hong Kong and the Antibiotic Resistance in the Associated Zoonotic Pathogens[J]. J Xenobiot. 2022,12(4): 365-377. (港观赏鱼使用抗生素的情况及相关人畜共患动物对抗生素的抗药性)
Lin Z, Lu J, Wu S, et al. A novel detection method for the pathogenic Aeromonas hydrophila expressing aerA gene and/or hlyA gene based on dualplex RAA and CRISPR/Cas12a. Front Microbiol. 2022, 13: 973996.
卢兰芬, 冯雪琴, 王娟, 等. 肠道外感染嗜水气单胞菌的临床相关因素及治疗对策分析[J]. 中华医院感染学杂志, 2018, 28(6): 866-868.
朱大玲, 李爱华, 汪建国,等. 嗜水气单胞菌毒力与毒力基因分布的相关性[J]. 中山大学学报(自然科学版), 2006(01):82-85.
De Silva LADS, Wickramanayake MVKS, Heo G-J. Virulence and antimicrobial resistance potential of Aeromonas spp. associated with shellfish[J]. Lett Appl Microbiol. 2021, 73(2): 176-186.
Moya-Salazar J, Díaz CR, Cañari B, et al. Detection of pathogenic Aeromonas hydrophila from two rainbow trout (oncorhynchus mykiss) farms in Peru. Braz J Vet Med. 2022, 44: e000922. (秘鲁两个虹鳟鱼养殖场致病性嗜水气单胞菌的检测)
Jung-Schroers V, Jung A, Ryll M, et al. Diagnostic methods for identifying different Aeromonas species and examining their pathogenicity factors, their correlation to cytotoxicity and adherence to fish mucus. J Fish Dis. 2019, 42(2): 189-219.
Qu Y, Wang Q, Li Y, et al. Development of a real-time recombinase polymerase amplification assay for rapid detection of Aeromonas hydrophila. J Fish Dis. 2021 Apr; 44(4): 469-477.
El-Bahar HM, Ali NG, Aboyadak IM, Khalil SAES, et al. Virulence genes contributing to Aeromonas hydrophila pathogenicity in Oreochromis niloticus. Int Microbiol. 2019, 22(4): 479-490.
Algammal AM, Ibrahim RA, Alfifi KJ, et al. A First Report of Molecular Typing, Virulence Traits, and Phenotypic and Genotypic Resistance Patterns of Newly Emerging XDR and MDR Aeromonas veronii in Mugil seheli. Pathogens. 2022, 11(11): 1262.
Sherif AH, Abdelsalam M, Ali NG, et al. Zinc oxide nanoparticles boost the immune responses in oreochromis niloticus and improve disease resistance to aeromonas hydrophila infection. Biol Trace Elem Res. 2023 Feb; 201(2): 927-936.
Pereira C, Duarte J, Costa P, et al. Bacteriophages in the control of Aeromonas sp. in aquaculture systems: An integrative view. Antibiotics (basel). 2022 Jan 27; 11(2):163.
EFSA Panel on Animal Health and Welfare (AHAW); Nielsen SS, Bicout DJ, et al. Assessment of animal diseases caused by bacteria resistant to antimicrobials: kept fish species. EFSA J. 2022, 20(2): e07076.
Nhinh DT, Le DV, Van KV, et al. Prevalence, Virulence gene distribution and alarming the multidrug resistance of Aeromonas hydrophila associated with disease outbreaks in freshwater aquaculture. Antibiotics (basel). 2021 May 4; 10(5): 532.
林鹏, 卢洁, 郭松林, 等. 时间分辨荧光免疫分析高灵敏检测嗜水气单胞菌. 化学学报. 2017, 75(04): 398-402
朱大玲, 李爱华, 钱冬, 等. 汪建国嗜水气单胞菌毒力基因的研究进展. 水生生物学报 2004, 28(1): 80-84.
张静, 王永杰, 陈红莲, 等. 嗜水气单胞菌菌落多重PCR方法的建立及应用. 微生物学通报. 2022, 49(02): 841-850.
De Silva LADS, Wickramanayake MVKS, Heo G-J. Virulence and antimicrobial resistance potential of Aeromonas spp. associated with shellfish[J]. Lett Appl Microbiol. 2021, 73(2): 176-186.
Awan F, Dong Y, Liu J, et al. Comparative genome analysis provides deep insights into Aeromonashydrophila taxonomy and virulence-related factors. BMC Genomics. 2018, 19(1): 712.
Roger F, Marchandin H, Jumas-Bilak E, et al. Multilocus genetics to reconstruct aeromonad evolution. BMC Microbiology 2012, 12:62.
Martinez-Murcia AJ, Monera A, Saavedra MJ, et al. Multilocus phylogenetic analysis of the genus Aeromonas[J]. Syst Appl Microbiol. 2011, 34(3):189-99.
周妍妍, 南征, 耿子昕, 等. 2017年肠道门诊分离气单胞菌MLPA分型及临床特征分析. 中华医院感染学杂志2018, 28(24): 3726-3729.
Persson S, Al-Shuweli S, Yapici S, et al. Identification of clinical aeromonas species by rpoB and gyrB sequencing and development of a multiplex PCR method for detection of Aeromonas hydrophila, A. caviae, A. veronii, and A. media. J Clin Microbiol. 2015, 53(2):653-6.
Wang G, Clark CG, Liu C, et al. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR. J Clin Microbiol. 2003, 41(3): 1048-54.
Qu Y, Wang Q, Li Y, et al. Development of a real-time recombinase polymerase amplification assay for rapid detection of Aeromonas hydrophila. J Fish Dis. 2021, 44(4):469-477.
Zaher HA, Nofal MI, Hendam BM, et al. Prevalence and Antibiogram of Vibrio parahaemolyticus and Aeromonas hydrophila in the Flesh of Nile Tilapia, with Special Reference to Their Virulence Genes Detected Using Multiplex PCR Technique. Antibiotics (basel). 2021, 10(6): 654.
王蓉, 王忠发, 王志铮, 等. 实时荧光定量PCR快速检测嗜水气单胞菌方法的建立. 现代预防医学2012, (13): 3339-3341.
高建忠, 魏雪, 童琰, 等. MGB探针实时定量PCR检测致病性嗜水气单胞菌. 安徽农业科学2009, 37(19): 8911-8913.
Wong CYF., Flower RLP., Heuzenroeder MW,. Inactivation of two haemolytic toxin genes in Aeromonas hydrophila attenuates virulence in a suckling mouse model[J]. Microbiology, 1998, 144(Pt.2): 291-298.
林鹏, 卢洁, 郭松林, 等. 时间分辨荧光免疫分析高灵敏检测嗜水气单胞菌. 化学学报. 2017, 75(04): 398-402.
胡继红, 马筱玲, 王辉, 等. MALDI-TOF MS在临床微生物鉴定中的标准化操作专家共识中华检验医学杂志, 2019, 42(4): 241-249.
蒋颜, 周宏伟, 蔡加昌, 等. MALDI-TOF MS在临床常见菌快速鉴定中的应用研究[J]. 中华检验医学杂志, 2010, 33(6):4.
王成彬, 陈文燕. MALDI-TOF MS在临床细菌鉴定中的应用[J]. 临床检验杂志(电子版)2014, 3(4): 724-729.
Kitagawa D, Suzuki Y, Abe N, et al.Comparison of MALDI-TOF mass spectrometry and rpoB gene sequencing for the identification of clinical isolates of Aeromonas spp[J]. Heliyon. 2022, 8(11): e11585.
Pérez-Sancho M, Cerdá I, Fernández-Bravo A, et al. Limited performance of MALDI-TOF for identification of fish Aeromonas isolates at species level. J Fish Dis. 2018, 41(10):1485-1493.
Shin HB, Yoon J, Lee Y, et al. Comparison of MALDI-TOF MS, housekeeping gene sequencing, and 16S rRNA gene sequencing for identification of Aeromonas clinical isolates. Yonsei Med J. 2015, 56(2): 550-5.




