非配套血培养系统质量保证问题与评价方法

陈风,生物梅里埃产品经理,毕业于重庆医科大学医学检验系,在生物梅里埃工作8年。血培养系统全流程应用培训师、数据分析培训师。在协助实施血培养项目全流程质量管理、快速分级报告、信息化建设等有丰富经验。

王伟洁,生物梅里埃客服经理,于生物梅里埃从事产品应用和技术支持工作10年;Bact/alert 3D& VIRTUO产品应用培训师,具有丰富的血培养培训和技术投诉处理经验;结合血培养临床需求深入研究血培养系统性能提升;Castlefirth 认证LCS(Lean Competency System) 绿带,在评估和改善微生物室血培养检验流程项目有丰富经验。
临床实验室使用的是A品牌的血培养仪,如果在A品牌的血培养仪器上使用B品牌的血培养瓶可以吗?如果可以需要通过哪些验证过程呢?回答是,部分科室在血培养系统的应用上有一个矛盾点:A品牌注册证和说明书显示只能配套使用,B品牌说明书显示可以跨品牌适用,那A和B可以非配套使用吗?我们可以从血培养连续监测系统判断报阳信号的原理、血培养系统的性能评价方法及血培养对血流感染诊疗的重要性三个方面来思考这个问题。
一、血培养连续监测系统判断报阳信号的原理
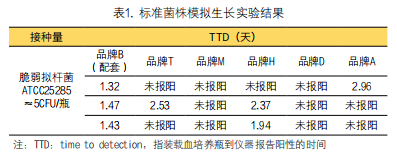
目前,连续监测的商品化血培养系统主要为监测CO2浓度变化或监测培养瓶内压力变化等,国内使用的主要以监测CO2浓度变化为主。以生物梅里埃公司的BacT/alert 3D系统为例,如果测试样品中存在微生物,则当微生物在培养基中代谢基质时,就会产生二氧化碳。当微生物生长产生CO2时,每个血培养瓶底部的传感器颜色就由蓝绿色变浅。发光二极管(LED)将光线投射到传感器上,由一个光电探测器测量反射光。产生的CO2越多,则被反射的光就越多。将产生CO2的量值与标本瓶中初始的CO2水平相比较。出现以下情况时,样品被确定为阳性:CO2产生的速率持续增加,初始CO2含量高,和/或CO2生成速率异常高。对于培养瓶中的分枝杆菌生长,也可根据产生的微量CO2或CO2缓慢的持续变化,将其确定为阳性。经过规定的时间后CO2水平没有明显变化,样品就被确定为阴性。
不同品牌的系统对于CO2变化量判断的计算法则各不相同,不同品牌的血培养瓶底部的初始反射值亦有不同(图1),瓶底指示剂随CO2浓度变化发生颜色变化的敏感度也各不相同。商品化系统对于计算法则与瓶底指示剂配方等核心技术往往会保密或申请专利,因此,血培养系统仪器和血培养瓶通常是配套使用。血培养仪与血培养瓶非配套使用时,可能因仪器计算法则与瓶底指示剂颜色变量不匹配,造成漏检或假阳性的情况发生(表1)。

图1. 使用Labscan Agera分光光度计(美国Hunter Labs公司)对血培养瓶瓶底初始反射值测量结果
二、血培养系统的性能评价方法
全自动血培养系统的性能验证应在新系统投入使用前、系统主要部件故障、系统整体更新或升级后进行,评估与全自动血培养系统配套使用的血培养瓶以及相应的自动化监测设备是否能在规定时间内检出临床血培养阳性常见分离的病原微生物(包括需氧菌、厌氧菌、苛养菌、酵母菌等)[1]。具体的验证方案可以参照行业标准WS/T 807-2022《临床微生物培养、鉴定和药敏检测系统的性能验证》。
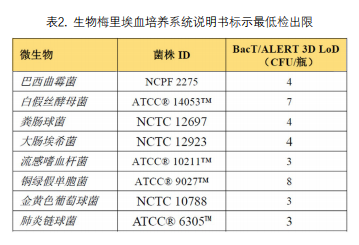
值得注意的是,实验室对含有抗微生物药物吸附剂的血培养瓶进行药物吸附性能验证时,应遵从厂家的建议,如生物梅里埃血培养产品说明书标注“以下类别的抗菌药物/抗菌药物种类可被培养基中和:亚胺培南、美罗培南、苯唑西林、甘氨环素类、大环内酯类、头孢西丁、头孢洛林、氨基糖苷类、氟喹诺酮类、林可酰胺类、酮内酯类和糖肽类”,即在验证说明书声明的抗生素吸附能力时,建议模拟人体环境向血培养瓶内加入的药物浓度能达到血药浓度的最高剂量。如果厂商说明书提供了其血培养系统的检出限,实验室宜进行检出限的验证[2]。
非配套培养瓶使用属于超出预定范围使用的方法,应行检验程序的确认。方法确认应尽可能全面,并通过客观证据(以性能特征形式)证实满足检验预期用途的特定要求。检验程序的性能特征宜包括:测量正确度、测量准确度、测量精密度(含测量重复性和测量中间精密度)、测量不确定度、分析特异性(含干扰物)、分析灵敏度、检出限和定量限、测量区间、诊断特异性和诊断灵敏度[3]。
血培养系统的主要性能特征包括检出限和抗生素吸附能力。使用非配套血培养瓶替换配套血培养瓶前,须根据配套血培养瓶说明书中标示的性能指标行抗生素吸附能力确认和检出限确认(表2)。当抗生素吸附能力及检出限与配套系统性能一致时方可应用。非配套培养瓶更换试剂批号时使用质控菌株进行血培养瓶质量验收,以符合性能要求[1]。
三、血培养对血流感染诊疗的重要性
(一)血流感染的特点
血流感染是严重感染性疾病之一,具有“三高一重:发病率高、病死率高、紧迫性高、患者负担重”的特点。
1. 发病率高:呼吸道感染、泌尿道感染、胃肠道感染、外科手术以及静脉留置导管等均可引起血流感染[4]。社区获得性和医院获得性血流感染大约各占40%,ICU获得性病例约占20%[5],所有年龄段患者均可能发生血流感染。一项6年回顾性队列研究显示,住院患者中血流感染发生率约为5.9%[6],我国公立医院每年的住院人数约为1.5亿,意味着近1000万人发生血流感染。
2. 病死率高:血流感染是世界范围内发病率和死亡率最高的疾病之一,全球每年约有600万人死于严重血流感染[7]。不同地区和国家血流感染病死率的风险等级不一致,我国一项为期十年的前瞻性研究显示,血流感染导致的死亡率约为12.83%[8],国外类似研究表明死亡率为15.6%[9]。如果血流感染早期干预与护理不足,则病死率可达50%[10]。
3. 紧迫性高:脓毒症休克的患者第一次发生低压后,正确治疗每延迟1小时,死亡率增加7.6%[11];延迟正确治疗6个小时,死亡率便会增加58%[12]。与不良的预后密切相关,尤其是没有及时的进行抗菌药物治疗和感染灶控制。
4. 患者负担重:根据2004-2005年国内一项多中心研究结果,国内平均住院治疗费用502美元/天,平均住院费用为11390美元[13]。在欧洲和美国,败血症是医保支出最多的病种之一[14]。
(二)血流感染的诊疗原则
病原学诊断的临床意义是毋庸置疑的。尽管病原体宏基因组学第二代测序(mNGS)、微滴式数字聚合酶链反应(ddPCR)等新兴技术逐渐发展并临床应用,但血培养仍然是诊断血流感染的金标准。《医院感染诊断标准》(卫医发 [2001] 2号)中血流感染的诊断标准:临床诊断基础上,血液培养分离出病原微生物或血液中检测到病原体抗原物质,可诊断血流感染。
血流感染的治疗有三个重点:① 及时正确的抗菌药物治疗。及时是指脓毒症或脓毒症休克可能性大的患者,立即进行(1h内)经验性抗菌治疗[15];对于不是脓毒症休克患者但持续存在潜在感染的风险时,可进行经验性抗菌治疗。正确是指合理的抗生素类别、合理的剂量、合理的给药方式,正确治疗高度依赖MIC药敏报告,所以病原学检查是必需的。② 去除可能的诱发因素。如全身血流感染是因为局部扩散性感染造成,对局部的引流清创处理非常重要。证实导管相关性血流感染时,可做拔管处理。③ 积极治疗原发疾病[16]。
四、总结
血培养系统的研发与计算法则升级的数据基础是基于配套的仪器与血培养瓶。因此,从质量保证来看,首先推荐科室采用血培养配套系统开展项目检测。非配套系统的耗材成本低于配套系统,但必须在质量保证的基础上缩减成本。因此,在拟采用非配套血培养检测前,务必按照配套系统标示的抗生素吸附能力和检出限指标完成性能确认。血液培养是微生物检验非常珍贵的标本,采集和运输都有很高的要求,尽可能的提高血培养阳性检出率和缩短报告时间是提升血培养质量的核心。目前,最好的血培养系统阳性检出率可达到12%[1],每提升一个百分点的阳性检出率对于血流感染患者的治疗都具有重大价值。
参考文献
中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组,中华医学会微生物学和免疫学分会临床微生物学组. 血液培养技术用于血流感染诊断临床实践专家共识[J]. 中华检验医学杂志, 2022, 45(2): 105-121.
WS/T 807-2022, 临床微生物培养、鉴定和药敏检测系统的性能验证.
GB/T 22576.1-2018, 医学实验室质量和能力的要求第1部分: 通用要求.
Timsit JF, Ruppé E, Barbier F, Tabah A, Bassetti M. Bloodstream infections in critically ill patients: an expert statement. Intensive Care Med. 2020 Feb; 46(2): 266-284.
Vallés J, Ferrer R. Bloodstream infection in the ICU. Infect Dis Clin North Am. 2009 Sep; 23(3): 557-69.
[6] Rhee C, Dantes R, Epstein L,et al.CDC Prevention Epicenter Program. Incidence and Trends of Sepsis in US Hospitals Using Clinical vs Claims Data, 2009-2014. JAMA. 2017 Oct 3; 318(13): 1241-1249.
Rudd KE, Johnson SC, Agesa KM, et al.Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet. 2020 Jan 18; 395(10219): 200-211.
Jin L, Zhao C, Li H, et al. (2021). Clinical profile, prognostic factors, and outcome prediction in hospitalized patients with bloodstream infection: results from a 10-year prospective multicenter study. Frontiers in Medicine, 8, 629671.
Rhee C, Dantes R, Epstein L,et al. CDC Prevention epicenter program. incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014. JAMA. 2017 Oct 3; 318(13):1241-1249.
Kwizera A, Dünser M, Nakibuuka J. National intensive care unit bed capacity and ICU patient characteristics in a low income country. BMC Res Notes. 2012 Sep 1; 5: 475.
Kumar Anand MD, Roberts, Daniel MD, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock*. Critical Care Medicine 34(6): p 1589-1596, June 2006.
Latif A, Halim MS, Pronovost PJ. Eliminating Infections in the ICU: CLABSI. Curr Infect Dis Rep. 2015 Jul;17(7):491.
Cheng B, Xie G, Yao S, et al. Epidemiology of severe sepsis in critically ill surgical patients in ten university hospitals in China. Crit Care Med. 2007 Nov; 35(11): 2538-46.
Torio CM, Moore BJ. National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2013.
Evans L, Rhodes A, Alhazzani W,et al.Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021 Nov; 47(11): 1181-1247.
骆俊,吴菊芳. 血流感染诊断及治疗进展[J]. 中国抗感染化疗杂志, 2005, 5(2):119-123.




