MALDI-TOF MS微生物质谱临床标准化操作中的问题解析

卫锦然,梅里埃诊断产品(上海)有限公司微生物产品经理。毕业于东南大学医学检验专业,从事微生物产品管理8年。
微生物的质谱鉴定基于基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS)所生成的蛋白图谱分析开展,这一技术克服了传统生化表型鉴定方法操作复杂、检测时间长、效率低的短板,从技术上提升了临床微生物的检验能力,因此在临床得到了快速的应用。2020年10月,胡继红和丛玉隆发表的《我国临床微生物实验室现状与分级诊疗下实验室的能力建设重点》中建议[1],三级医院(包括三级专科医院)临床微生物室,MALDI-TOF MS作为必备的专业设备之一;建议二级甲等医院的微生物室有条件的情况下,应配备MALDI-TOF MS。
一、MALDI-TOF MS微生物质谱的临床应用现状
MALD-TOF MS微生物质谱在临床应用已超过十年时间,其在细菌和真菌鉴定上的性能表现及技术成熟度也得到了充分的验证[2],目前国内使用MALDI-TOF MS的临床机构已超过1200家,并且依然保持着每年新增超过200家的速度[3]。伴随着技术的成熟和数据库的完善,该领域的厂商品牌也不断增加,目前获得NMPA认证的品牌已超过15家[4],其中主流的品牌包括:梅里埃VITEK MS,布鲁克microflex,安图生物Autof ms1000,中元汇吉EXS2600,珠海迪尔Smart MS 5020,珠海美华M-Discover 100等。由于MALDI-TOF MS技术本身的成熟性,不同品牌在硬件基础上的参数差异不大,而差异点主要体现在数据库以及相应的算法规则上。数据库方面,目前主流品牌的可鉴定菌种数量普遍达到了2000种以上,已经基本能够完全满足临床使用的需要,但在建库菌株的选择和建库方法上不同品牌所使用的策略有所不同,同时数据库一般可分为临床库和科研库,代表了数据库的可靠性程度以及开放程度;从算法的技术路线出发,主要分为以梅里埃为代表的权重矩阵算法和以布鲁克为代表的神经网络识别算法,其主要差异体现在鉴定结果的呈现方式上,比如梅里埃VITEK MS的结果大多数以单个菌名的方式呈现,同时提供该结果的可信程度;而布鲁克microflex的结果则以所匹配到的菌株作为结果参考,并提供相应的分值,代表了该结果在种水平或者属水平的可信程度。
微生物质谱的普遍应用对于临床产生的一个重要影响体现在鉴定周转时间的显著缩短,使得微生物鉴定报告能够提前一天的时间发出;另一方面由于微生物质谱具备更广泛的菌种覆盖,一些通过传统方法无法准确鉴定到种水平的细菌,如丝状真菌、放线菌、分枝杆菌能够通过质谱得到准确的鉴定。尽管微生物质谱在临床的使用已经相当普遍,但在操作实践环节仍然存在着一些误区和突出的问题。
二、MALDI-TOF MS微生物质谱在操作实践中的误区和突出问题
1. 对一次性靶板重复使用或重复用靶板不规范清洗:微生物质谱的靶板分为可重复用靶板和一次性靶板,一次性靶板按照制造商的要求只能进行单次的使用,不可进行重复清洗。但在临床实践中,部分实验室会出于成本方面的考虑,对一次性靶板进行重复清洗使用,不仅可能导致鉴定成功率或可信度下降,更甚会出现错误的鉴定结果。以下是在梅里埃实验室进行的内部评估实验。
在选择一株已知的嗜麦芽窄食单胞菌在新靶板上完成鉴定后,对该靶板清洗至肉眼观测干净无残留,并涂上一株已知的鲍曼不动杆菌,同时取另一新靶板并涂上同一株鲍曼不动杆菌,将此两块靶板同时上机鉴定,清洗后靶板显示为:无鉴定结果,而新靶板显示为:鲍曼不动杆菌(图谱差异如图1)。重复该试验,再次选择一株已知的嗜麦芽窄食单胞菌在新靶板的两个孔位上完成鉴定后,对该靶板清洗至肉眼观测干净无残留,在清洗的两个孔位上分别涂上一株已知的鲍曼不动杆菌和一株已知的大肠埃希菌,同时取一块新靶板,分别涂上同一株鲍曼不动杆菌和大肠埃希菌,将此两块靶板同时上机鉴定,清洗后靶板显示为:肺炎克雷伯菌(高置信)和弗格森埃希菌
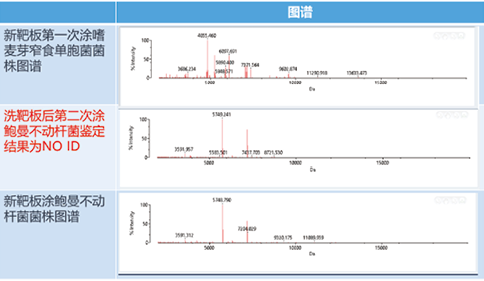
图1. 鲍曼不动杆菌图谱差异图
+大肠埃希菌(低分辨),新靶板显示为:鲍曼不动杆菌和大肠埃希菌(图谱差异如图2)。由此可见,使用清洗后靶板即使获得的结果显示为绿灯(高置信),仍然可能出现错误的鉴定,由此可能带来严重的临床后果。而出现这一问题的原因可以用阴性质控的方法来进行说明,取一块新靶板,随机选取一个孔位涂布1μl基质液作为阴性质控,另取一块使用过并清洗后的靶板,随机选取一个孔位涂布1μl基质液作为阴性质控,两块靶板同时上机检测后,可以观察到新靶板仅在2000Da处检测到蛋白而清洗靶板在多个质量位点均有蛋白检出(图谱差异如图3)。
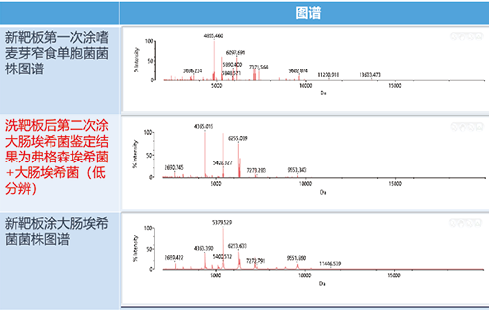
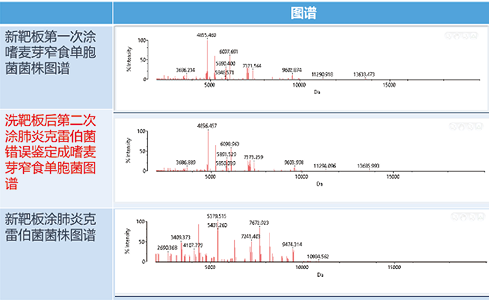
图2. 鲍曼不动杆菌和大肠埃希菌图谱差异图
由此说明清洗过的靶板虽肉眼见孔位干净清洁,但仍有不可预测的蛋白量残留,导致临床出现意料之外的红灯(无结果)、黄灯(低分辨)甚至是绿灯(高置信)但是错误的鉴定结果!对于可重复用靶板,尽管没有可以参考的数据,但不恰当的清洗方式同样可能导致类似的结果,因此对于重复用靶板应参照制造商的SOP或相关指南要求进行严格清洗,并且设置阴性质控。
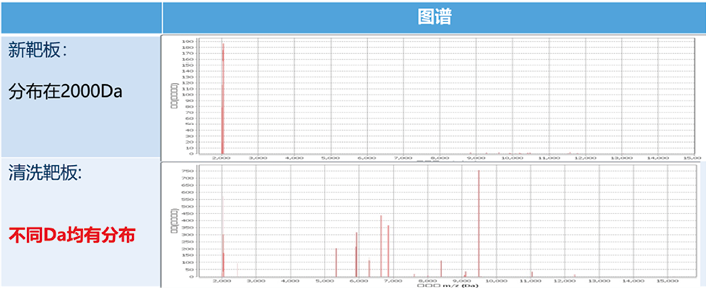
图3. 清洗靶板在多个质量位点均有蛋白检出图谱差异图
2. 直接报告最高分结果:当质谱鉴定结果出现“黄灯”(中度置信)结果,或者多个不同种的“绿灯”(高度置信)结果时,有必要使用进一步的补充试验或其他方法进行鉴定结果的确认。但部分实验室会在未经进一步确认的情况下直接将最高分结果作为审核结果发送至临床,由此可能带来较高的临床风险。据2019年Journal of Clinical Microbiology的一篇文献报道[5],加州洛杉矶儿童医院处理了一份儿童纤维化病人咽部培养物,质谱鉴定结果为:(1)淋病奈瑟菌(1.93分);(2)脑膜炎奈瑟菌(1.85分);(3)脑膜炎奈瑟菌(1.78分),而该院实验室未经进一步确认,直接将分值最高的鉴定结果淋病奈瑟菌报告临床,而随后的回顾性研究显示,淋病奈瑟菌探针进行PCR扩增结果阴性,排除了淋球菌,通过16S rRNA测序结果为脑膜炎奈瑟菌/灰色奈瑟菌也不能确认,氧化酶试验阳性排除灰色奈瑟菌,最终确认是脑膜炎奈瑟菌。这样的错误对于临床可能产生一定程度的误导,因此所谓的“分值”或“置信分数“并不能作为鉴定结果的唯一判据,实验室在遇到此类结果时,还需要谨慎处理。每个实验室对一些特殊菌应设置保险的报告分值,对于给出多个结果的情况,不应直接选择排第一位的结果报告,而是应做补充试验或确认试验,以确定最终报告的菌种。
3. 手抄结果输入LIS或自动化药敏系统:部分实验室在购置微生物质谱仪后显著提升了对临床致病菌的鉴定水平,但同时也对工作流程产生了重要影响,传统的自动化鉴定药敏系统由于整合了鉴定和药敏结果,LIS只需要从一台设备获取这些结果信息,而随着质谱的应用,一方面由于鉴定结果需要由微生物质谱生成,鉴定结果需要完成从质谱到LIS的传输,另外在进行药敏试验时,也需要将鉴定结果和与自动化药敏系统进行同步,在没有实现LIS数据直接传输的情况下,鉴定结果仍然需要通过手抄登记及手工录入的方式进行传输,而很多情况下这种记录往往是一次性的,并没有形成规范的文件归档,导致整个检测过程无法被有效溯源,一旦出现录入错误,则无法找到问题的根源。
三、MALDI-TOF MS微生物质谱的质量要求和相关操作规范
针对以上提及的问题,2017年CLSI发布的M58文件和2019年国内发布的《MALDI-TOF MS在临床微生物鉴定中的标准化操作专家共识》(以下简称《专家共识》)对以上问题都有提出明确的要求。比如在《专家共识》中明确指出[6],一次性使用靶板不可重复使用,而重复用靶板清洗应用70%酒精浸泡擦洗后,用80%三氟乙酸进行擦拭再用去离子水冲洗擦干;酒精浸泡时间不宜过长防止固定磁铁脱落,三氟乙酸步骤不可省略以免蛋白残留交叉污染;确保靶板无严重划痕、溢出,清洗后需要对靶板进行阴性质控。
而在结果报告的问题上,《专家共识》中同样明确指出[6],针对中低置信度结果或一致性差的高置信度结果,仅能报告属水平或菌群结果,或进行补充实验;同时报告时也需要参考仪器说明书明确MALDI-TOF MS系统存在的局限性,对于存在局限性的鉴定结果可根据临床意义判断是否需要报告到种水平,如有必要进行相应的补充试验。而在关于鉴定结果传输至LIS的问题上,《M58》文件中则提及了人员培训和能力评估中需要重点强调结果全程溯源的重要性,要么通过制造商提供的软件和LIS系统进行连接实现数据的直接传输,或者使用规范的工作表单对鉴定结果进行记录和归档[7];同时《M58》也建议在准备使用微生物质谱之前,应将质谱和LIS以及其他设备(如药敏系统)的连接可行性提前纳入考量,否则将会带来大量的手工数据管理工作[7]。
四、如何实现MALDI-TOF MS微生物质谱的高质量临床应用
以上提及的问题是目前在微生物质谱临床应用中比较有代表性的问题,这些问题都和微生物质谱的规范化使用密切相关,而实现规范化使用是实现微生物质谱高质量临床应用的基础。在此基础之上,如何充分利用质谱实现更加快速的临床报告,尤其在危急样本(如血液)的报告流程上,使用微生物质谱实现分级报告,实现检验时长(TAT)的缩短,从而做到快速诊断、规范临床抗微生物药物使用,并减少住院时间,改善患者预后,才是高质量临床应用的关键所在。在2022年发布的《血培养技术用于血流感染诊断临床实践专家共识》(以下简称《血培养专家共识》)中[8],定义了微生物质谱技术在三级报告中相应的应用场景:在血培养报阳及镜检后,通过快速集菌技术直接对阳性样本进行质谱鉴定,可以最快发出危急值一级鉴定报告(报阳后≤2h);在经过初步分离培养获得菌落或菌膜后,直接使用质谱鉴定获得二级鉴定报告(报阳后≤24h);在经过传代纯化后,对单个菌落进行质谱鉴定获得最终鉴定报告(报阳后≤3天)。要实现这一目标,一方面技术本身仍然需要更加精进,比如针对阳性血培养样本的直接鉴定方法仍然不够成熟,尽管目前有一些前处理方法,如通过红细胞解离后离心或者分离胶离心获得沉渣进行鉴定,或是短时间培养后的菌膜鉴定,但在阳性菌和念珠菌的鉴定效能上仍然有待于进一步提升[9];另一方面对微生物实验室的流程安排和人员排班也提出了更高的要求,比如《血培养专家共识》中提出[7],建议临床微生物学实验室安排24h接收血培养标本并及时上机,同时建议有条件的实验室实时处理血培养标本,夜班人员应完成接收样本上机、报阳瓶转种以及染色镜检和危急值报告的工作。
参考文献
胡继红, 丛玉隆. 我国临床微生物实验室现状与分级诊疗下实验室的能力建设重点.临床实验室, 2021, (10).
Tsung-Yun Hou, Chuan Chiang-Ni, Shih-Hua Teng. Current status of MALDI-TOF mass spectrometry in clinical microbiology. journal of food and drug analysis 27 (2019) 404 e414.
千里马招标网 https://vip.qianlima.com/
国家药品监督管理局网站. https://www.nmpa.gov.cn/datasearch/#category=ylqx
Pandey U, Naccache S N, Bard J D. Back to the basics: Biochemical testing for pathogen identification in the era of Matrix-Assisted Laser Desorption Ionization–Time of Flight Mass Spectrometry (MALDI-TOF MS)[J]. J Clin Microbiol, 2019, 57 (10).
胡继红, 马筱玲, 王辉, 等. MALDI-TOF MS在临床微生物鉴定中的 标准化操作专家共识, 中华检验医学杂志. 2019, (42): 4 .
CLSI M58 Methods for the ldentification of Cultured Microorganisms Using Matrix-Assisted Laser Desorption/lonization Time-of-Flight Mass Spectrometry.
王辉, 王成彬, 血液培养技术用于血流感染诊断临床实践专家共识, 中华检验医学杂志, 2022年2月第45卷第2期 Chin J Lab Med, February 2022, Vol. 45, No. 2
Ruiz-Aragón J, Ballestero-Téllez M, Gutiérrez-Gutiérrez B, de Cueto M, Rodríguez-Baño J, Pascual Á. Direct bacterial identification from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry: A systematic review and meta-analysis. Enferm Infecc Microbiol Clin (Engl Ed). 2018 Oct; 36(8): 484-492. English, Spanish. doi: 10.1016/j.eimc.2017.08.012. Epub 2017 Oct 27. PMID: 29110928.




