液相色谱串联质谱法检测血清他汀及其活性代谢物浓度方法的建立与临床应用

李姿芸,硕士研究生。2016年本科毕业于中国药科大学药学院(药学专业)。2020年考入国家卫生健康委北京老年医学研究所攻读老年医学硕士,研究方向为老年相关疾病生物标志物研究。硕士阶段主要参与液相色谱串联质谱分析方法的开发、支链氨基酸与脂代谢紊乱相关疾病的关系研究等课题。硕士期间,已发表SCI文章两篇,中文核心期刊文章一篇。

杨睿悦,北京医院 国家老年医学中心/国家卫健委北京老年医学研究所研究员,硕士研究生导师。北京大学医学学士和博士学位。主要从事老年相关疾病生物标志物研究,在液相色谱串联质谱的方法学研究和临床应用研究等方面拥有丰富的经验。主持国家自然科学基金项目2 项和北京市自然科学基金项目1项,同时作为科研骨干在多项国家级和省部级项目中承担重要工作。近年来共发表论文 60 余篇,其中以第一/通讯作者发表SCI论著15篇。曾获得省部级科技成果奖1项、局级科技成果奖2项。主要学术兼职包括:中华预防医学会老年病防控专委会委员兼副秘书长、中国老年医学学会基础与转化医学分会常务委员、中国老年医学学会检验医学分会委员、中华医学会老年医学分会老年基础医学学组委员兼秘书,科技部国家重点研发项目会评专家,以及eLife、Obesity、Frontiers in Nutrition等期刊审稿人。
【摘要】目的 基于液相色谱-串联质谱(LC-MS/MS),建立一种可靠、简单、高效的检测血清瑞舒伐他汀(RSV)、匹伐他汀(PIV)、阿托伐他汀(AT)、阿托伐他汀的活性代谢物2-羟基阿托伐他汀(2-AT)和4-羟基阿托伐他汀(4-AT)浓度的分析方法,并在行冠脉造影人群中进行初步临床应用。方法 以d5-AT、d5-2-AT、d5-4-AT、d3-RSV、d4-PIV为同位素内标,乙酸铵缓冲溶液调节血清pH值后,加入乙酸乙酯液液萃取。离心后吸取上层溶液、吹干、流动相重组、经液相分离后,采用正离子多反应监测模式进行串联质谱检测。考察方法的特异性、线性、检测限(LOD)、定量限(LOD)、精密度、回收率、基质效应和样本稳定性。收集100名服用AT、RSV或PIV进行调脂治疗的行冠脉造影患者血清,测定上述五种他汀及活性代谢物浓度,分析他汀服用剂量与浓度的关系。结果 本方法特异性良好,在待测物保留时间内无干扰峰;待测物的检测限均低于0.05ng/ml;AT、2-AT、4-AT、RSV在0.1~40ng/ml浓度范围内表现良好的线性(r>0.999),定量限为0.1ng/ml;PIV在0.25~100ng/ml浓度范围内表现良好的线性(r>0.999),定量限为0.25ng/ml;批内不精密度和批间不精密度均小于7.7%;加标回收率范围为97.7%~106.9%;无明显基质效应;样本在室温放置3h、4℃放置24h、-80℃放置30天以及反复冻融3次后保持稳定,经前处理后的样本室温或4℃放置24小时后仍能保持稳定。检测100名行冠脉造影患者血清他汀及代谢物水平,五种待测物的浓度均在线性范围内;Jonckheere-Terpstra趋势检验结果显示,AT、2-AT和4-AT的浓度均随着服药剂量增加而上升(Z=2.849,P=0.004;Z=3.174,P=0.002;Z=2.767,P=0.006)。结论 建立的测定血清中AT、2-AT、4-AT、RSV和PIV浓度的HPLC-MS/MS方法简便、灵敏、可靠,有望为他汀类药物浓度监测、个体化用药指导及进一步的临床研究提供有效技术手段。
【关键词】液相色谱串联质谱;他汀类药物;代谢产物
心血管疾病已经成为人类健康的头号杀手。流行病学研究显示,我国动脉粥样硬化性心血管病(Cardiovascular disease,CVD)的发生率和死亡率逐年上升,疾病负担日益加重[1]。血脂异常是导致CVD发生的主要原因之一。他汀类药物可以显著减少体内胆固醇的生物合成,降低血脂水平,还具有稳定动脉粥样硬化斑块,抗炎症反应,改善内皮细胞功能,抑制血栓形成等功能,从而发挥抗CVD作用,广泛应用于CVD的预防和治疗[2-4]。
由于遗传背景差异、依从性、药物联用等因素,他汀类药物的安全性和疗效在个体患者中存在明显差异。例如,患者接受他汀治疗时,出现血药浓度过低或过高,导致降脂效果不理想和严重不良反应(如横纹肌溶解、肝损伤等)的发生[5]。因此,对服用他汀类药物的患者进行治疗药物监测(Therapeutic drug monitoring,TDM),实行个体化用药,对提高药物治疗效果尤为重要。此外,在CVD的流行病学研究中,通过调查服药史对他汀的暴露水平进行评价,容易引入许多偏倚,也无法很好地评价他汀体内代谢产物的浓度。而测定他汀及代谢物的体内浓度,可以直接反映其暴露水平,在CVD的流行病学研究中具有重要意义。
目前,文献报道测定他汀类药物及其代谢物的分析方法主要有酶抑制法、HPLC、GC-MS、LC-MS、LC-MS/MS等[6],酶抑制法[7],步骤繁琐、耗时长,灵敏度低;HPLC法多用于测定单种他汀[8-11],检测多种他汀时灵敏度较低[12];GC-MS法需要进行衍生化预处理[13];LC-MS/MS法灵敏可靠,但是现有方法大多只能测定单一他汀及其代谢物[11, 14-26],仅有少数可同时检测多种他汀及代谢物[27-30]。而同时检测多种他汀的LC-MS/MS方法,存在灵敏度较差、耗时长、操作复杂、较难实现高通量检测等问题。因此,本研究旨在建立一种特异灵敏、简单准确,可同时测定瑞舒伐他汀(Rosuvastatin,RSV)、匹伐他汀(Pitavastatin,PIV)、阿托伐他汀(Atorvastatin,AT)及其活性代谢产物2-羟基阿托伐他汀(Ortho-hydroxy atorvastatin,2-AT)和4-羟基阿托伐他汀(Para-hydroxy atorvastatin,4-AT)血药浓度的LC-MS/MS分析方法,为他汀类药物的TDM、个体化用药指导及CVD流行病学研究提供技术平台。
材料与方法
一、材料
1. 试剂:本实验所用的标准品AT(批号和规格:6-XJZ-145-1,50mg)、PIV(批号和规格:2-HBS-106-1,50mg)、2-AT(批号和规格:1-RTW-185-1,1mg)和稳定同位素内标d3-RSV(批号和规格:11-VKU-88-3,1mg)均购买自加拿大Toronto Research Chemicals公司;标准品4-AT(批号和规格:4279-017A2,10mg)、RSV(批号和规格:1967-066A2,10mg)、氘代同位素内标d5-AT(批号和规格:2783-086A2,10mg)、d5-2-AT(批号和规格:4903-001A1,1mg)和d4-PIV(批号和规格:2622-063A2,10mg)均购买自加拿大TLCPharmaceutical Standards Ltd公司;氘代同位素内标d5-4-AT(批号和规格:21B052-A3,1mg)购买自中国IsoReag同位素公司;所有标准品和内标的纯度均大于98%,同位素内标的同位素纯度均大于98%。有机试剂乙腈、乙酸乙酯(色谱纯)均购买自美国Fisher Scientific公司;甲酸、甲酸铵、乙酸铵均购买自美国Sigma-Aldrich公司。超纯水由Milli-Q纯水仪制备。
2. 仪器:Agilent 1260高效液相色谱仪(美国Agilent公司)和QTRAPAPI 5500质谱仪(美国AB Sciex公司)组成LC-MS/MS系统,数据采集处理软件为Analyst 1.6。
3. 血清样本:采集北京医院心内科住院并行冠状动脉造影100名患者(男性57名,女性43名)的空腹静脉血于真空采血管内,离心10min(3500rpm,4℃),取上清液于2ml冻存管内,-80℃条件下保存。本研究经北京医院伦理委员会审核批准(编号:2016BJYYEC-121-02),研究对象均签署了知情同意书。
二、方法
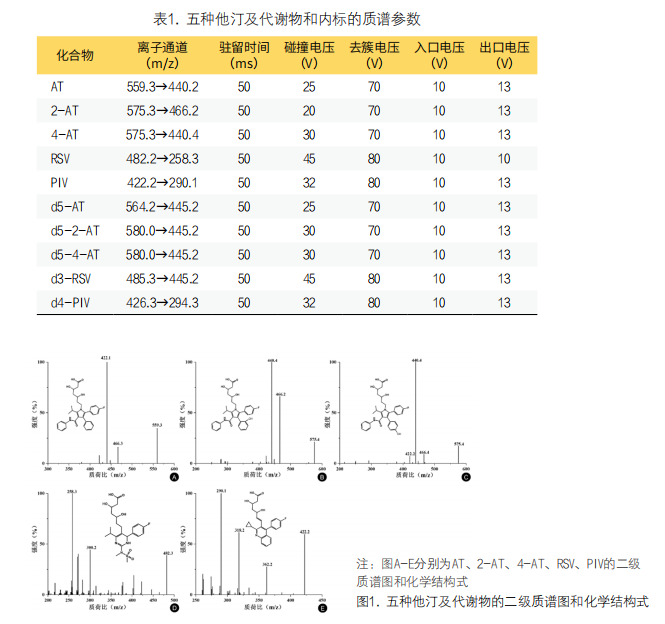
1. HPLC-MS/MS条件:采用美国Waters公司的XSelect HSS PFP(2.1mm×150mm,2.5μm)色谱柱,水-乙腈(38:62,v/v,含0.1%甲酸和2mM甲酸铵)为流动相等度洗脱进行色谱分离,流速200μl/min,柱温25℃,进样量3μl。选择电喷雾离子源(Electron sprayionization,ESI)进行离子化,正离子多反应监测模式(Multiple reaction monitoring,MRM)进行监测。五种待测物及其相应同位素标记内标的质谱参数如表1所示。五种待测物的化学结构式和二级质谱图如图1所示。质谱的源气参数设置如下:电喷雾电压550V,气帘气30.0psi,碰撞气Medium,去溶剂温度550℃,气雾气50.0psi,加热辅助气70.0psi。
2. 储备液、工作液、标准样品和质控样品的制备:将5种待测物和5种内标分别溶于乙腈溶液,配制成1 mg/ml的储备液。精密吸取储备液,以乙腈为溶剂进行稀释,分别配制混合标准工作液和混合内标工作液(d5-AT、d5-2-AT、d5-4-AT、d3-RSV浓度为200ng/ml,d4-PIV浓度为500ng/ml),分装、密封后在-80℃条件下保存。用不含他汀的空白血清稀释混合标准工作液至相应的浓度得到标准样品(Standard samples,STD)和质控样品(Quality control,QC)。配制极低浓度、低、中、高四个浓度的QC,其中AT、2-AT、4-AT、RSV浓度为0.1、1.0、8.0、32.0ng/ml,PIV浓度为0.25、2.5、20.0、80.0ng/ml。
3. 样本前处理:精密吸取100μl标准溶液、血清样品或QC样品于1.5ml离心管内,加入等体积乙酸铵缓冲溶液(pH4.0)和10μl的混合内标工作液(d5-AT、d5-2-AT、d5-4-AT、d3-RSV浓度为200ng/ml,d4-PIV浓度为500ng/ml),涡旋10s;加入500μl乙酸乙酯,震荡3min,离心10min(3500rpm,4℃);吸取400μl上层溶液,氮气流下吹干(室温);40μl流动相复溶,离心10min(12000rpm,4℃),取上清于带内插管的进样瓶中。
4. 方法学评价:方法学评价参考CLSI C62-A[31]和《液相色谱-质谱临床应用建议》[32]等指南,包括对方法的特异性、线性、检测限和定量限、不精密度、加标回收率、基质效应、稳定性等方面的考察。
(1)特异性评价:收集6份未服用他汀类药物的个体空白血清进行实验,考察人体血清中的内源物质是否会对待测物和内标的测定造成干扰。空白血清和加标血清经过前处理后,进样分析,观察各待测物和内标分析时间内是否有杂质峰干扰。
(2)线性、检测限和定量限评价:以待测物的浓度作为横坐标,待测物峰面积与内标峰面积的比值作为纵坐标,绘制标准曲线,经1/x加权后进行回归分析后得到线性回归方程和相关系数r。信噪比(Signal-to-noise ratio,S/N)≥3时的浓度定为检测限(Limit ofdetection,LOD),S/N≥10时的浓度定为定量限(Limit of quantitation,LOQ)。
(3)不精密度评估:用所建方法连续3天测定3批极低、低、中、高4个浓度的QC样本,每个浓度QC各设置6个平行管,计算批内、批间不精密度。
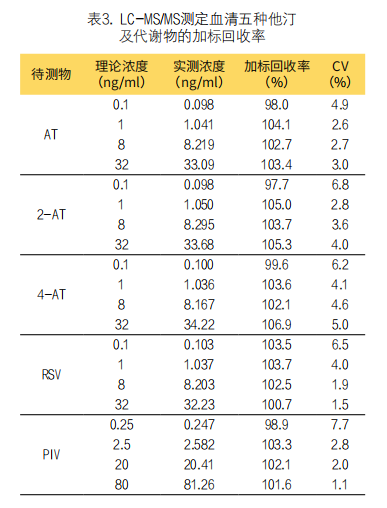
(4)加标回收率评估:用所建方法检测极低、低、中、高4个浓度的QC样本,每个浓度检测6次,计算加标回收率。加标回收率计算方法:加标回收率(%)=实测浓度待测物/理论浓度待测物×100%;理论浓度为实际添加待测物的浓度。
(5)基质效应评价:6份不同个体的空白血清经前处理后,用含有待测物和内标的流动相复溶,进样分析,待测物和内标的峰面积分别记为A1和A2。另取超纯水经同样处理,进样分析,待测物和内标的峰面积分别记为B1和B2。基质因子(Matrix factor,MF)计算公式如下:MF待测物=A1/B1,MF内标=A2/B2。经内标校正的基质效应(Matrix effect,ME)的计算公式为:ME=MF待测物/MF内标×100%。
(6)稳定性考察:为考察在不同储存条件下血清样本中待测物的稳定性,将4个浓度的QC样本分别放置在室温(3h)、4℃(24h)、-80℃(30day)条件下和反复冻融3次处理后,进行浓度测定。为考察经前处理后的样本稳定性,将4个浓度的QC样本经前处理后在室温(24h)、4℃(48h)条件下保存后,再进行浓度测定。
5. 统计学分析:采用SPSS 26进行数据统计分析,两组间差异采用Mann-Whitney U检验,三组间趋势性检验采用Jonckheere-Terpstra趋势检验,p<0.05具有统计学差异。采用GraphPad Prism 9.0和Origin 2020绘图。
结 果
1. 特异性:各个待测物的色谱峰见图2。空白血清中的内源性物质在分析时间内对待测物和内标的测定不造成干扰,具有良好的特异性。AT、2-AT、4-AT、RSV、PIV、d5-AT、d5-2-AT、d5-4-AT、d3-RSV、d4-PIV的保留时间分别为2.92min、2.78min、2.19min、2.77min、2.20min、2.51min、5.03min、2.91min、2.50min、5.10min。
注:A:空白血清加入标准品和内标(AT、2-AT、 4-AT和 RSV浓度为5ng/ml,PIV浓度为10ng/ml,d5-AT、d5-2-AT、d5-4-AT、d3-RSV和d4-PIV浓度为10ng/ml)经前处理后LC-MS/MS测定;B:空白血清前处理后LC-MS/MS测定
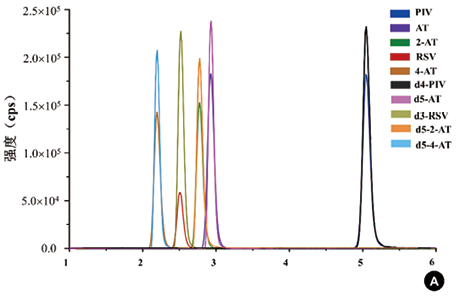
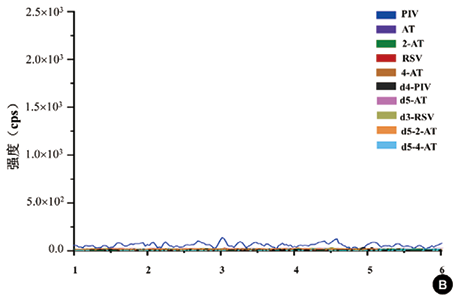
图2. LC-MS/MS测定血清中五种他汀及代谢物的色谱图
2. LC-MS/MS测定的线性、LOD和LOQ:AT、2-AT、4-AT、RSV在0.1~40.0ng/ml浓度范围内具有良好的线性表现,PIV在0.25~100ng/ml浓度范围内具有良好的线性表现,五种待测物的线性相关系数r均大于0.999。五种待测物的LOD均低于0.05ng/ml。AT、2-AT、4-AT、RSV的LOQ为0.1ng/ml,PIV的LOQ为0.25ng/ml。
3. LC-MS/MS测定的不精密度:五种待测物在低、中、高3个水平浓度的批内CV均在0.2%~6.1%,总CV均在1.5%~5.1%;在极低浓度水平的批内CV均在1.8%~7.6%,总CV均在4.9%~7.7%,具体结果见表2。
4. LC-MS/MS测定的加标回收率:五种待测物在低、中、高浓度水平的加标回收率为100.7%~107.0%;在极低浓度水平的加标回收率分别为97.7%~103.5%,加标回收率结果见表3。
5. LC-MS/MS测定的基质效应评价:利用6份不同个体的空白血清,考察在高、低两个浓度水平下的基质效应。五种待测物经内标校正的基质效应见表4,经内标校正后的基质效应均在97.1%~101.5%,CV均小于4.1%,无明显基质效应。

6. 样本的稳定性考察:4个水平(极低浓度、低、中、高)的QC样本经过室温放置3h,4℃放置24h,-80℃放置30天,反复冻融3次处理后,均能保持稳定,测定浓度为初始浓度的94.5%~106.3%。样本经过前处理后,在室温放置24h(25℃)、4℃放置48h后均能保持稳定,测定浓度为初始浓度的91.0%~107.5%。
7. LC-MS/MS测定血清中他汀及其活性代谢物的浓度:通过已建立的LC-MS/MS方法检测服用他汀类药物(AT、RSV、PIV)的100名行冠脉造影者血清,他汀及代谢物浓度分布如图3所示。其中,服用AT的患者共有39名,每天的剂量为10mg(n=14)、20mg(n=16)和40mg(n=8);服用RSV的患者共有35名,每天服药剂量为10mg(n=29)和20mg(n=5);服用PIV的患者共有26名,每天服药剂量为1mg(n=2)和2mg(n=6),其余患者服药剂量不明确。对他汀及其活性代谢物的血清浓度与剂量进行Jonckheere-Terpstra趋势检验分析,结果如图4所示。=0.006)。由于服用20mg的RSV和明确服用PIV具体剂量的样本量较少,不同剂量组间的他汀浓度差异无统计学意义。
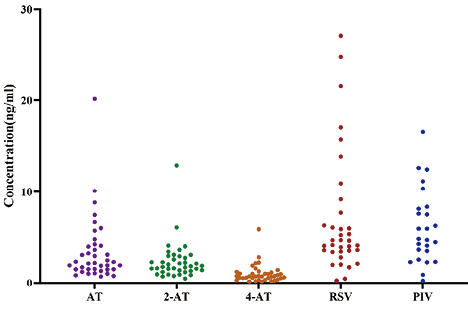
图3. LC-MS/MS测定100名行冠状动脉造影者血清中的AT、RSV、PIV及其代谢物水平
注:图A-C 分别为服用不同剂量AT的行冠状动脉造影者血清中AT、2-AT、4-AT的浓度水平;多组
检验采用Jonckheere-Terpstra趋势检验
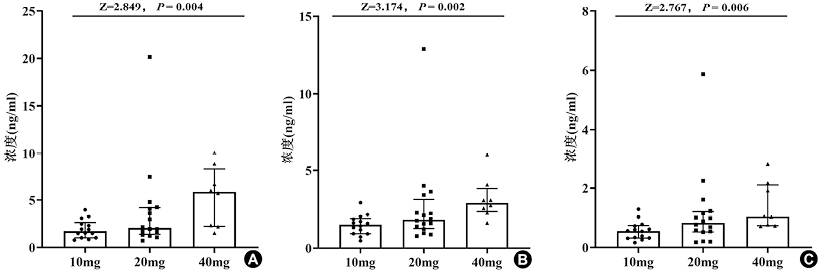
图4. 血清AT及代谢物浓度水平与服用剂量的关系
讨 论
阿托伐他汀、瑞舒伐他汀和匹伐他汀是临床上常用的他汀类药物。这些药物的使用在降低心血管疾病发生率和死亡率方面发挥了重要作用。国内外研究显示[33, 34],他汀类药物调脂治疗中存在患者依从性差等问题,这可能会导致血药浓度过低,治疗效果不理想。此外,患者的合并症、遗传多态性、药-药相互作用等因素也会导致其血药浓度过高,从而导致他汀相关性肌病等不良反应的发生[35, 36]。TDM可以提供患者服药和他汀反应情况等信息,帮助医生根据患者实际情况制定个体化给药方案,提高药物疗效,避免毒副反应的发生。在CVD流行病学研究中,通过自我报告/问卷调查的方式获取患者服药的种类和剂量,容易出现药物数据缺失,或引入回顾偏倚,也无法反映体内他汀代谢物的水平。而测定体内他汀和代谢物的浓度,可以帮助快速获取服药种类、剂量、血药浓度等信息,减少偏倚和药物数据缺失,在流行病学研究中也具有重要意义和应用前景。
他汀类药物以羟基酸的形式发挥药理活性,AT、RSV和PIV都是以活性形式给药,AT的代谢物2-AT和4-AT同样具有降脂活性,且在AT治疗过程中,大部分降脂活性由这两种活性代谢物提供[2, 37]。研究发现[38],他汀相关肌病患者体内4-AT的浓度显著高于健康人群。队列研究表明[39],4-AT的体内浓度与死亡风险增加独立相关,提示4-AT可能是预测心血管结局的标志物。因此,对他汀原型药物及其活性形式的血药浓度监测可以客观地反映其降脂疗效,辅助评估治疗过程中不良反应和心血管事件的风险。
他汀类药物的结构主要由含取代基的疏水性环状结构和药效基团(二羟基庚酸片段或其内酯形式)共同组成,疏水环及其环上取代基的种类决定了他汀类药物在极性、溶解性等方面的差异。例如,瑞舒伐他汀因其疏水环上取代水溶性的甲磺酰氨基而呈较强的亲水性,匹伐他汀因其环上取代基为脂溶性的三元环和氟代苯环而呈强亲脂性。此外,他汀类药物的羟基酸形式与内酯形式之间可以相互转化,该过程受温度、pH值等因素的影响。他汀类药物的理化性质差异和酸-内酯转化过程,给其准确分析定量带来了较大难度。
目前,已报道许多用于药代动力学研究和等效性研究的定量测定血样中他汀类药物及其代谢物浓度的LC-MS/MS方法,但大多只能测定单一他汀及其代谢物,仅有个别可同时检测多种他汀及代谢物。在已报道的测定单种他汀及其代谢物的方法中[15,17-21, 23-26],前处理环节所需样本的体积较大(200-1000μl),采用的固相萃取法步骤复杂,成本高。我们建立的方法所需的血清体积仅为100μl,选择乙酸乙酯进行液液萃取,操作更简单,成本更低,响应基线低,且无杂质峰干扰。同时,据文献报道[15-17, 23],前处理过程中,将pH值控制在4.0~5.0之间可以抑制他汀羟基酸与内酯形式之间的转化,而我们采用乙酸铵溶液调节血清的pH值至4.0~4.5,保证了他汀的准确定量。测定单种他汀及其代谢物的分析方法[15, 19-20, 23]的LOQ(0.05ng/ml)较低,但本方法具有同时定量三种他汀及其活性代谢物的优势,避免人工区分服用不同他汀的血样,可实现高通量检测。在已报道的同时定量测定多种他汀及代谢物的研究中[29-31],为将同分异构体分离都采用梯度洗脱方式,分析运行周期长(11-12min),且灵敏度较差,部分方法的基质效应明显。本研究采用的五氟苯基柱对他汀具有良好的保留和选择性,采用等度洗脱的方式便可实现对羟基取代在苯环邻位和对位的两种羟基阿托伐他汀的基线分离,这大大缩短了分析运行周期(6min),提高检测效率。本研究的基质效应接近100%,且CV<5%,表明待测物对应的稳定同位素氘代内标的使用有效校正了基质效应,提高了方法的准确度和精密度。本实验的批间和批内精密度均小于8%,待测物的加标回收率均在100%左右,LOQ可达ng/ml级(0.1ng/ml和0.25ng/ml),分析方法稳定,准确度高,灵敏度较高,可以满足流行病学筛查和治疗药物监测的临床应用的需求。
利用所建立的LC-MS/MS方法检测100名行冠状动脉造影者的血清,检测到的他汀种类均与患者病例中所报告的一致。在同一剂量下,患者血清他汀及其代谢物浓度相差较大,说明不同个体对剂量反应存在较大差异,这很有可能会造成调脂效果不佳,甚至出现严重的毒副作用和不良反应。对服用他汀类药物的患者进行他汀和代谢物浓度监测,可以帮助及时调整给药方案,提高药物治疗的安全性和有效性。趋势检验结果显示,AT及其活性代谢物2-AT、4-AT的血清浓度随着剂量增加而升高,说明其血清浓度可以一定程度上反映AT的暴露水平。不同剂量组的RSV和PIV样本量较少,下一步应扩大样本量进行验证。
综上,本研究建立了一种简易、灵敏、可靠的LC-MS/MS方法,应用于服用阿托伐他汀、瑞舒伐他汀和匹伐他汀药物人群的血药浓度监测,客观地反映他汀类药物的暴露剂量,有望为TDM、个体化用药指导及CVD流行病学研究提供技术手段。
参考文献
Zhao D, Liu J, Wang M, et al. Epidemiology of cardiovascular disease in China: current features and implications [J]. Nat Rev Cardiol, 2019, 16: 203-212.
Sirtori CR. The pharmacology of statins [J]. Pharmacol Res, 2014, 88: 3-11.
Oesterle A, Laufs U, Liao JK. Pleiotropic Effects of Statins on the Cardiovascular System [J]. Circ Res, 2017, 120: 229-243.
Almeida SO, Budoff M. Effect of statins on atherosclerotic plaque [J]. Trends Cardiovasc Med, 2019, 29: 451-455.
Adhyaru BB, Jacobson TA. Safety and efficacy of statin therapy [J]. Nature Reviews Cardiology, 2018, 15: 757-769.
Patel M, Kothari C. Critical review of statins: A bio-analytical perspective for therapeutic drug monitoring [J]. Trac-Trends in Analytical Chemistry, 2017, 86: 206-221.
Valesky RJ, Liu L, Musson DG, et al. Automated enzyme inhibition assay method for the determination of atorvastatin-derived HMG-CoA reductase inhibitors in human plasma using radioactivity detection[J]. J Pharmacol Toxicol Methods, 2008; 57: 61-69.
Sithole MN, Oosthuysen E, Jaarsveld JV, et al. Development and validation of an HPLC method to be used for simultaneous detection and quantification of different statins after ex vivo skin diffusion studies [J]. Pharmazie, 2021; 76: 583-587.
Martins AF, Frank CDS, Altissimo J, et al. Determination of statin drugs in hospital effluent with dispersive liquid-liquid microextraction and quantification by liquid chromatography[J]. J Environ Sci Health A Tox Hazard Subst Environ Eng, 2017; 52: 939-945.
Kumar TR, Shitut NR, Kumar PK, et al. Determination of rosuvastatin in rat plasma by HPLC: Validation and its application to pharmacokinetic studies[J]. Biomed Chromatogr, 2006; 20: 881-887.
Zarghi A, Shafaati A, Foroutan SM, et al. A simple and rapid HPLC method for the determination of atorvastatin in human plasma with UV detection and its application to pharmacokinetic studies[J]. Arzneimittelforschung, 2005; 55: 451-454.
Shah Y, Iqbal Z, Ahmad L et al. Simultaneous determination of rosuvastatin and atorvastatin in human serum using RP-HPLC/UV detection: method development, validation and optimization of various experimental parameters[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011; 879: 557-563.
Morris MJ, Gilbert JD, Hsieh JY, et al. Determination of the HMG-CoA reductase inhibitors simvastatin, lovastatin, and pravastatin in plasma by gas chromatography/chemical ionization mass spectrometry[J]. Biol Mass Spectrom, 1993; 22: 1-8.
Borek-Dohalský V, Huclová J, Barrett B, et al. Validated HPLC-MS-MS method for simultaneous determination of atorvastatin and 2-hydroxyatorvastatin in human plasma-pharmacokinetic study[J]. Anal Bioanal Chem, 2006; 386: 275-285.
Macwan JS, Ionita IA, Dostalek M, et al. Development and validation of a sensitive, simple, and rapid method for simultaneous quantitation of atorvastatin and its acid and lactone metabolites by liquid chromatography-tandem mass spectrometry (LC-MS/MS) [J]. Anal Bioanal Chem, 2011, 400: 423-433.
M Jemal 1, Z Ouyang, B C Chen, et al.Quantitation of the Acid and Lactone Forms of atorvastatin and its biotransformation products in human serum by high-performance liquid chromatography with electrospray tandem mass spectrometry[J]. Rapid Commun. Mass Spectrom., 1999;13(11):1003-15.
Cestari RN, Rocha A, Marques MP, et al. Simultaneous analysis of the total plasma concentration of atorvastatin and its five metabolites and the unbound plasma concentration of atorvastatin: Application in a clinical pharmacokinetic study of single oral dose [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2019, 1126-1127: 121766.
Nirogi RV, Kandikere VN, Shukla M, et al. Simultaneous quantification of atorvastatin and active metabolites in human plasma by liquid chromatography-tandem mass spectrometry using rosuvastatin as internal standard [J]. Biomed Chromatogr, 2006, 20: 924-936.
Ghosh C, Jain I, Gaur S, et al. Simultaneous estimation of atorvastatin and its two metabolites from human plasma by ESI-LC-MS/MS [J]. Drug Test Anal, 2011, 3: 352-362.
Partani P, Verma SM, Gurule S, et al. Simultaneous quantitation of atorvastatin and its two active metabolites in human plasma by liquid chromatography/(-) electrospray tandem mass spectrometry [J]. J Pharm Anal, 2014, 4: 26-36.
Cai L, Zheng Z, Wang X, et al. Simultaneous determination of atorvastatin and its metabolites in human plasma by UPLC-MS/MS [J]. Analytical Methods, 2017, 9: 1038-1045.
Shen-Tu JZ, Xu X, Liu J, et al. Determination of Pitavastatin in Human Plasma by LC-MS-MS[J]. Chromatographia, 2009; 69: 1041-1047.
Qi X, Ding L, Wen A, et al. Simple LC-MS/MS methods for simultaneous determination of pitavastatin and its lactone metabolite in human plasma and urine involving a procedure for inhibiting the conversion of pitavastatin lactone to pitavastatin in plasma and its application to a pharmacokinetic study [J]. J Pharm Biomed Anal, 2013, 72: 8-15.
邱畅, 温预关, 张明等. LC-MSMS法检测人血浆中瑞舒伐他汀的浓度[J]. 今日药学, 2010.
Macwan JS, Ionita IA, Akhlaghi F. A simple assay for the simultaneous determination of rosuvastatin acid, rosuvastatin-5S-lactone, and N-desmethyl rosuvastatin in human plasma using liquid chromatography-tandem mass spectrometry (LC-MS/MS) [J]. Anal Bioanal Chem, 2012, 402: 1217-1227.
Bai X, Wang XP, He GD, et al. Simultaneous Determination of Rosuvastatin, Rosuvastatin-5 S-lactone, and N-desmethyl Rosuvastatin in Human Plasma by UPLC-MS/MS and Its Application to Clinical Study [J]. Drug Res (Stuttg), 2018, 68: 328-334.
Deng JW, Kim KB, Song IS, et al. Determination of two HMG-CoA reductase inhibitors, pravastatin and pitavastatin, in plasma samples using liquid chromatography-tandem mass spectrometry for pharmaceutical study [J]. Biomed Chromatogr, 2008, 22: 131-135.
Wang J, Luzum JA, Phelps MA, et al. Liquid chromatography-tandem mass spectrometry assay for the simultaneous quantification of simvastatin, lovastatin, atorvastatin, and their major metabolites in human plasma [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 983-984: 18-25.
El-Zailik A, Cheung LK, Wang Y, et al. Simultaneous LC-MS/MS analysis of simvastatin, atorvastatin, rosuvastatin and their active metabolites for plasma samples of obese patients underwent gastric bypass surgery [J]. J Pharm Biomed Anal, 2019, 164: 258-267.
Wagmann L, Hemmer S, Caspar AT, et al. Method development for quantitative determination of seven statins including four active metabolites by means of high-resolution tandem mass spectrometry applicable for adherence testing and therapeutic drug monitoring [J]. Clinical Chemistry and Laboratory Medicine, 2020, 58: 664-672.
Lynch KL. CLSI C62-A: A New Standard for Clinical Mass Spectrometry[J]. Clin Chem, 2016; 62: 24-29.
中华医学会检验医学分会, 卫生计生委临床检验中心. 液相色谱-质谱临床应用建议[J]. 中华检验医学杂志, 2017; 40: 770-779.
Alefishat E, Jarab AS, Al-Qerem W, et al. Factors Associated with Medication Non-Adherence in Patients with Dyslipidemia[J]. Healthcare (basel), 2021; 9.
张丹, 葛蕾, 李静等. 中国39家大医院动脉粥样硬化性心脑血管病患者他汀类药物应用现状调查[J]. 中华心血管杂志, 2011; 39: 397-401.
Stroes ES, Thompson PD, Corsini, A, et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management[J]. Eur Heart J, 2015; 36: 1012-1022.
Chatzizisis YS, Koskinas KC, Misirli G, et al. Risk factors and drug interactions predisposing to statin-induced myopathy: implications for risk assessment, prevention and treatment[J]. Drug Saf, 2010; 33: 171-187.
Lins RL, Matthys KE, Verpooten GA, et al. Pharmacokinetics of atorvastatin and its metabolites after single and multiple dosing in hypercholesterolaemic haemodialysis patients [J]. Nephrol Dial Transplant, 2003, 18: 967-976.
Hermann M, Bogsrud MP, Molden E, et al. Exposure of atorvastatin is unchanged but lactone and acid metabolites are increased several-fold in patients with atorvastatin-induced myopathy[J]. Clin PharmacolTher, 2006; 79: 532-539.
Zhou XH, Cai LY, Lai WH, et al. Impact of Plasma Exposure of Statins and Their metabolites With Major Adverse Cardiovascular Events in Chinese Patients With Coronary Artery Disease[J]. Front Pharmacol, 2020; 11: 675.




