液相色谱-串联质谱法检测血清鞘氨醇-1-磷酸方法的建立与临床应用研究

胡敏,教授,主任技师,博士研究生导师。现任中南大学湘雅二医院检验医学科主任,湖南省临床分子诊断中心主任。中华医学会检验医学分会委员,湖南省医学会检验专业委员会主任委员,中华检验医学杂志编委、CNAS技术评审员等。长期从事脂代谢、慢性炎症、肝纤维化等方面研究,发表论文80余篇,以第一作者或通讯作者发表SCI论文30余篇。主持国家自然科学基金、湖南省重点研发、长沙市重大专项等国家级、省部级课题十余项。
龙琪琛,中南大学湘雅二医院检验医学科,医学博士,主管技师,湖南省临床分子诊断中心质谱实验室负责人。获得北京协和医学院-国家卫生健康委临床检验中心-临床检验诊断学博士学位,主要研究方向为临床生化检验项目标准化、小分子代谢物和蛋白质质谱检测方法开发等。以课题负责人承担湖南省自然科学基金1项,累计发表文章十余篇,以第一作者/共同第一作者发表论文6篇。
【摘要】目的 本文旨在开发和验证用于临床血清S1P测量的液相色谱-串联质谱(LC-MS/MS)方法,并比较健康志愿者和两种不同血清型CHB患者的血清S1P水平。方法 血清样本使用甲醇蛋白沉淀来进行样本前处理。色谱柱使用Kinetex® C18色谱柱(100×2.1mm,2.6μm),通过LC-MS/MS进行S1P的测定。本研究对方法的基质效应、线性、不精密度、分析回收、检测限定量限和携带污染进行了评价,并且对血液样本中S1P的储存稳定性进行了评估。此外,该方法还应用于21名健康志愿者、28名HBeAg阳性CHB患者和42名HBeAg阴性CHB患者的血清S1P检测。结果 色谱分析时间为4分钟。本方法S1P的检测范围为9.86~804.43ng/ml(R2>0.9990),定量下限为4.62ng/mL,检测限为1.39ng/ml。总不精密度为2.9%∼7.5%,分析回收率为99.3%~106.3%。室温对全血样本对S1P浓度影响较大,在4℃至少可稳定保存4h。对于患者样本检测,健康志愿者和HBeAg阴性CHB患者之间的血清S1P水平存在显着差异 [297.07(245.18,314.25)vs. 314.90(279.03, 376.38)ng/ml;p<0.05];此外,HBeAg阴性CHB患者的血清S1P水平高于HBeAg阳性CHB患者 [297.07(245.18,314.25)vs. 285.01(240.61, 307.90)ng/ml;p<0.01]。结论 本研究开发了一种简单、快速、精确的血清S1P临床检测方法。稳定性结果表明立即进行血清分离或放于4℃对于取得准确结果十分重要。本研究还显示出S1P作为CHB严重程度早期指标的潜力,有利于CHB抗病毒治疗的管理。
【关键词】HBeAg;慢性乙型肝炎;鞘氨醇-1-磷酸;液相色谱-串联质谱;1-磷酸-鞘氨醇
慢性乙型肝炎(CHB)是世界上最常见的慢性病毒感染[1, 2],若不能得以及时的诊断和治疗可进展为肝癌并造成终身损害[3, 4]。越来越多的临床证据表明肝纤维化程度是CHB的主要预后因素之一,它与肝硬化及肝硬化相关并发症的发生风险相关[5, 6]。因此,准确识别CHB患者的肝纤维化程度和疾病进程,早期对其进行干预对于临床治疗非常重要。目前识别CHB患者肝纤维化的金标准为肝脏病理活检,但因其为侵入性操作,相较之下,血清标志物得到临床更广泛的关注。而CHB患者实际临床应用的主要血清标志物大多存在诊断准确度不高,预测价值有限的局限性[7]。因此,临床上亟需开发新的血清生物标志物来预测和评估CHB患者严重程度。
鞘氨醇-1-磷酸(S1P)是磷脂代谢过程中产生的脂质介质之一。作为调节细胞生长的第二信使,越来越多的证据表明,S1P参与癌症[8, 9]、心血管疾病[10, 11]、糖尿病[12]、脑衰老和中枢神经系统疾病[13]以及病毒感染[14, 15]等病理生理过程。据已有报道,S1P也与肝脏疾病有关[16]。S1P对肝星状细胞增殖具有刺激作用,并调节肝纤维化过程中细胞外基质的表达[17]。红景天苷可通过SphK1下调SphK/S1P/S1PR通路[18],抑制肝星状细胞的活化和迁移,缓解肝纤维化;LncRNA H19在人纤维化中显著升高,对其进行敲除可减弱胆汁淤积小鼠肝纤维化程度,降低S1PR2的表达[18]。这些研究表明,S1P与肝纤维化发展密切相关,可能是CHB纤维化严重程度的潜在预测标志物。
目前,血清S1P的测定手段主要为酶联免疫吸附测定(ELISA)和液相色谱-串联质谱(LC-MS/MS)[19-21]。ELISA由于其经济有效性低下,且存在抗原抗体交叉反应的方法学局限性,尚未得到广泛应用。LC-MS/MS以其高灵敏度、特异性和准确性的特点成为许多生物标志物测定的金标准。目前已有部分研究开发了血清S1P的LC-MS/MS检测方法[21-28],但存在方法正确度和精密度不足、前处理复杂[24, 28]、分析时间长[22, 27]等问题,其检测过程和方法性能仍然存在改进的空间。
因此,本研究开发并验证了一种经济,高效且精确的血清S1P的LC-MS/MS方法,该方法分析时间短,前处理仅需一步蛋白沉淀,适用于临床检测。同时本研究也进一步评估了健康个体和两种不同血清型CHB患者之间血清S1P水平的差异,以探究S1P作为CHB患者早期指标的潜力。
对象与方法
一、对象
本研究的血清样品取自2021年1月至10月中南大学湘雅二医院临床实验室21名表面健康志愿者、28例HBsAg(+)/HBeAg(+)/Anti-HBc(+)乙型肝炎患者(下文简称大三阳乙肝患者)和42例HBsAg(+)/Anti-HBe(+)/Anti-HBc(+)乙型肝炎患者(下文简称小三阳乙肝患者)的血清,并在-80℃下保存后进行检测。正常对照血清的纳入标准是肝功能正常的健康人群。大三阳乙肝患者纳入标准为HBsAg,HbeAg,HbcAb呈阳性,小三阳乙肝患者为HBsAg,HBeAb,HBcAb检测呈阳性,排除肝癌或肝硬化患者。该研究方案获得湘雅二医院调查审查委员会的批准。
二、方法
1. 仪器和试剂:(1)仪器:用于溶液配置的十万分之一天平CPA225D购自德国Sartorius公司,微量移液器(20μl,100μl,200μl,1000μl)购自美国Ependorf公司。用于样本前处理的漩涡混匀仪和离心机均购自上海大龙公司。液相色谱串联质谱系统:岛津LC-30A高效液相色谱仪(Shimadz,日本)串联AB/Sciex API 5500三重四级杆质谱仪(AB SCIEX,美国)。使用Kinetex® C18色谱柱(100×2.1mm,2.6μm)进行色谱分离。(2)化学试剂:标准品C18-S1P和内标C17-S1P 购自美国Avanti Polar Lipids公司,纯度均大于99%。甲酸、甲醇、乙腈、乙醇、氯仿、2-丙醇都是HPLC级,购自美国Fisher公司。实验所用的去离子水由Milli-Q Reference装置产生。
2. 标准溶液配制:标准溶液由甲醇稀释储备溶液得到,配置标准溶液浓度分别为9.86ng/ml、18.47ng/ml、35.53ng/ml、67.98ng/ml、129.63ng/ml、246.26ng/ml、465.25ng/ml、804.43ng/ml。浓度由低到高分别记为STD1~STD8,1ml/支分装,保存至-80℃冰箱。每次检测前将50μl标准溶液与50μL内标(1:1)混合以制备标准曲线。
3. 内标溶液配制:用DMSO:HCl(v:v,100:2)制备浓度为1000mg/L的内标C17-S1P母液。取20μl内标母液加入20ml乙醇溶液后混匀,稀释为浓度约1000ng/ml的内标C17-S1P储备液。1ml/支分装,保存至-80℃冰箱备用。
4. 质控品配制:收集50mL中南大学湘雅二医院检验科健康体检人群剩余血清,排除严重溶血、脂血、黄疸样本,混合均匀后冻存于-80℃冰箱备用。使用4%BSA稀释混合血清或者在混合血清中加入S1P储备液来制备质控品,最终配置浓度为59.3ng/mL,118.6ng/mL,237.2ng/mL,474.4ng/mL,711.6ng/mL的质控品。1mL/支分装,保存至-80℃冰箱,并在使用前置于室温。
三、样本前处理
选择甲醇蛋白沉淀法对样本进行前处理,具体方案为:取50μL血清于1.5ml EP管,加入50μl内标,立即震荡,将内标与血清中的S1P混匀,然后加入450μl甲醇,震荡混匀30分钟进行蛋白沉淀。最后,15000r/min离心5分钟,取100μl上清,加入200μl流动相(甲醇:水,1:1),震荡混匀后进行分析。
四、色谱和质谱条件
1. 色谱条件:本研究使用选择Kinetex® C18柱(100×2.1mm,2.6μm)进行色谱分离,柱温为45℃。流动相A为含1%甲酸的去离子水,流动相B为乙腈。流速为0.60ml/min。流速为0.6ml/min条件下,流动相B在0.01~1.5min内流动相B由50%增加到100%,在1.50~2.50min内以100%B进行等度洗脱,然后0.0min内从100%B降低为50%B,在2.51~4min以50%B进行等度洗脱,总分析时间为4min。
2. 质谱条件:MS/MS检测在正电喷雾电离模式下进行,具有多重反应监测(MRM)。定量分子的离子反应为S1P(m/z 380.2→264.3);C17-S1P(m/z 366.4→250.2)以氮气为帘式气体(25psi)、雾化器气体(30psi)、辅助气体(60psi)、碰撞气体(4psi)。涡轮气体温度(TEM)为400℃,停留时间为150ms,DP为70v,EP为10v,CE为20v,CXP为15。
结 果
一、方法性能评价
1. 基质效应:通过在提取后添加法来评估基质效应。本研究设计了三组样本:A组:在血清样本前处理之后分别加入50μl的246.26ng/ml、328.36ng/ml的标准品和50μl内标;B组:只加入50μl 246.26ng/ml、328.36ng/ml的标准品和50μl内标;C组:在血清样本前处理之后分别加入50μL甲醇和50μL内标。利用分析物峰面积与其IS峰面积比值的平均值计算基质效应。S1P的基质效应:(A组S1P峰面积-C组S1P峰面积)/B组S1P峰面积*100%;C17-S1P的基质效应:A组内标峰面积/B组内标峰面积。
2. 提取回收率:提取回收主要用于考察在样本前处理过程中,分析物的损耗。通过在蛋白质沉淀之前或之后加入S1P标准品和内标,来评估提取回收率。内标的提取回收率:提取前加内标的内标峰面积/提取后加内标的内标峰面积;S1P的提取回收率:提取前加S1P的S1P峰面积/提取后加S1P的S1P峰面积。
3. 线性评价:利用称量法稀释S1P母液,制备浓度依次为9.86ng/ml、18.47ng/ml、35.53ng/ml、67.98ng/ml、129.63ng/ml、246.26ng/ml、465.25ng/ml、804.43ng/ml的8个标准品。绘制标准曲线时,以标准品浓度为横坐标,分析物和内标峰面积比值为纵坐标,计算出的直线方程即为标准曲线,统计十条标准曲线进行线性评价。
4. 精密度:为了评估该方法的精密度,在健康人的混合血清中加入不同体积的4% BSA或S1P母液,得到五个浓度水平范围在69.68~666.46ng/ml。每个水平的样本准备三个重复平行管,连续三天独立重复进行。计算批内、批间和总精密度。
5. 分析回收率:将50µl三种不同浓度的S1P标准品(35.53ng/ml、67.9ng/ml、246.26ng/ml)分别加入50 µl混合血清(202.12ng/ml)中,并将计算出的添加浓度与预期浓度相比较,来计算分析回收率。
6. 检测限和定量限:为考察方法的检测限和定量限,本研究用4% BSA对血清样本进行稀释,稀释后血清的最终S1P浓度为13.00ng/ml。计算信噪比S/N=3时的S1P浓度为检测限,S/N=10时的S1P浓度为定量限。
7. 携带污染的评价:在连续进样了三针高浓度质控品后,进样了两针纯水空白样本以评估该方法的携带污染。
二、样本稳定性及储存稳定性
选取表面健康人群中的16名志愿者并将其平均分为A、B两组(男女比例为1:1),来探究血液样本未离心前,放置时间和温度对S1P浓度的影响。使用黄色分离胶采血管每人空腹抽血四管,A组志愿者的四管全血分别在4℃放置0、2、4、8h后离心,B组志愿者的全血分别在室温放置0、2、4、8h后离心,随后采用所建LC-MS/MS方法对各样本进行S1P检测。
三、S1P检测方法的临床应用
经性别年龄配对后,采用所建方法对21名健康的志愿者、28名大三阳乙肝患者和42名小三阳乙肝患者的血清S1P浓度进行检测。在7600-210自动生化分析仪(日立,日本)中对所有样本进行血清丙氨酸氨基转移酶(ALT),天冬氨酸转氨酶(AST),总蛋白(TP),白蛋白(ALB),球蛋白(GLO),直接胆红素(DBIL),总胆红素(TBIL)和总胆汁酸(TBA)检测。采用 CL6000i 化学发光仪(迈瑞,中国)测定所有受试者血清肝纤四项四型胶原 (C IV)、透明质酸 (HA)、多粘蛋白(LN)和三型胶原(PIIINP)的表达水平;采用iFlash 3000-H化学发光仪(亚辉龙,中国)测定血清中壳多糖酶3样蛋白1(CHI3L1)的浓度。使用Kruskal Wallis检验以及 Spearman秩相关检验等方法用于多组间的结果比较分析。数据以中位数(四分位数间距)表示。认定有统计学差异的标准为:p<0.05。
结 果
1. 方法性能评价:基质效应结果如表1所示,基质效应为95.7%~96.1%,这表明经过甲醇蛋白沉淀法处理过的血清基质对质谱检测S1P的影响不大。

2. 提取回收率:本方法中内标和分析物的平均提取回收率分别为74.0%和73.6%。
3. 线性评价:表2显示了10条标准曲线的线性方程和R2,斜率范围在0.0040~0.0048,截距范围为-0.0177~0.0216,R2均大于0.9990,表明线性良好。典型的S1P标准曲线图如图1。


图1. S1P标准曲线
4. 不精密度:观察到五个浓度梯度的批内、批间和总的CVs范围分别为2.0∼5.7%、1.3∼6.3%和2.9∼7.5%(表3)。

5. 分析回收率:分析回收率结果如表4所示,范围为99.3%~106.3%。

6. 检测限和定量限:稀释后S1P浓度为13.00ng/ml的血清样本所产生S/N为28.13,CV为15.0%。因此可估算S/N=10时的浓度即所开发方法的定量限为4.62ng/ml,S/N=3时的浓度即所开发方法的检测限为1.39ng/ml。
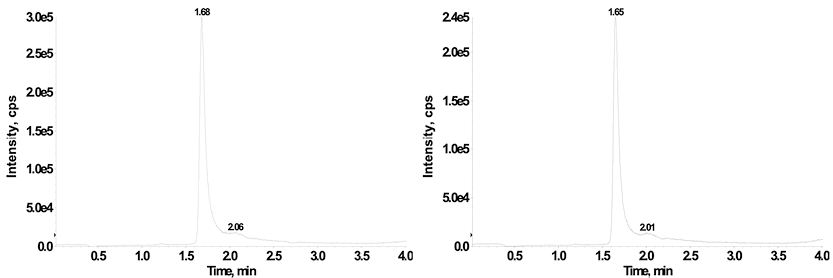
7. 携带污染:如图2所示,空白样品在S1P的保留时间内没有检测到明显的峰值,证明该方法不存在明显的携带污染,可以满足检测要求。

注:图A为高浓度质控品,图B为空白样本
图2. 所建方法携带污染结果色谱图
四、样本稳定性及储存稳定性
稳定性结果如图3所示。结果表明,全血在4℃保存时,S1P浓度在0-4小时没有明显变化(P<0.05),在放置8h时浓度上升显著。而在室温下储存时,0-2h内S1P浓度增加趋势明显,但没有统计学意义(P=0.053),这可能与本研究样本量较小有关。在室温放置4h和8h时S1P浓度上升显著。这些说明储存温度和储存时间会对内源性S1P浓度造成影响,立即进行血清分离对于取得可靠结果十分重要。

图3. 存储条件对S1P浓度的影响
五、S1P检测方法的临床应用
健康志愿者和CHB患者的一般临床数据和肝损伤血清学指标如表5所示。其中,小三阳组血清S1P水平高于对照组 [297.07(245.18,314.25)vs. 314.90(279.03,376.38)ng/ml;p<0.05],而大三阳组血清S1P水平与对照组相比无统计学差异(p>0.05)。此外,小三阳组血清S1P水平高于大三阳组 [297.07(245.18,314.25)vs. 285.01(240.61,307.90)ng/ml;p<0.01](见图4)。
进一步分析乙肝患者血清S1P水平与各肝功能和肝纤维化指标之间的相关关系,发现S1P与肝维化指标C IV(r=0.264;p=0.011)和CHI3L1(r=0.295;p=0.004)呈正相关关系(图5),而与血清酶学(ALT、AST)、蛋白质(TP、ALB、GLO)、胆红素(TBIL、DBIL)以及TBA等肝功能指标的相关关系无统计学差异(p>0.05)。

图4. 正常人与乙肝患者血清S1P水平比较
注:乙肝患者血清S1P水平与肝纤维化指标(a)C IV和(b)CHI3L1的相关性分析

图5. 乙肝患者血清S1P水平与肝纤维化指标C IV和CHI3L1的相关性
讨 论
准确测量S1P水平对于CHB患者的治疗监测和早期风险分层非常重要。目前已有研究建立了几种LC-MS/MS方法用于S1P的定量,但很少有方法得到充分验证并在临床检测中使用。在本研究中,我们开发并验证了检测血清S1P的LC-MS/MS方法。该方法分析时间仅需4分钟,分析时间是以往报道的LC-MS/MS方法的一半[23, 28],用血量仅需50μl,适合应用于临床常规检测。此外,以往S1P的前处理方式常通过甲醇沉淀和氯仿萃取方法提取[26, 27]。具有的劣势用作萃取溶剂的氯仿对环境不友好,对人体有害。根据基质效应结果,我们将蛋白质沉淀联合液液萃取的方法与单独使用甲醇进行蛋白质沉淀的结果进行对比,发现两者在峰形上没有显著差异,且后者能保持较低的基线水平和较高的响应(如图6)。该方法未观察到明显的离子抑制或增强。因此,本研究选择简单经济且无环境危害的单步蛋白质沉淀法进行样本前处理,对所开发方法的线性度、灵敏度、基质效应、精密度、分析回收率和携带污染进行全面验证,结果在CLSI C62-A的可接受范围内[29]。该方法的检出限(1.39ng/mL)小于健康人群报告的S1P水平的1/100[30]。本方法的总不精密度≤7.5%,分析回收率为99.3%~106.3%,性能与以往研究的LC-MS/MS方法相比(分析回收率:95.2~111%,不精密度:0.44~13.6%)[21-28]有明显改善。
注:A:单步蛋白质沉淀,B:蛋白沉淀串联液液萃取
图6. 不同预处理方法对S1P检测的影响
既往研究表明,对于离心后的血液样本,S1P浓度没有明显变化[21]。这表明,外界环境对血清中S1P稳定性影响不大。本研究中,S1P浓度在室温放置2h内上升趋势明显,室温放置4h内显著上升(P<0.05),最有可能与血液中的细胞成分红细胞和血小板有关。与其他类型的细胞相比,红细胞和血小板中S1P的代谢有独特的特征。红细胞和血小板合成鞘磷脂的能力很弱,因此缺乏从通用途径合成S1P的能力,但它们可以有效摄入血浆中的鞘氨醇直接通过SphK1/2磷酸化作用合成S1P[31]。此外,红细胞内S1P裂解酶和S1P磷酸酶的活性很低,血小板中鞘氨醇激酶2活性很高且缺乏S1P裂解酶,这使得它们能够大量产生和储存S1P[32, 33]。血液循环中50%以上的S1P来源于红细胞和血小板[34]。在放置过程中红细胞和血小板可能会持续性释放S1P而导致血清S1P浓度升高。然而目前关于室温下全血中S1P浓度上升的具体机制仍不明确,还需要更多的研究来阐明。与以前的研究结果[35]一致,本研究发现采血后,立即将血液放于4℃,S1P浓度至少在4小时内保持稳定。因此,抽血后立即将血液置于4℃,并在4小时内离心也能取得良好的效果。
我们将所建方法进一步应用于检测健康志愿者和两种不同血清型CHB患者的血清S1P水平,结果显示乙型肝炎患者血清S1P水平高于健康对照组,这与文献中大多数炎症性疾病S1P上调的结论一致。然而,我们的研究表明S1P水平仅在小三阳乙肝患者的血清中升高,在大三阳乙肝患者血清中没有增加。这与本课组前期相关结果一致:apoM作为人体内S1P的主要载体,在小三阳乙肝患者血清升高并与HBV DNA水平呈正相关,但在大三阳乙肝患者血清中apoM与HBV DNA水平无相关性[36, 37]。此外,本研究还表明大三阳和小三阳在内的乙肝患者血清S1P水平与肝纤维化指标C IV、CHI3L1呈正相关,显示出血清S1P作为CHB患者肝纤维化严重程度评价指标的潜力。然而本研究仍存在局限性:首先本研究的样本量不足,可能需要研究更多的临床样本来证实这一点。其次尽管本研究发现HBeAg阴性CHB患者中S1P升高,但尚不清楚确切机制,仍需要进一步研究。
结 论
综上所述,本研究开发了一种简单、快速且精确的血清S1P临床检测方法,并对新鲜血液样本中S1P的储存稳定性进行初步评估以确定样品储存的合适条件。此外,本研究还将该方法应用于患者样本的检测。健康志愿者与HBeAg阴性CHB患者之间血清S1P水平的显著差异显示了其作为CHB患者早期指标的潜力,有利于CHB的抗病毒治疗管理。
参考文献
Word Health Organization. Available from: https://www.who.int/news-room/fact-sheets/detail/hepatitis-b [Accessed 27 July 2021].
C. Trepo, H.L. Chan, A. Lok, Hepatitis B virus infection, Lancet 384(9959) (2014) 2053-63.
Hepatitis B virus infection, Nat Rev Dis Primers 4 (2018) 18036.
T. Tu, J.M. Block, S. Wang, C. Cohen, M.W. Douglas, The Lived Experience of Chronic Hepatitis B: A Broader View of Its Impacts and Why We Need a Cure, Viruses 12(5) (2020).
Lu XJ, Li XH, Yuan ZX, Sun HY, Wang XC, Qi X, Zhang X, Sun B. Assessment of liver fibrosis with the gamma-glutamyl transpeptidase to platelet ratio: a multicentre validation in patients with HBV infection. Gut. 2018 Oct; 67(10): 1903-1904.
Qi X, Zhang X, Li Z, Hui J, Xiang Y, Chen J, Zhao J, Li J, Qi FZ, Xu Y. HVPG signature: A prognostic and predictive tool in hepatocellular carcinoma. Oncotarget. 2016 Sep 20; 7(38): 62789-62796.
G. Singh, E. M. Yoshida, S. Rathi, V. Marquez, P. Kim, S.R. Erb, B.S. Salh, Biomarkers for hepatocellular cancer, World J Hepatol 12(9) (2020) 558-573.
K. Czubowicz, H. Jesko, P. Wencel, W.J. Lukiw, R.P. Strosznajder, The Role of Ceramide and Sphingosine-1-Phosphate in Alzheimer's Disease and Other Neurodegenerative Disorders, Mol Neurobiol 56(8) (2019) 5436-5455.
K. Takabe, S. Spiegel, Export of sphingosine-1-phosphate and cancer progression, J Lipid Res 55(9) (2014) 1839-46.
I. Soltau, E. Mudersbach, M. Geissen, E. Schwedhelm, M.S. Winkler, M. Geffken, S. Peine, G. Schoen, E.S. Debus, A. Larena-Avellaneda, G. Daum, Serum-Sphingosine-1-Phosphate Concentrations Are Inversely Associated with Atherosclerotic Diseases in Humans, PLoS One 11(12) (2016) e0168302.
F. Zhang, Y. Xia, W. Yan, H. Zhang, F. Zhou, S. Zhao, W. Wang, D. Zhu, C. Xin, Y. Lee, L. Zhang, Y. He, E. Gao, L. Tao, Sphingosine 1-phosphate signaling contributes to cardiac inflammation, dysfunction, and remodeling following myocardial infarction, Am J Physiol Heart Circ Physiol 310(2) (2016) H250-61.
J. Guitton, C.L. Bandet, M.L. Mariko, S. Tan-Chen, O. Bourron, Y. Benomar, E. Hajduch, H. Le Stunff, Sphingosine-1-Phosphate metabolism in the Regulation of Obesity/Type 2 Diabetes, Cells 9(7) (2020).
M. Nagahashi, M. Abe, K. Sakimura, K. Takabe, T. Wakai, The role of sphingosine-1-phosphate in inflammation and cancer progression, Cancer Sci 109(12) (2018) 3671-3678.
G. Marfia, S. Navone, L. Guarnaccia, R. Campanella, M. Mondoni, M. Locatelli, A. Barassi, L. Fontana, F. Palumbo, E. Garzia, G. Ciniglio Appiani, D. Chiumello, M. Miozzo, S. Centanni, L. Riboni, Decreased serum level of sphingosine-1-phosphate: a novel predictor of clinical severity in COVID-19, EMBO Mol Med 13(1) (2021) e13424.
H. Rosen, M.B.A. Oldstone, The riddle of the Sphinx: why sphingosine-1-phosphate may help define molecular mechanisms underlying risk stratification for serious COVID-19 infections, EMBO Mol Med 13(1) (2021) e13533.
W.J. Park, J.H. Song, G.T. Kim, T.S. Park, Ceramide and Sphingosine 1-Phosphate in Liver Diseases, Mol Cells 43(5) (2020) 419-430.
Ye Q, Zhou Y, Zhao C, et al. Salidroside inhibits CCl(4)-induced liver fibrosis in mice by reducing activation and migration of HSC induced by liver sinusoidal endothelial cell-derived exosomal sphK1 [J]. Front Pharmacol, 2021, 12: 677810
Li X, Liu R, Yang J, et al. The role of long noncoding RNA H19 in gender disparity of cholestatic liver injury in multidrug resistance 2 gene knockout mice [J]. Hepatology, 2017, 66(3): 869-884.
F. Yu, X. Feng, X. Li, Z. Liu, D. Liao, Y. Luo, M. Wei, Q. Huang, L. Zhang, J. Xia, Association of Plasma metabolic Biomarker Sphingosine-1-Phosphate With Cerebral Collateral Circulation in Acute Ischemic Stroke, Front Physiol 12 (2021) 720672.
Q. Bai, H.X. Guo, C.Y. Su, Q.F. Han, T. Wang, W. Tang, Serum Sphingosine-1-phosphate level and peritonitis in peritoneal dialysis patients, Ren Fail 42(1) (2020) 829-835.
Scherer M, Schmitz G, Liebisch G. High-throughput analysis of sphingosine 1-phosphate, sphinganine 1-phosphate, and lysophosphatidic acid in plasma samples by liquid chromatography-tandem mass spectrometry. Clin Chem. 2009 Jun; 55(6) :1218-22.
Frej C, Andersson A, Larsson B, Guo LJ, Norström E, Happonen KE, Dahlbäck B. Quantification of sphingosine 1-phosphate by validated LC-MS/MS method revealing strong correlation with apolipoprotein M in plasma but not in serum due to platelet activation during blood coagulation. Anal Bioanal Chem. 2015 Nov; 407(28): 8533-42.
Xu Y, Li H, Han Y, et al. A simple and rapid method for extraction and measurement of circulating sphingolipids using LC-MS/MS: a targeted lipidomic analysis [J]. Anal Bioanal Chem, 2022, 414(6): 2041-54.
Berdyshev E V, Gorshkova I A, Garcia J G, et al. Quantitative analysis of sphingoid base-1-phosphates as bisacetylated derivatives by liquid chromatography-tandem mass spectrometry [J]. Anal Biochem, 2005, 339(1): 129-36.
Schmidt H, Schmidt R, Geisslinger G. LC-MS/MS-analysis of sphingosine-1-phosphate and related compounds in plasma samples [J]. Prostaglandins Other Lipid Mediat, 2006, 81(3-4): 162-70.
Lan T, Bi H, Liu W, et al. Simultaneous determination of sphingosine and sphingosine 1-phosphate in biological samples by liquid chromatography-tandem mass spectrometry [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(7-8): 520-6.
X. Tang, H. Chen, G. Chen, C. Duan, Q. Fan, H. Li, Y. Wang, Z. Li, W. Shi, Y. Liu, Validated LC-MS/MS method of Sphingosine 1-phosphate quantification in human serum for evaluation of response to radiotherapy in lung cancer, Thorac Cancer 11(6) (2020) 1443-1452.
M.P. Kraemer, S. Halder, S.S. Smyth, A.J. Morris, Measurement of Lysophosphatidic Acid and Sphingosine-1-Phosphate by Liquid Chromatography-Coupled Electrospray Ionization Tandem Mass Spectrometry, Methods Mol Biol 1697 (2018) 31-42.
CLSI. Liquid chromatography-mass spectrometry methods; approved guideline, 1st ed. CLSI document C62-A. Wayne, PA:Clinical Laboratory Standards Institute; 2014
E. Moritz, D. Wegner, S. Gross, M. Bahls, M. Dorr, S.B. Felix, T. Ittermann, S. Oswald, M. Nauck, N. Friedrich, R.H. Boger, G. Daum, E. Schwedhelm, B.H. Rauch, Reference intervals for serum sphingosine-1-phosphate in the population-based Study of Health in Pomerania, Clin Chim Acta 468 (2017) 25-31.
Thuy AV, Reimann CM, Hemdan NY, Gräler MH. Sphingosine 1-phosphate in blood: function, metabolism, and fate. Cell Physiol Biochem. 2014; 34(1): 158-71.
Książek M, Chacińska M, Chabowski A, Baranowski M. Sources, metabolism, and regulation of circulating sphingosine-1-phosphate. J Lipid Res. 2015 Jul; 56(7): 1271-81.
Selim S, Sunkara M, Salous AK, Leung SW, Berdyshev EV, Bailey A, Campbell CL, Charnigo R, Morris AJ, Smyth SS. Plasma levels of sphingosine 1-phosphate are strongly correlated with haematocrit, but variably restored by red blood cell transfusions. Clin Sci (Lond). 2011 Dec;121(12): 565-72.
Nguyen TQ, Vu TM, Tukijan F, Muralidharan S, Foo JC, Li Chin JF, Hasan Z, Torta F, Nguyen LN. Erythrocytes efficiently utilize exogenous sphingosines for S1P synthesis and export via Mfsd2b. J Biol Chem. 2021 Jan-Jun;296:100201.
Brunkhorst R, Pfeilschifter W, Patyna S, Büttner S, Eckes T, Trautmann S, Thomas D, Pfeilschifter J, Koch A. Preanalytical Biases in the Measurement of Human Blood Sphingolipids. Int J Mol Sci. 2018 May 7; 19(5): 1390.
Lodder J, Denaës T, Chobert MN, Wan J, El-Benna J, Pawlotsky JM, Lotersztajn S, Teixeira-Clerc F. Macrophage autophagy protects against liver fibrosis in mice. Autophagy. 2015; 11(8): 1280-92.
Coppola N, onorato L, Panella M, de Stefano G, Mosca N, Minichini C, Messina V, Potenza N, Starace M, Alessio L, Farella N, Sagnelli E, Russo A. Correlation Between the Hepatic expression of Human MicroRNA hsa-miR-125a-5p and the Progression of Fibrosis in Patients With Overt and Occult HBV Infection. Front Immunol. 2018 Jun 13; 9: 1334.




