MALDI-TOF MS检测血清M蛋白在单克隆丙种球蛋白疾病中的临床应用

崔瑞芳,博士,副教授,硕士研究生导师。现任长治医学院医学检验系教学科研科科长。学术兼职:中国医学装备协会现场快速检测POCT装备技术分会青年委员会副主任委员;中国中西医结合学会检验医学专业委员会肿瘤分子诊断专家委员会常务委员;白求恩精神研究会检验医学分会细胞因子与疾病检测学组委员;山西省医师协会检验医师分会委员;长治医学会临床检验专业委员会秘书。获奖情况:长治市科学技术奖二等奖(第一完成人);山西省教学成果奖一等奖(第四完成人);国家实用新型专利2项。以第一作者或通讯作者发表论文10余篇,其中SCI收录2篇;参编教材3部。
【摘要】目的:探讨MALDI-TOF MS技术检测血清M蛋白在单克隆丙种球蛋白疾病中的诊断效能。方法:2020年7月至2020年12月在首都医科大学附属北京朝阳医院申请M蛋白鉴定检测的455例患者检验后剩余血清标本,采用血清蛋白电泳(SPE)、免疫固定电泳(IFE)和MALDI-TOF MS方法,分别检测血清中M蛋白成分,对不同方法学检测结果及患者临床信息进行分析。结果:455例患者样本中,MALDI-TOF MS检出单克隆丙种球蛋白疾病M蛋白阳性者278例(检出率72.0%),IFE检出244例(检出率63.2%),SPE检出175例(检出率45.3%)。MALDI-TOF MS对316例多发性骨髓瘤诊断敏感性为71.3%,高于IFE的63.3%和SPE的45.4%,p<0.001,差异具有统计学意义。结论:MALDI-TOF MS技术对血清M蛋白的检测效能优于IFE和SPE等现有M蛋白检测常规实验室方法,有望在单克隆丙种球蛋白疾病诊断、治疗监测和预后评估中发挥重要作用。
单克隆免疫球蛋白(M蛋白)是单克隆丙种球蛋白疾病尤其是多发性骨髓瘤(Multiple myeloma,MM)的血清学特异生物标志物,表现为完整性的单克隆免疫球蛋白(IgG、IgA、IgM、IgD、IgE)或游离的单克隆κ或λ轻链的过度增生[1]。MM是单克隆丙种球蛋白疾病中最常见的类型。一般来说,骨髓瘤的进展经历3个阶段,分别为意义未名的单克隆丙种球蛋白血症(monoclonal gammopathy of undetermined significance,MGUS)、冒烟型骨髓瘤(smoldering multiple myeloma,sMM)和活动性多发性骨髓瘤(active multiplemyeloma,MM)[2]。MM目前仍无法治愈,早期鉴定其主要生物学指标并及时进行有效干预,是准确诊断、疗效评估及延长生存期的重要手段[3]。血清蛋白电泳和免疫固定电泳虽然分析灵敏度和分辨率有限,但仍然是检测M蛋白的常规方法。随着越来越多的新药研发和临床应用,经过规范治疗能够达到完全缓解的患者比例越来越高,但检测M蛋白的常规实验室方法往往给到的是阴性结果,但这类人群大多最终会出现复发,因此,更加灵敏、准确的实验室检测方法就显得尤为重要和必要。
近年来,基于质谱技术检测血清M蛋白的方法不断研究、开发,也越来越受到人们的关注和重视。质谱技术基于质荷比的差异鉴定M蛋白比传统的电泳方法具有更高的灵敏度和特异性。本研究基于前期成功建立的MALDI-TOF MS检测血清M蛋白的方法[4],对该法检测M蛋白应用于临床样本,并基于临床诊断进行诊断效能评价。
对象与方法
一、对象
收集2020年7月至2020年12月在首都医科大学附属北京朝阳医院申请M蛋白鉴定检测的455例患者检验后剩余血清标本。本研究已通过首都医科大学附属北京朝阳医院伦理委员会审查,研究过程严格按照我国相关伦理规范执行。
二、方法
1. 实验室检测:血清蛋白电泳和免疫固定电泳使用Sebia HYDRASYS全自动电泳仪(法国,Sebia公司)测定,质谱方法测定M蛋白采用Quan TOF宽谱定量飞行时间质谱仪(中国,融智生物)。
2. 数据分析:统计分析使用SPSS25.0软件完成。患者的人口学和实验室数据采用描述性统计分析,连续性变量采用中位数(四分位数)描述,不同组间均值比较采用多样本秩和检验,不同组间诊断敏感度比较采用Fisher精确检验和组间两两比较。
结 果
研究队列的临床信息见表1。将研究队列分为5组,分别为多发性骨髓瘤组(MM)、系统性或局限性AL或AH型淀粉样变性组(AL/AH)、单克隆免疫球蛋白病(MGUS)、其他对照疾病(Other)和其他浆细胞性疾病(Other PCD)。335例MM样本中有6%是初诊患者,9例AL/AH中有33%是初诊人群,18例MGUS均为初诊,其他对照疾病(包括肾病、风湿免疫性疾病和肺炎等)有88%为初诊,非MM的PCD的初诊比例为21%。5组间ALB和PLT的水平差异有显著性。MM组与其他疾病组ALB、Hb、PLT、Cr和Ca2+水平差异均有显著性。

据临床诊断,比较了455例研究人群分别采用MALDI、IFE和SPE对M蛋白检测的诊断灵敏度。335例MM患者中,MALDI对MM患者的诊断灵敏度为71.3%,优于IFE的63.3%和SPE的45.4%,三种方法间对MM的诊断灵敏度具有显著性差异,p<0.001;MALDI与IFE进行诊断灵敏度比较,p=0.026<0.05,两者间差异具有显著性;MALDI与SPE进行诊断灵敏度比较,p<0.001,两者间差异具有显著性;IFE与SPE进行诊断灵敏度比较,p<0.001,两者间差异具有显著性。各组三种方法间的诊断灵敏度及差异见表2。

MALDI对MGUS的诊断灵敏度为94.4%,优于IFE的88.9%和SPE的66.7%。其他疾病组中,MALDI的诊断灵敏度与IFE和SPE相同,均为100%。对于经过治疗的316例MM患者,MALDI检出M蛋白的诊断灵敏度为69.6%,高于IFE的61.4%和SPE的43.4%,三种方法间对MM的诊断敏感性具有显著性差异,p<0.001。
MALDI-TOF MS在386例单克隆丙种球蛋白疾病中检出M蛋白278例,检出率72.0%;IFE对M蛋白检出244例,检出率63.2%;SPE对M蛋白检出175例,检出率45.3%,三组间检出率差异有显著性。
将5组人群逐一进行3种方法的检测灵敏度比较。在MM组、AL/AH淀粉样变性组、MGUS组和其他疾病组中,均可看到常规IFE和SPE方法检测到M蛋白的样本,MALDI-TOF MS也可以检测出,其对单克隆丙种球蛋白疾病的诊断灵敏度也都高于IFE和SPE。

注:(没有标识的方格代表1个患者)。A. 未经治疗的MM初诊患者 B. 经过治疗的MM患者 C. AL/AH淀粉样变性患者 D. MGUS患者 E. 其他疾病患者(包括前述的其他疾病对照和其他PCD患者)
图1. MALDI、IFE和SPE检测性能地形图
Kumar[5]的研究表明,被免疫富集的样品经MALDI-TOF-MS检测,发现了天然形式的糖基化单克隆κFLC,经过PNGase F处理后显示分子量降低,向非糖基化形式转移,经过PNGase F处理后,单克隆κ轻链解析为23,441 Da的单个峰,进一步通过高分辨率LC-MS/MS进行的轻链糖基化分析,发现至少有四个峰代表单克隆κ轻链的不同糖型(图2)。PNGase F前后峰的分子量差异与不同聚糖的分子量相匹配。
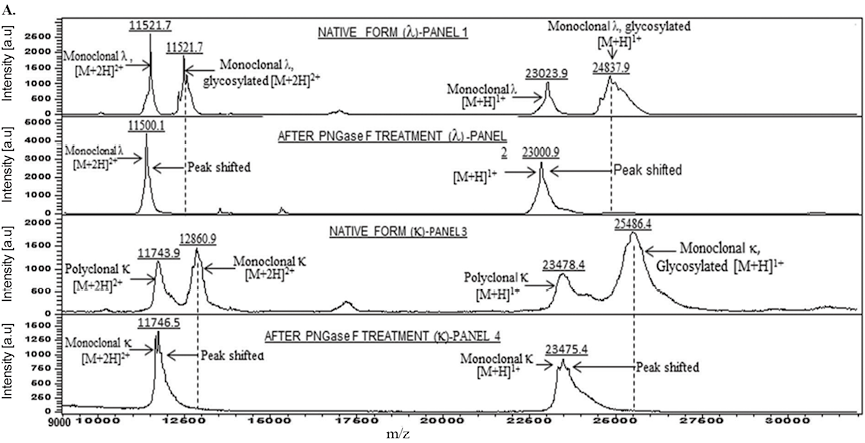
图2. Kumar S等研究轻链型M蛋白糖基化谱图
对1例IFE和SPE检测均为阴性的经过治疗的MM样本经MALDI-TOF MS检测为M蛋白阳性,观察本例样本的质谱图发现,除了在M+[H]2+为23382处出现κ轻链外,在大于该分子量的M+[H]2+为25734附近也出现尖峰,推测可能为轻链的糖基化修饰。

图3. 特殊谱图,M蛋白的糖基化修饰
讨 论
单克隆丙种球蛋白病包括了一系列复杂的疾病,这些疾病共同的特征就是浆细胞的克隆增殖,通常可在血清或尿液中检测到M蛋白(完整的单克隆免疫球蛋白分子和/或单克隆游离轻链)。这类疾病涵盖从MGUS到MM,前者是一种癌前状态,后者是一种广泛的骨髓和全身器官受累的恶性肿瘤。事实上,所有的MM病例都是从含有M蛋白的MGUS开始的,这种蛋白可能早在诊断MM之前10年就存在于血清中[6]。M蛋白的测定对疾病的诊断、风险分层和监测治疗反应至关重要[7]。MM预后和随访的关键依赖于可重复的、准确的M蛋白测量。几十年来,这些测量已被用作肿瘤负荷的标记物[8-10]。早期鉴定M蛋白,进行及时有效干预,以追踪疾病进程和治疗反应,是降低MM发病率和死亡率的重要手段。
血清IFE和SPE检测已纳入IMWG关于多发性骨髓瘤的诊断标准,并且它们也是临床最常用的M蛋白筛查技术,对单克隆丙种球蛋白疾病的诊断具有重要价值[11]。本研究使用经过IFE和SPE筛查的队列样本进行前期所建MALDI-TOF MS方法检测M蛋白,在临床诊断明确的基础上进行该方法的临床效能评价,结果显示,MALDI-TOF MS方法在低浓度M蛋白检测、亚型鉴别、轻链糖基化修饰等方面比传统电泳方法具有潜在优势和临床应用价值。从5组人群的3种检测方法结果看,MALDI-TOF MS检出M蛋白的能力高于传统的IFE和SPE方法,这种结果在对诊断明确的经治疗的MM患者人群分析时也得到印证。经治疗达到完全缓解的MM患者,因检测M蛋白阴性通常会转为维持治疗,但现有方法检测敏感性的局限可能会产生假阴性结果,从而可能对疾病治疗和预后发展产生不利影响,在我们采用MALDI-TOF MS检测时,检出了多例IFE和SPE均为阴性的样本,后续在对病例的随访中也看到了疾病复发,质谱方法。
人们也越来越认识到蛋白质修饰在异常生物学和疾病过程中所起的作用。能够检测和量化这些细微修饰(蛋白质形态)的分析方法可能在未来对敏感和特异性诊断的发展越来越重要。我们在研究中发现的1例可疑糖基化修饰的样本,其κ轻链的[M+H]+为25734,与Kumar[5]等学者的研究结果相似,他们发现的对应的经糖基化修饰的κ轻链的[M+H]+为25486。而M蛋白糖基化与多发性骨髓瘤(MM)预后不良相关,基于质谱技术检测M蛋白对预测、评估MM预后具有潜在临床应用前景。
对于初诊的单克隆丙种球蛋白疾病在诊断明确的前提下,MALDI因灵敏度高、操作简单、检测快速、成本效益优良等优点可作为单克隆丙种球蛋白疾病筛查的有效方法,对于轻链型MM及血清M蛋白含量较低的MM患者,相较SPE和IFE的方法局限性,具有独特的优势。MALDI-TOF质谱具有分析完整蛋白的优势,仅此一点,预计MALDI-TOF质谱将越来越多地用于临床分子标志物研究和测试。
总之,MALDI-TOF质谱是灵敏、高通量、低成本的理想分析平台,有望在浆细胞性疾病的筛查、诊断、监测和评估治疗反应中发挥重要作用。
参考文献
Kumar SK, Rajkumar V, Kyle RA, et al. Multiple myeloma. Nat Rev Dis Primers 2017; 3:17046.
Rajkumar SV. Multiple myeloma: 2016 update on diagnosis, risk-stratification, and management, Am. J. Hematol. 2016; 91 (7): 719-734.
Landgren O, Morgan GJ. Biologic frontiers in multiple myeloma: from biomarker identification to clinical practice. Clin Cancer Res. 2014; 20(4): 804-813.
崔瑞芳, 张顺利, 孙德慧, 王默, 翟玉华, 岳育红, 周晓光, 王清涛, 张瑞. 基于MALDI-TOF MS技术无需抗体富集直接检测血清M蛋白方法的建立.中华检验医学杂志, 2022, 45(10): 101-106.
Kumar S, Murray D, Dasari S, et al. Assay to rapidly screen for immunoglobulin light chain glycosylation: a potential path to earlier AL diagnosis for a subset of patients. Leukemia. 2019 Jan; 33(1): 254-257.
Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma:a prospective study. Blood. 2009; 113: 5412-7.
Katzmann JK. Screening for monoclonal gammopathies: time to change. Clin Biochem Rev, 2009; 30:105-11.
Guideline. CADTH Rapid Response Reports. Canadian Agency for Drugs and Technologies in Health 2015.
Murray DL, Ryu Euijung R, Snyder MR, et al. Quantitation of serum monoclonal proteins: relationship between agarose gel electrophoresis and immunonephelometry. Clin Chem. 2009; 55: 1523-9.
Smith A, Wisloff F, Samson D. Guidelines on the diagnosis and management of multiple myeloma. Brit J Haematol. 2006; 132: 410-51.
Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov; 15(12): e538-48.




