质谱法检测尿液游离甲氧基肾上腺素类物质的定性诊断价值

赵蓓蓓,广州医科大学金域检验学院临床基因组教研室副主任,广州金域医学检验集团质谱技术主任,临床蛋白组学联合创新实验室执行主任、广州金域临床质谱检测中心主任、广州金域淀粉样变性研究中心主任。广东省五一劳动奖章获得者,广东省科技进步奖一等奖获得者,广州市开发区创新创业骨干人才和紧缺人才。中国营养学会公共营养分会委员,中国医疗器械行业协会临床质谱创新发展分会委员,广东省精准医学应用学会委员。研究方向:临床色谱质谱技术发展与应用研究,临床质谱实验室管理。学术成就:全国首本临床色谱质谱高等学校教材《临床色谱质谱检验技术》副主编,拥有发明专利30余项,以第一作者或通讯作者发表SCI和中文核心学术论文20余篇,参与指南共识8项。
【摘要】目的 探讨高效液相色谱串联质谱法(LC-MS/MS)检测尿液游离甲氧基肾上腺素类物质(包括甲氧基肾上腺素MN、甲氧基去甲肾上腺素NMN,3-甲氧基酪胺3-MT,统称MNs),对嗜铬细胞瘤和副神经节瘤(PPGLs)的定性诊断价值。方法 收集113名广州金域医学检验中心表观健康志愿者24h尿液作为对照组(CH),采用LC-MS/MS检测患者24h尿液中游离的MNs,建立24h尿游离MNs(简称f-UMNs)参考范围。回顾性分析广州金域医学检验中心2018年2月至2020年5月同时进行血浆游离MNs(简称f-PMNs)和f-UMNs检测的2016例高血压人群结果,其中106例f-PMNs结果中至少有一项超过相应参考范围上限的4倍,作为血结果阳性组(PH);1776例f-PMNs三项结果均在参考范围内,作为血结果阴性组(NH);134例f-PMNs结果高于参考范围上限的1~4倍,作为血结果灰区组(GH);比较各组对应f-UMNs水平,并依据建立的f-UMNs参考范围,对f-UMNs与f-PMNs结果定性诊断一致性进行分析,探讨f-UMNs的定性诊断价值。结果 (1)24h尿游离MN、NMN和3-MT的参考范围分别为47.3~261.9nmol/24h、52.7~202.2nmol/24h和100.7~438.4 nmol/24h。(2)PH组中尿游离MN,NMN和3-MT的水平,高于CH组5.3倍、32.6倍和1.8倍,高于NH组6.8倍、29.3倍和1.7倍,高于GH组5.2倍、11.8倍和1.5倍。(3)对2016例高血压人群f-UMNs与f-PMNs检测结果回顾分析认为,若基于参考范围上限的4倍作为定性诊断切值,f-UMNs与f-PMNs结果阳性符合率为95.3%,阴性符合率为86.4%。Kappa一致性分析,f-UMNs与f-PMNs结果具有中度一致性。结论 在国内首次建立了基于LC-MS/MS检测f-UMNs的参考范围,并报道了血尿同检的游离MNs结果真实情况,2016例结果回顾性分析,认为f-UMNs与f-PMNs结果的阳性与阴性吻合率达95.3%和86.4%,对PPGLs定性诊断价值等同,血和尿MNs联合检测,可提升PPGLs筛查敏感性,降低假阴性。
【关键词】嗜铬细胞瘤和副神经节瘤;尿液游离甲氧基肾上腺素类物质;高效液相色谱串联质谱法;参考范围;定性诊断
嗜铬细胞瘤和副神经节瘤(pheochromocytomas and paragangliomas,PPGLs)是一种神经内分泌肿瘤,分别起源于肾上腺髓质或肾上腺外交感神经链。由于肿瘤阵发性或持续性分泌大量儿茶酚胺(包括肾上腺素、去甲肾上腺素和多巴胺),如果不及时治疗会引发严重的心、脑、肾等靶器官的损害,部分可伴有致死性心血管并发症,高血压急症,甚至导致多系统衰竭而危及生命,因此,PPGLs的早期诊断很重要[1]。PPGLs临床表现多变,虽典型的表现为三联征头痛、心悸、多汗,但研究认为高达20%的患者血压正常,10%~15%的患者几乎没有任何临床症状。因此,早期临床诊断极具挑战[1],许多病人在死后尸检时才能得到确诊。同时,对于患者若术前未准确排除PPGLs,未做好术前准备,患者在手术中将面临极大的血压波动而危及生命,因此对于肾上腺占位的患者,术前排除PPGLs意义重大。
无论是早期诊断还是术前排除PPGLs,均需要敏感性和特异性较高的检测指标。2014版《嗜铬细胞瘤和副神经节瘤诊断治疗的专家共识》[2]建议,PPGLs首选的生化检测指标为血浆游离或24h尿液分馏甲氧基肾上腺素类物质,包括甲氧基肾上腺素(metanephrine,MN)和甲氧基去甲肾上腺素(normetanephrine,NMN)。但对于头颈部副神经节瘤患者,增加3-甲氧基酪胺(3-methoxytyramine,3-MT)的检测可提高筛查敏感性[3],同时3-MT被认为对嗜铬细胞瘤的转移识别,具有重要意义[4],因此,MN、NMN和3-MT(统称为甲氧基肾上腺素类物质,metanephrines,MNs)被认为是PPGLs定性诊断的最佳生化标志物[1-8]。
相比于尿液,血浆游离MNs(plasma free metanephrines,f-PMNs)虽具有更好的诊断性能[9];但因样本采集易受患者体位、血浆分离温度和分离时长等条件的影响[8],若不能很好地控制采样条件,f-PMNs相比尿液MNs并没有诊断优势[7, 10]。与尿液分馏MNs相比,24h尿游离MNs(24h urine free metanephrines,f-UMNs)由于不需要添加防腐剂,采样要求简单,受影响因素更少[11],在临床实践可提供更优的诊断性能[9, 12]。但目前国内对尿游离MNs的研究较少,尤其是针对目前儿茶酚胺及其代谢物主流的检测方法[8],液相色谱串联质谱法(LC-MS/MS)的检测方法,未见MNs三项的参考范围建立,也缺少尿游离MNs定性诊断价值的研究。
基于此,本研究基于建立的LC-MS/MS检测f-UMNs方法,以表观健康人群数据进行参考范围建立,并通过对大规模f-PMNs和f-UMNs数据进行回顾分析,探讨f-UMNs定性诊断性能,为临床实际应用提供参考依据。
对象与方法
一、研究对象
本研究纳入广州金域医学检验中心表观健康志愿者(CH)113名,纳入标准:血压无异常(<130/80mmHg、1mmHg=0.133kPa),未服用降压药物或经过激素治疗;无吸烟嗜酒;非妊娠、哺乳期妇女;既往无高血压病史。所有志愿者禁食香蕉、咖啡等影响MNs结果的实物72h,留取24小时尿液,测定f-UMNs以及尿肌酐。排除标准:24h尿量不足的患者(尿量小于500ml,24h尿肌酐<7mmol/天)。
回顾性分析2018年02月12日至2020年05月24日,于广州金域医学检验中心同时进行血浆和尿游离MNs(MN、NMN、3-MT)检测的2016例高血压患者结果数据。根据文献研究,以MN 0.5nmol/L、NMN 0.9nmol/L和3-MT 0.18nmol/L作为血浆游离MNs的参考范围上限[13-15]。另有研究认为,以f-PMNs或f-UMNs参考范围上限4倍作为定性诊断切值,可提高诊断敏感度[1, 13]。因此,本研究以f-PMNs检测结果为依据,对2016例结果进行分组分析。将f-PMNs结果低于参考范围上限的纳入阴性组(NH),三项指标任意一项结果高于参考范围上限1-4倍则纳入灰区组(GH),三项指标任意一项结果高于参考范围上限4倍则纳入阳性组(PH)。
本研究符合伦理要求,已获得广州金域医学检验中心伦理委员会批准。
二、方法
1. 样本采集:志愿者准备:采样前72h禁食含有咖啡因的食物(苏打、巧克力、咖啡)、烟草(吸烟或雪茄)、茶或含酒精的饮料,戒色素饮食。
24小时尿液样本采集:当日早晨8点排空小便,弃去当日晨尿,至次日早晨8点的全部尿液收集至洁净储存容器中,记录24小时总尿量(收集过程中不添加任何防腐剂,尿液储存容器需在冷藏(2~8℃)避光的条件下放置),将尿液混合均匀并留取5~10mL冷藏保存。
血浆样本采集:患者空腹、卧位休息30min后抽血,取血前30min应于静脉内留置注射针头,以减少抽血时疼痛刺激所致生理性升高。使用EDTA抗凝管,静脉采血2~4mL后充分混匀,混匀后立即在4℃条件下离心分离血浆或者放置在冰浴中,并在2h内于4℃条件下离心分离血浆,离心后血浆样本冷藏保存。
所有采集后的样本,在7天内冷藏运输至广州金域医学检验中心进行检测,所有样本在到达后72h内完成检测,检测批次的室内质控在控,则检测数据可用于本研究。
2. 试剂与仪器:MN和3-MT标准品购自加拿大北约克Toronto Research Chemicals公司,NMN标准品购自美国Sigma公司,MN内标(d3-MN)购自美国Medical Isotopes公司,NMN和3-MT内标(d3-NMN和d4-3-MT)购自加拿大魁北克C/D/N Isotopes公司,标准品及内标储备液用0.4%甲酸水配制。质谱仪为美国Waters公司Xevo TQ-S液相色谱串联质谱(LC-MS/MS),尿肌酐测定仪器为罗氏Cobas C311。
3. 统计分析:数据采用MedCalc 15.2.2进行统计学分析,计量资料用平均值±标准误差(x±s)表示,非正态分布数据采取非参数检验以中位数(M)[四分位数(P25~P75)]表示,多组比较采用Kruskal-Wallis检验,两组间比较采用非参数Mann Whitney检验。双侧95%参考区间的建立采用非参数百分位数法。结果一致性评价采用Kappa检验。以P<0.05为差异有统计学意义。
结 果
1. 临床资料:本研究最终入选符合标准的表观健康志愿者(CH)结果113例,年龄(29.8±10.9)岁,其中男61例,女52例。2016例同时检测血浆和尿液MNs的结果,NH组共1776例,年龄(48.9±15.5)岁,其中男850例,女926例;GH组共134例,年龄(48.0±18.4),其中男72例,女62例;PH组共106例,年龄(47.6±16.4)岁,其中男63例,女43例。详细信息见表1。
2. f-UMNs参考范围的建立:根据113例CH组f-UMNs数据,采用非参数统计方法建立双侧95%参考区间(见表2),男女性别组间的MN水平差异有统计学意义(P<0.05),NMN和3-MT水平差异无统计学意义(P>0.05)。
3. f-UMNs水平组间分布:对CH、NH、GH、PH组的f-UMNs结果进行比较分析,四组间的差异均有统计学意义(P<0.05),见表1。在两两比较Post-hoc analysis分析,PH组f-UMNs的水平显著高于CH组、NH组和GH组,且差异均有统计学意义。GH组NMN、3-MT的水平高于CH组、NH组,且差异均有统计学意义;这与NH组相比,GH组MN的水平更高,且差异有统计学意义;与CH组相比,GH组MN水平差异无统计学意义。NH组NMN的水平高于CH组,且差异具有统计学意义;NH组MN的水平低于CH组,且差异有统计学意义;与CH组相比,NH组3-MT水平差异无统计学意义。根据中位值计算,PH组MN、NMN和3-MT的水平分别高于CH组5.3倍、32.6倍、1.8倍,高于NH组6.8倍、29.3倍、1.7倍,高于GH组5.2、11.8、1.5倍。各组f-UMNs的水平分布图如图1。
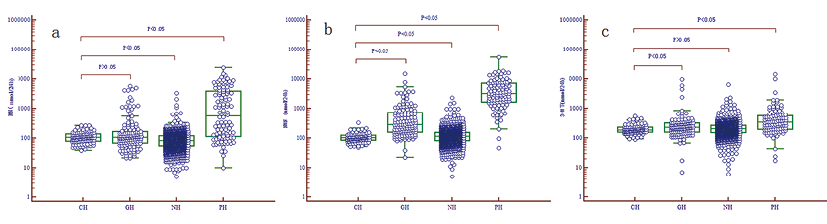
注:a、b、c分别表示不同组MN、NMN、3-MT的水平分布
图1. 不同组尿游离MNs的水平分布
4. 尿游离MNs与血浆游离MNs定性诊断一致性:以本研究建立的f-UMNs参考范围(表2)为基础,对NH、GH、PH组的f-UMNs结果进行分析,计算f-UMNs与f-PMNs定性诊断一致性(表3)。f-UMNs结果阳性共153例,灰区为278例,阴性为1585例;f-PMNs结果PH组共106例;GH组共134例,其中38例f-UMNs结果高于参考范围上限4倍;NH组共1776例,其中14例f-UMNs结果高于参考范围上限4倍,227例f-UMNs结果灰区。f-UMNs与f-PMNs结果一致的共1684例,阳性符合率为95.3%,阴性符合率为86.4%,灰区符合率为35.8%。f-UMNs与f-PMNs结果进行Kappa一致性分析,检验Kappa值为0.440,表明f-UMNs与f-PMNs结果具有中度一致性。
讨 论
血浆和尿游离MNs作为PPGLs定性诊断的首选生化检验,国外已有较多有关LC-MS/MS的参考范围和临床诊断切值的研究,表明f-PMNs和f-UMNs都有较高的敏感性和特异性[7, 12, 16],但是有关f-UMNs与f-PMNs诊断性能一致性的研究较少见;在我国尚缺少基于表观健康人群的f-UMNs参考范围的报道,基于临床应用中f-UMNs的临床诊断价值研究未见报道。
本研究基于表观健康(CH)人群建立了LC-MS/MS方法的尿游离MN、NMN和3MT的参考范围,其中MN、NMN参考范围上限分别为261.9nmol/24h、202.2nmol/24h,与国外报道在原发性高血压和血压正常志愿者中建立的参考范围基本一致[17],且在CH组和NH组间有统计学差异,这与文献报道不同。但本研究3-MT参考范围上限为438.4nmol/24h,高于文献报道的320nmol/24h,并且在EH和NH组间无统计学差异,可能与多巴胺及3MT易于受到药物和生理状态的影响有关[8, 11, 18]。
通过对2016例临床随机送检f-PMNs和f-UMNs的高血压人群结果进行回顾性分析,比较了f-UMNs与f-PMNs定性诊断的一致性。基于f-PMNs结果高于参考范围上限4倍作为定性诊断切值分析,106例f-PMNs结果阳性中,f-UMNs仅有2例为阴性,假阴性率为1.9%;f-PMNs结果阴性而f-UMNs为阳性占比0.7%,灰区占比11.3%。由于f-UMNs与f-PMNs结果仅具有中度一致性,血尿阴性吻合率86.4%,阳性吻合率95.3%;2016例中有14例f-UMNs高于参考范围4倍以上,但f-PMNs结果在参考范围内,与文献报道的f-PMNs具有更高的敏感性和特异性不一致,可能与血MNs的分析前采样要求较高,部分采样未能真正满足规范要求有关。也表明若考虑到较高质量的采样要求,f-UMNs作为筛查PPGLs的方法敏感性可能高于f-PMNs。考虑到PPGLs的病人需要特殊的术前准备,MNs检测的假阴性是需要尽量避免的,因此对于PPGLs的定性诊断,血尿不可相互替代,联合检测将利于降低假阴性率。
本研究存在不足之处:研究重点关注f-UMNs与f-PMNs作为一线筛查方法对PPGLs的敏感性,通过一致性分析表明f-UMNs的定性诊断价值。入组的2016例回顾性分析人群缺乏明确诊断信息,以f-PMNs的结果为“金标准”进行结果筛选分组。考虑到血MNs结果的准确性与样本采集质量有关,本研究无法对采样质量一一核实,存在一定不足。同时通过比较纳入研究的PH组与CH组、NH组的f-UMNs水平差异,结果表明PH组人群中尿MN高出5.3~6.8倍,NMN高出29.3~32.6倍,远超基于明确临床诊断的研究中报道[9, 17]的PPGLs与非PPGLs人群中差异水平(MN水平差异2.7~4倍以上,NMN水平差异10倍以上),也反映了本研究以血浆游离MNs高于参考范围上限4倍,对PPGLs进行定性诊断的特异性较高。但瑕不掩瑜,不影响本研究结论对LC-MS/MS检测f-UMNs定性诊断价值的贡献。
综上,本研究在国内首次建立了基于LC-MS/MS检测f-UMNs的参考范围,并报道了血尿同检的MNs结果真实情况,2016例结果回顾性分析,肯定了f-UMNs的定性诊断敏感性和特异性不低于f-PMNs,且一定程度上敏感性高于后者。血和尿MNs联合检测,有助于提升PPGLs筛查敏感性,降低假阴性。建议采用本研究建立的f-UMNs参考范围进行定性诊断,以高于参考范围上限4倍为特异性诊断切点值,高度提示PPGLs。
参考文献
Dobri GA, Bravo E, Hamrahian AH. Pheochromocytoma: pitfalls in the biochemical evaluation[J]. Expert Rev Endocrinol metab, 2014, 9(2): 123-135. DOI: 10.1586/17446651.2014.887985.
中华医学会内分泌学分会肾上腺学组. 嗜铬细胞瘤和副神经节瘤诊断治疗的专家共识[J]. 中华内分泌代谢杂志, 2016, 32(3): 181-187. DOI: 10.3760/cma.j.issn.1000-6699.2016.03.002.
Rao D, Peitzsch M, Prejbisz A, et al. Plasma methoxytyramine: clinical utility with metanephrines for diagnosis of pheochromocytoma and paraganglioma[J]. Eur J Endocrinol, 2017, 177(2):103-113. DOI: 10.1530/EJE-17-0077.
Eisenhofer G, Lenders JW, Siegert G, et al. Plasma methoxytyramine: a novel biomarker of metastatic pheochromocytoma and paraganglioma in relation to established risk factors of tumour size, location and SDHB mutation status[J]. Eur J Cancer, 2012, 48(11): 1739-1749. DOI: 10.1016/j.ejca.2011.07.016.
Eisenhofer G, Keiser H, Friberg P, et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors[J]. J Clin Endocrinol metab,1998, 83(6): 2175-2185. DOI: 10.1210/jcem.83.6.4870.
[Gupta P, Khurana ML, Khadgawat R, et al. Plasma free metanephrine, normetanephrine, and 3-methoxytyramine for the diagnosis of pheochromocytoma/paraganglioma[J]. Indian J Endocrinol metab, 2015, 19(5): 633-638. DOI: 10.4103/2230-8210.163183.
Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline[J]. J Clin Endocrinol metab, 2014, 99(6): 1915-1942. DOI: 10.1210/jc.2014-1498.
刘庆香, 周伟燕, 张传宝. 儿茶酚胺及其代谢物的检测现状及标准化期望[J]. 中华检验医学杂志, 2020, 43(3): 322-327. DOI: 10.3760/cma.j.issn.1009-9158.2020.03.024.
Eisenhofer G, Prejbisz A, Peitzsch M, et al. Biochemical Diagnosis of Chromaffin Cell Tumors in Patients at High and Low Risk of Disease: Plasma Versus Urinary Free or Deconjugated O-Methylated Catecholamine metabolites[J]. Clin Chem, 2018, 64(11): 1646-1656. DOI: 10.1373/clinchem.2018.291369.
Därr R, Kuhn M, Bode C, et al. Accuracy of recommended sampling and assay methods for the determination of plasma-free and urinary fractionated metanephrines in the diagnosis of pheochromocytoma and paraganglioma: a systematic review[J]. Endocrine, 2017, 56(3): 495-503. DOI: 10.1007/s12020-017-1300-y.
de Jong WH, Eisenhofer G, Post WJ, et al. Dietary influences on plasma and urinary metanephrines: implications for diagnosis of catecholamine-producing tumors[J]. J Clin Endocrinol metab, 2009, 94(8): 2841-2849. DOI: 10.1210/jc.2009-0303.
王恺隽, 高小晶, 张伟, 等. 尿液游离型及分馏儿茶酚胺代谢产物对嗜铬细胞瘤的诊断价值评估[J]. 中华检验医学杂志, 2020, 43(3): 255-260. DOI: 10.3760/cma.j.issn.1009-9158.2020.03.012.
Van Berkel A, Lenders JW, Timmers HJ. Diagnosis of endocrine disease: Biochemical diagnosis of phaeochromocytoma and paraganglioma[J]. Eur J Endocrinol, 2014, 170(3): R109-119. DOI: 10.1530/EJE-13-0882.
Peaston RT, Graham KS, Chambers E, et al. Performance of plasma free metanephrines measured by liquid chromatography-tandem mass spectrometry in the diagnosis of pheochromocytoma[J]. Clin Chim Acta, 2010, 411(7-8): 546-552. DOI: 10.1016/j.cca.2010.01.012.
Woo HI, Yang JS, Oh HJ, et al. A simple and rapid analytical method based on solid-phase extraction and liquid chromatography-tandem mass spectrometry for the simultaneous determination of free catecholamines and metanephrines in urine and its application to routine clinical analysis[J]. Clin Biochem, 2016, 49(7-8):573-9. DOI: 10.1016/j.clinbiochem.2016.01.010.
Eisenhofer G, Peitzsch M, Kaden D, et al. Reference intervals for LC-MS/MS measurements of plasma free, urinary free and urinary acid-hydrolyzed deconjugated normetanephrine, metanephrine and methoxytyramine[J]. Clin Chim Acta, 2019, 490: 46-54. DOI: 10.1016/j.cca.2018.12.019.
Peitzsch M, Pelzel D, Glöckner S, et al. Simultaneous liquid chromatography tandem mass spectrometric determination of urinary free metanephrines and catecholamines, with comparisons of free and deconjugated metabolites[J]. Clin Chim Acta, 2013, 418: 50-58. DOI: 10.1016/j.cca.2012.12.031.
Eisenhofer G, Brown S, Peitzsch M, et al. Levodopa therapy in Parkinson's disease: influence on liquid chromatographic tandem mass spectrometric-based measurements of plasma and urinary normetanephrine, metanephrine and methoxytyramine[J]. Ann Clin Biochem, 2014, 51(Pt 1):38-46. DOI: 10.1177/0004563213487894.




