应重视肿瘤标志物临床检测中的影响因素

齐军,主任医师、教授、硕士研究生导师。中国医学科学院肿瘤医院深圳医院检验科主任、输血科主任,北京协和医学院临床检验诊断学系副主任。专业研究方向:临床检验诊断,重点是肿瘤实验诊断及实验室检测项目临床应用研究。学术兼职:中华医学会检验医学分会第九届委员;白求恩精神研究会检验医学分会第一届、第二届理事会副会长;中国老年医学学会检验医学分会常委;中国研究型医院学会血栓与止血专业委员会常委;中国医学装备协会临床检验医学专业委员会常委等。在国内外核心期刊上发表论文近90余篇。参编及主编书籍10余部。

张晓煜,主管技师,从事检验科临床微生物分子检验工作10年,主要负责临床微生物分子检验、教学及细菌和真菌耐药监测工作等。擅长临床微生物分子检验技术及感染性疾病的实验室诊断。研究方向:肿瘤与病原微生物感染的关系、细菌耐药机制研究。主持和参与科研项目多项,以第一作者主持院内课题一项。以第一作者发表SCI论文一篇,在核心期刊上撰写和参与论文发表10余篇。2020年获得“深圳市抗击新冠肺炎疫情先进个人”。现兼任深圳市分析测试协会委员,深圳市医院协会检验医学分会委员。
众所周知,由于人口老龄化加剧以及癌症主要危险因素的流行和分布变化,全球癌症的发病率和死亡率正在迅速增加。根据世界卫生组织(WHO)的评估,癌症已成为绝大多数国家/地区70岁之前的前两位死因[1]。在肿瘤病因不明确的情况下,将肿瘤预防的重心放在二级预防,即早期发现、早期诊断和早期治疗(简称"三早" )是目前国际上认可的防控癌症的重要策略,尤其是那些筛查证据充分,可以通过筛查降低人群死亡率的某些重要癌种[2]。虽然目前有很多的诊断方法,但往往就诊时患者大多已经处于晚期或转移状态,不利于后期的治疗和预后。因此,科学合理的肿瘤标志物联合检测对各系统肿瘤的早期诊断和治疗具有重要意义。本文旨在探讨肿瘤标志物水平变化与非肿瘤疾病的相关性,以便给予临床合理解释。
一、中国癌症流行病学调查
中国国家癌症中心(National Cancer Center,NCC)在今年发布了最新一期的全国癌症统计数据。结果显示,中国当前的主要恶性肿瘤包括肺癌、结直肠癌、胃癌、肝癌、女性乳腺癌等,前5位恶性肿瘤发病约占全部新发病例的57.27%。肺癌、肝癌、胃癌、结直肠癌、食管癌是主要的肿瘤死因,约占全部肿瘤死亡病例的69.25%[3]。近年来,我国癌症负担不断加大,中国癌症发病率、死亡率居全球第一,全球每新增100个癌症患者中,中国人就占了21个[4],每一年我国花费在恶性肿瘤疾病上的费用超过2200亿人民币[5],如何控制癌症在国内快速蔓延,已经成为医学专家和药物专家亟需解决的首要工作之一。肿瘤标志物(Tumor Marker,TM)在对于患者肿瘤的早期诊断、预后判断和疗效监测等方面起着至关重要的作用,TM联合相对应的影像学检查,具有明显的成本效果[6],有效提高医院的服务质量和效率。如何帮助临床医生做出与肿瘤患者相关的诊疗决策是我们检验科工作的重点。
二、肿瘤标志物检测的临床意义
早在1978年TM就已获得明确定义,即存在于肿瘤细胞内或细胞膜表面,或由肿瘤细胞表达分泌进入血液、其他体液及组织中,或由机体对肿瘤发生免疫反应而产生并进入体液或组织中的物质。当TM达到一定水平时,即代表肿瘤的存在并可反映出一定的生物特征。TM种类多样,包括酶类、激素类、未知功能的抗原类、癌蛋白类等,且不同种类的TM具有不同的功能[7-10]。血液TM的检测作为一种非侵入性检查方法,具有简便、快捷、痛苦小、易复查等特点,易被患者接受。鉴于TM的敏感性和特异性问题,临床医生会针对某一肿瘤选择多个TM进行常规实验室检测,以便提高检测的准确性[11-13]。检测TM可以了解人体代谢指标是否正常,对于高危人群的肿瘤疾病风险判断有一定帮助。在一项研究显示,在以症状和(或)TM升高首诊的患者中结直肠肿瘤约占1/3,临床工作中应密切关注患者临床症状及异常TM的升高[14],肿瘤标志物检测,助力于肿瘤患者临床诊疗全过程。
三、肿瘤标志物检测的质量管理
TM的检测质量对于临床治疗至关重要,检测结果可能会导致患者焦虑、治疗方案的调整、生存预期的改变等。根据国内外指南,科学合理选择和应用TM是确保检测质量的前提。检测过程中,需要考虑TM的全流程质量管理,包括对检测前、检测中、检测后不同环节的监控,不仅需要避免技术问题造成的干扰,还要充分了解TM的自身特性,以免造成临床误判。
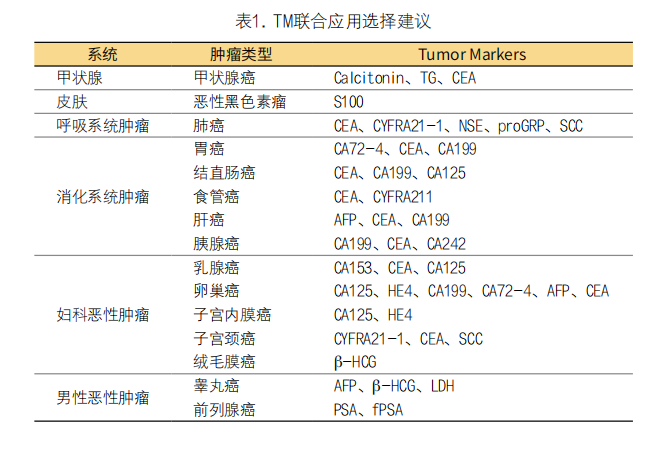
1. 检测前:(1)肿瘤标志物的选择:大多数TM对肿瘤早期诊断的敏感性和特异性不是特别高,其中PSA、HCG、降钙素(CT)、AFP的检测有助于高危人群的早期诊断,可作为筛查手段。其他TM对肿瘤的早期诊断并无太大意义,临床价值主要体现在肿瘤的预后判断、复发监测及疗效的评价等。虽然TM的联合检测对恶性肿瘤的诊断、治疗及预后都起到重要作用,但也引发了笔者对不适宜检验(IR)的担忧。因此必须经过科学分析与严格筛选,最后确定最合理的TM联合检测方案,参见表1。
(2)标本对肿瘤标志物的影响:多数TM检测不会受到抽血时间、常规饮食等因素的干扰,影响检测结果的主要因素包括检测前标本的采集、冷冻、样本溶血、样本量不足和样本污染等。比如PSA、NSE等项目,需在三小时内完成标本分离,短期保存温度需要维持在4℃,长期保存需要在-30℃,尤其是PSA的检测,还需特别注意样本采集前避免某些与前列腺相关的操作(如直肠指诊、活检等)[8, 10, 15, 16]。标本反复冻融也可影响TM检测结果造成假阴性,一项研究显示,经过多次反复冻融后的AFP、CEA、CA125、CA19-9的检测结果均出现不同程度降低[17]。
(3)非肿瘤因素对肿瘤标志物的影响:TM的合成是细胞的一种内在特征,有时与特定的恶性肿瘤或组织学类型有关,比如PSA主要由前列腺细胞合成,AFP在胎儿肝脏中合成[18]。大多数TM并不具备肿瘤特异性,一些组织或器官的正常细胞也可以合成。当非肿瘤性疾病或某些治疗引起合成TM的组织受损或良性增生,将会造成TM假性增高,如肝功能异常,胆道排泄不畅,胆汁淤滞等均可造成CEA、HE4、CA19-9等标志物的浓度增高;肾功能不全时,CA19-9、CYFRA 21-1、SCC、NSE、ProGRP等标志物均可升高[19-21]。
除肝肾功能异常会引起TM假性增高外,其他非肿瘤性疾病也会使TM不同程度增高。通常认为CEA浓度低于5ng/mL是正常水平。一项研究显示,接受CEA筛查的25786名参与者中,有597人(2.3%)的CEA的水平超过5ng/mL,其中有12人(2.0%)实际患有恶性肿瘤,CEA水平为8.3-155.3ng/mL[22]。CEA非肿瘤因素升高涉及多种良性疾病包括肝硬化、肾功能衰竭、肺部疾病(慢性阻塞性肺病、肺炎、肺结核等)、胃肠道疾病(憩室炎、克罗恩病、胰腺炎、溃疡性结肠炎等)、卵巢囊肿或甲状腺功能亢进等[7, 10 , 23-29]。女性生殖系统良性疾病(子宫内膜异位症、子宫肌瘤、卵巢囊肿、畸胎瘤、卵巢皮样囊肿、卵巢黏液囊肿等)会使CA125明显升高[30-31],与此同时,CA125升高还可见于转移瘤合并发生缺血性中风、心衰患者、35%肝硬化和10%慢性活动性肝炎患者。同样地,CA19-9水平异常可见于妇科良性疾病(子宫内膜炎和子宫肌瘤)。临床中多项研究指出,糖尿病与肿瘤的发生与发展也存在高度相关性[32-34],T2DM患者长期血糖控制不佳,CEA、CA19-9、CA125、AFP、CA153均出现显著差异性变化[35]。
临床药物及非常规饮食对TM标志物也有一定影响。如CA72-4会受到抗痛风药物(秋水仙碱、别嘌醇)、复方苦参注射液、非甾体类药物(如布洛芬等)、激素类药物的影响,从而出现假性增高[36];中草药、中成药类药物包括孢子粉、螺旋藻片、金蝉花也可引起 CA72-4一过性升高[37]。
不能忽视的是,某些患者自身的生理因素与环境因素同样会引起某项TM异常轻度升高,生活习惯、种族、年龄、性别、地理位置等因素的影响也可导致检测结果不一致。例如PSA会随着男性年龄的增长而增高;HE4在表观健康女性人群中的参考范围存在中外差异性变化[21];月经期间(月经来潮的第2~3天)血清CA125浓度明显高于其他时间点,而HE4则不受月经周期的影响[38];妊娠期女性的CA125水平也会出现明显升高[39];大约5-10%的重度吸烟人群CEA小幅升高(低于15ng/ml);5%的孕妇、老人、月经期的女性会出现 CA72-4水平升高等等。
因此,当出现TM升高时,我们应回顾患者情况,如发现患有良性疾病(如肝肾功能、特定器官炎症或增生等)、服用保健品和中成药等情况时,建议患者相应病情缓解后或停药后再进行复查。
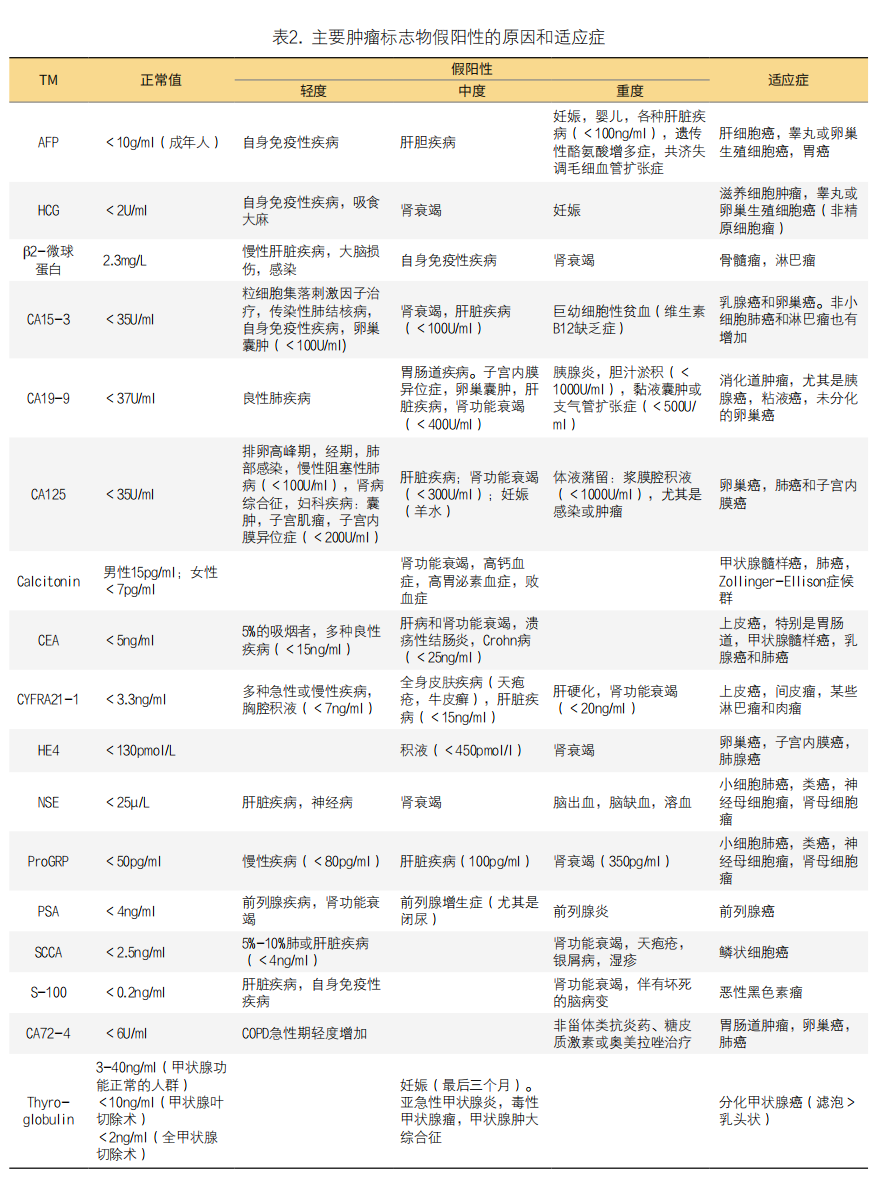
所以,TM的合成是细胞的一种内在特征,一些与肿瘤本身有关,而另一些与TM自身相关。在TM结果升高时我们需要用辩证的眼光看待,以免给患者造成不必要的恐慌。这里引用了西班牙临床生物化学和分子病理学学会、癌症生物标志物委员会共同发布的《导致血清肿瘤标志物结果假阳性的主要原因》的部分内容,分享大家对于非肿瘤因素造成TM增高的排除,详见表2。
2. 检测中:TM的检测方法很多,包括放射免疫测定法、酶联免疫测定法、化学发光免疫测定法等。 采用的方法不同、试剂不同,结果会有差异,因此,在TM连续检测、判断疗效或复发监测时应使用同一检测系统进行,以保证测定结果的可比性。
对于TM的检测要求,与其他检测技术类似,需使用外部和内部质控以确保检测结果的质量[40]。批内变异系数小于5%,批间变异系数小于10%是可以接受的检测方法[41]。为保证TM检测的质量,实验室要做好室内质控,对于TM检测的干扰因素(交叉反应、携带污染、 钩状效应、嗜异性抗体等)导致结果的假性升高或降低,可以通过重复检测既往的样本、不同稀释度重复检测[40]、使用线性范围更广的方法进行排除。
3. 检测后:为了更好的向临床解释TM检测结果,了解患者的基本信息是必不可少的环节。要注意TM轻微升高可能是因为肾功能衰竭或肝脏疾病导致,虽然在检测技术上是不正常的结果,但是对于病人本身可能处于正常范围。因此,我们应当尽可能与临床医生做好沟通,以利于更好的开展后续的诊断及治疗工作。当患者没有接受某种形式的治疗时,如果TM检测结果升高,应当认真区分真阳性与假阳性结果。临床工作中经常会发现部分患者由于其TM基线值处在稳定的较高水平,因此其TM的升高对于患者而言是正常的。总而言之,一个正确的结果不应当只保证检测技术的精准,更应该有正确合理的解释。结果评估时,TM检测结果如何变化尤为重要,在病理范围内升高或降低25%则视为阳性改变,但需要做好连续监测以排除TM干扰因素存在的可能性。
虽然目前TM的检测厂家多数使用的是常见来源的抗体,但是多数TM试剂缺乏国际标准品,尤其是糖类抗原类,且不同的厂家使用的单克隆抗体针对抗原的位点不同,又缺乏统一的抗原成分、校准品和参考方法,无法标准化,所以,对于检测结果的可比性不尽如人意[42, 43]。若利用不同的检测方法对同一个样本进行检测,出现了较大的差异,如果不考虑方法学因素,将可能导致临床医生做出错误的诊断。当检测方法发生变化时,不仅要考虑变化的百分比(增加或减少),而且要分区段进行研究,包括正常区段和决策区段。当对一个新的检测结果进行评价时,应当在共同时段采用不同方法或者用新方法对过去的标本进行检测,任何方法学的变化都应在至少六个月内的检测结果报告中注明。
在仪器自动化和信息大数据时代,检验人员除了要遵守TM相关卫生行业标准、规范仪器操作规程、做好全流程质量管理外,还应了解TM检测的影响因素,加强与临床医生沟通,使临床医生不仅能够及时、准确的给予患者诊治,还能更好的将患者从网络渠道搜取的片段式知识予以纠正,更加理性的看待TM在疾病诊治中的假阳性或假阴性,减少不必要的医患纠纷,使TM在肿瘤的诊治中更好的发挥作用。
我国政府从国家发展战略的高度,逐渐将癌症防治纳入国家重要公共卫生政策的工作内容。《“十三五”卫生与健康规划》、《“健康中国2030”规划纲要》等都明确了做好新时期肿瘤防治的方针和政策,到2030年实现总体癌症5年生存率提高15%的战略目标。在今年4月15-21日第29个全国肿瘤防治宣传周,也以“癌症防治 全面行动—全人群 全周期 全社会”为主题,可见社会各界对于肿瘤防治工作的决心,作为检验人我们更要积极倡导科学防治,实现对癌症的有效防控从全人群、全周期、全社会一起行动。
参考文献
Hyuna S, Jacques F, MSc, RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J].CA CANCER J CLIN, 2021, 0:1–41
徐志坚. 探讨癌症机会筛查和"防癌体检"对当前肿瘤防控的重要意义[J]. 中华健康管理学杂志, 2019, 13( 5 ): 369-375
郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45(3): 212-220.
Xia C, Dong X, Li H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chinese Medical Journal, 2022, 135(5): 584-590.
Sartorjus B, Sartorius K.How much incident lung cancer was missed globally in 2012 An ecological country level study[J].Geospat Health, 2016, 11(2): 396.
陈文, 袁蕾, 卢宪中,等. ROMA指数用于卵巢癌诊断的经济学评价[J]. 中国卫生经济, 2021, 40(6):4.
Molina R, Filella X, Ballest AM. Marcadores tumorales, teoria o realidad[J]. Med Clin, 1994, 102: 189-195.
Sturgeon C. Practice guideliness for tumor marker use in the clinic[J]. Clin Chem, 2002, 48: 1151-1159.
Riesen WF, Keller H. Definition of the performance of tumor marker tests, Principal considerations[J]. J Tumor Marker Oncol, 1993, 8: 15-20.
Sturgeon CM, Duffy MJ, Stenman UH. et al. National Academy of Clinical Biochemistry National Academy of Clinical Biochemistry laboratory medicine practice guidelines for use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers[J]. Clin Chem, 2008, 54: 11-79.
倪宁, 吕爱玲. 4种肿瘤标志物联合检测对胸腔积液鉴别诊断的意义[J]. 中国医科大学学报, 2005, 34(1): 90.
凤敏华. 多项肿瘤标志物对肺癌诊断的临床意义[J]. 实用肿瘤学杂志, 2007, 21(1): 44-46.
王冬莲, 金敏雅, 张慧芝. 胸水CYFRA21-1、NSE、C EA、CA125及CA199联合测定对肺癌的应用价值[J]. 江西医学检验, 2006, 24(4): 333-334.
李淑英. 以症状和 (或) 肿瘤标志物升高首诊结直肠肿瘤的临床特征分析[D]. 山东: 山东大学, 2022.
Selley S, Donovan J, Faulkner A, et al.Gillatt, D. Diagnosis, management and screening of early localised prostate cancer[J]. Health Technology Assessment, 1997, 1(2): i, 1-96.
Piironen T, Pettersson K, Suonpaa M. et al. In vitro stability of free prostatespecific antigen (PSA) complexeded to alpha 2 antichymotrypsin in blood samples[J]. Urology, 1996, 48: 81-87.
Gao YC, Yuan ZB. Effect of freeze–thaw cycles on serum measurements of AFP, CEA, CA125 and CA19-9.Scand[J]. J Clin Lab Invest, 2007, 67: 741-747.
Schneider DT, Calaminus G. Diagnòstic value of Alpha1-Fetoprotein and Beta- Human Chorionic Gonadotropin in infancy and childhood[J]. Pediatric Hematology and Oncology, 2001, 18: 11-26.
Molina R, Auge JM, Filella X, et al. Pro-gastrin-releasing peptide (proGRP) in patients with benign and malignant diseases: comparison with CEA, SCC, CYFRA 21-1 and NSE in patients with lung cancer[J]. Anticancer Research, 2005, 25(3A): 1773-1778.
Amiri, Shamekhi F. Serum tumor markers in chronic kidney disease: as clinical tool in diagnosis, treatment and prognosis of cancers[J]. Renal Failure, 2016, 38(4): 530-544.
Xiaofang Y, Yue Z, Xialian X, et al. Serum tumour markers in patients with chronic kidney disease[J]. Scand J Clin Lab Invest, 2007, 67: 661-667.
Soie Chung MD. False-positive Elevations in Carcinoembryonic Antigen Levels at a Health Screening Center[J]. Lab Med online Vol. 9, No. 3: 146-152, July 2019
Cases A, Filella X, Molina R, et al. (1999). Tumor markers in chronic renal failure and hemodialysis patients[J]. Nephron, 1991, 57(2): 183-186.
Filella X, Cases A, Molina R, et al. Tumor markers in patients with chronic renal failure[J]. Int J Biol Markers, 1990, 5: 85-88.
Sekiya K, Sakai T, Homma S, et al. Pulmonary tuberculosis accompanied by a transient increase in serum carcinoembryonic antigen level with tuberculous empyema drainage[J]. Intern Med, 2007, 46: 1795-1798.
Collazos J, Genollà J, Ruibal A. evaluation of the behavior of carcinoembryonic antigen in cirrhotic patients[J]. Int J Biol Markers, 1992, 7: 244-248.
Amino N, Kuro R, Yabu Y, et al. Elevated levels of circulating carcinoembryonic antigen in hypothyroidism[J]. J Clin Endocrinol metab, 1981, 52: 457-462.
Nakeeb A, Lipsett P, Lillemoe K, et al. Biliary carcinoembryonic antigen levels are a marker for cholangiocarcinoma[J]. Am J Surg, 1996, 171: 147-152.
Eberth W, Muley T, Drings P. Does the assessment of serum markers in patients with lung cancer aid in the clinical decision making process[J]. Anticancer Res, 1996, 16: 2161-2168.
Pyeon SY, Park JY, Ki KD, et al. Abnormally high level of CA-19-9 in a benign ovarian cyst[J]. Obstet Gynecol Sci, 2015, 58(6): 530-532.
Pandey D, Sharma R, Sharma S, et al. Unusually high serum levels of CA 19-9 in an ovarian tumour: malignant or benign[J]. J Clin Diagn Res, 2017, 11(3): QD08-QD10.
Tharek Z, Ramli AS, Whitford DL, et al. Relationship between self-efficacy, self-care behaviour and glycaemic control among patients with type 2 diabetes mellitus in the Malaysian primary care setting[J]. BMC Family Practice, 2018, 19(1):
Zhu WW, Yang HX, Wang C, et al. High Prevalence of Gestational Diabetes Mellitus in Beijing: Effect of Maternal Birth Weight and Other Risk Factors[J]. Chinese Medical Journal, 2017, 130(9): 1019 -1025.
陈娟, 高鹏霞. 血清中胰岛素样生长因子Ⅰ、肿瘤坏死因子 α、血管内皮生长因子165在糖尿病视网膜病变中的诊断价值[J]. 中华内分泌代谢杂志, 2018, 34(11): 935-938.
王旭桃. 2型糖尿病患者肿瘤标志物水平与糖尿病并发症的关系及相关影响因素分析[D]. 河南:新乡医学院, 2020.
黄芸菲, 吴巧萍, 杨俊杰. 糖类抗原724 (CA724) 水平在部分痛风患者体内升高的原因分析[C]//2014年浙江省检验医学学术年会论文汇编. 2014.
孙欢. 服用蛹虫草致CA72-4异常升高1例并文献分析[J]. 健康必读, 2020, 23: 298.
Moore, Richard G, BethHartnett, et al. Assessment of serum HE4 levels throughout the normal menstrual cycle[J]. Am J Obstet Gynecol, 2017, 217(1): 53.e1-53.e9.
Han SN, Lotgerink A, Gziri M M, et al. Physiologic variations of serum tumor markers in gynecological malignancies during pregnancy: a systematic review[J]. BMC Med, 2012, 10(1): 86.
Sturgeon C, Dati F, Duffy MJ. et al. (1999). Quality requirements and control: EGTM recommendations. European Group on Tumour Markers[J]. Anticancer Res, 1999, 19(4A): 2791-2794.
中国卫生行业标准-常用血清肿瘤标志物检测的临床应用和质量管理(WS/T 459-2018)
Sturgeon CM, Seth J. Why do immunoassays for tumor markers give differing results? -- A view from the UK National External Quality Assessment Schemes[J]. Eur J Clin Chem Clin Biochem, 1996, 34(9): 755-759.
Sturgeon C. Practice guidelines for tumor marker use in the clinic[J]. Clin Chem, 2002, 48(8): 1151-1158.




