肿瘤标志物检测在临床应用中面临的机遇与挑战

王慜杰,主任技师,国家癌症中心 中国医学科学院肿瘤医院检验科。专业研究方向:临床检验诊断,主要从事肿瘤标志物临床应用研究工作。学术兼职:中国性病艾滋病防治协会艾滋病检测与促进社会应用专业委员会常委;中国抗癌协会癌症筛查与早诊早治专业委员会委员;中国生物化学与分子生物学会临床医学专业分会委员;中国医院协会临床检验专业委员会青年委员等。参与《中国结直肠癌筛查与早诊早治指南(2020,北京)》、《中国人群肝癌筛查指南(2022,北京)》等多个指南制定。以第一作者/通讯作者在国内外核心杂志发表论文20多篇。

齐军,主任医师、教授、硕士研究生导师。中国医学科学院肿瘤医院深圳医院检验科主任、输血科主任,北京协和医学院临床检验诊断学系副主任。专业研究方向:临床检验诊断,重点是肿瘤实验诊断及实验室检测项目临床应用研究。学术兼职:中华医学会检验医学分会第九届委员;白求恩精神研究会检验医学分会第一届、第二届理事会副会长;中国老年医学学会检验医学分会常委;中国研究型医院学会血栓与止血专业委员会常委;中国医学装备协会临床检验医学专业委员会常委等。在国内外核心期刊上发表论文近90余篇。参编及主编书籍10余部。
肿瘤标志物是指在恶性肿瘤的发生和增殖过程中,由肿瘤细胞本身所产生的或是由机体对肿瘤细胞反应而异常产生和(或)升高的,反映肿瘤存在和生长的一类物质,包括蛋白质、激素、酶(同工酶)、多胺及癌基因产物等,存在于患者的血液、体液、细胞或组织中,可用生物化学、免疫学及分子生物学等方法进行测定,对肿瘤的辅助诊断、鉴别诊断、疗效观察、复发监测以及预后评估具有一定的临床诊疗价值[1]。
自20世纪60年代,甲胎蛋白(AFP)[2]和癌胚抗原(CEA)[3]相继被发现并作为肿瘤标志物应用于肿瘤临床诊疗以来,目前已研究发现了上百种,肿瘤标志物已被广大医务人员及患者所熟知。作为基于核酸检测技术的特殊类型肿瘤标志物,液体活检技术的发展更是日新月异。鉴于篇幅限制,本文重点对传统血清肿瘤标志物在临床应用实践中面临的机遇与挑战进行论述。
一、血清肿瘤标志物检测技术的发展与机遇
肿瘤标志物种类繁多,检测方法多样;绝大多数检测方法是基于免疫学反应的特异性和标记技术发展起来的;常见的肿瘤标志物检测方法有放射免疫分析(RIA)、酶联免疫吸附试验(ELISA)、蛋白质芯片和化学发光免疫分析(CLIA)等[4]。RIA由于高灵敏度、高特异性以及易于商品化等原因,曾被广泛应用于肿瘤标志物检验;但RIA试剂盒效期短、有放射性污染风险等缺点,随着ELISA技术的发展,特别是CLIA的迅猛发展,RIA在世纪之交逐渐被淘汰;目前,ELISA在肿瘤标志物检验领域的占有率也呈现明显萎缩态势,面临被CLIA完全替代的境地。
CLIA是将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,用于各种抗原、半抗原、抗体、激素等的检测分析技术。上世纪70年代末期Arakawe首先应用化学发光免疫分析技术检测皮质醇[5],是免疫诊断技术不断更新迭代后的主流方向,至今已经发展成为一种成熟的、应用范围非常广泛的免疫学检测技术方法。
美国Ciba Corning公司研制的基于CLIA的ACS:180自动CLIA系统化学发光免疫分析仪于1991年上世[6]。经过短短20多年时间的发展,化学发光免疫分析仪从最早的单机设备发展到包含前处理、后处理和可以多台设备联机的全自动化学发光免疫流水线;化学发光免疫分析仪也以其灵敏度高、特异性强、方法稳定快速、检测范围宽、试剂稳定且有效期长、操作简单自动化程度高及可实现高通量等优点,在过去20多年的时间里逐渐发展成为临床免疫学检验主流的检测技术平台。目前,国内化学发光免疫分析仪的研发起步较晚,经过近20年的发展,在肿瘤标志物检验领域,国产厂家已经开始崭露头角,这有望打破国外大牌厂家长期垄断的市场局面。
目前,均相免疫分析技术在国内外的受关注度也持续提高,并有望在未来发展成为改变免疫检测领域格局的革命性技术。均相化学发光免疫分析技术(homogeneous chemiluminescence immunoassay)是基于纳米微球的化学发光、以时间分辨荧光为检测模式的新型免疫学检测技术,具有独特的能量转移机制。1994年,德灵诊断(Behring Diagnosis Inc.)的Edwin F. Ullman等学者提出并开发了一种创新型的均相免疫分析技术:发光氧通道免疫分析(Luminescent Oxygen Channeling Immunoassay,LOCI)[7]。LOCI分析技术具有均相免洗、高灵敏、操作简便、易于自动化等诸多优势。国内学者在LOCI技术基础上,从试剂及设备进行了改进并开发了光激化学发光检测系统(Light initiated chemiluminescence assay,LiCA),经过十几年的发展,可以广泛应用于血清肿瘤标志物的检测[8-9]。
二、肿瘤标志物在肿瘤筛查与诊疗中的临床应用
1. 肿瘤筛查与早期诊断中的应用:国家癌症中心最新发布的全国癌症统计数据显示,我国2016年新发癌症病例约406.4万,死亡人数约241.4万,发病率及死亡率呈现逐年上升趋势[10]。随着我国人口老龄化和工业化、城镇化进程不断加快,加之慢性感染、不健康生活方式的广泛流行和环境污染、职业暴露等因素的逐渐累积,我国癌症防控形势仍将十分严峻。恶性肿瘤防治的关键在于肿瘤早期诊断,肿瘤标志物在高危人群的癌症筛查中发挥重要作用。
美国国立卫生研究院下属的美国国家癌症研究所(National Cancer Institute,NCI)推荐的可用于癌症筛查/早期诊断的肿瘤标志物包括[11]:(1)人乳头瘤病毒(HPV)检测用于宫颈癌筛查;(2)高灵敏度的粪便隐血实验和粪便DNA检测用于结直肠癌筛查;(3)AFP用于高危人群肝细胞癌早期诊断;(4)CA125用于高危人群卵巢癌早期诊断;(5)前列腺特异性抗原(PSA)用于前列腺癌筛查;(6)基于液体活检标志物的泛癌种早筛(multi-cancer early detection,MCED)技术。
美国癌症协会(American Cancer Society,ACS)推荐的癌症筛查指南中,推荐在适宜人群中开展基于血清肿瘤标志物的结直肠癌、宫颈癌和前列腺癌早期筛查[12]。
在国家卫生健康委员会疾病预防控制局的委托与指导下,由国家癌症中心发起,联合多学科专家,整合了结直肠癌、肺癌、食管癌、胃癌、肝癌和前列腺癌等6种常见癌症筛查与早诊早治领域的国内外研究进展,同时考虑中国国情和癌症筛查的实际经验,根据世界卫生组织推荐的指南制定原则和方法,相继制定了6种癌症的筛查与早诊早治指南。在《中国前列腺癌筛查与早诊早治指南》中,“推荐首选PSA作为前列腺癌筛查手段,PSA临界值为4.0ng/ml(强推荐,证据分级为中级)”[13]。在《中国人群肝癌筛查指南》中,推荐“超声检查联合AFP检测仍是最广泛采用的肝癌筛查技术;PIVKA-Ⅱ等其他新血清标志物可作为补充筛查技术,但尚不能完全替代超声检查联合AFP检测(证据质量:中;推荐强度:强)”[14]。
综上所见,合理应用血清肿瘤标志物,联合其他检查手段,可以在常见癌症的筛查及早诊中发挥重要作用。
表1. 常见肿瘤标志物在恶性肿瘤临床诊疗中的临床应用
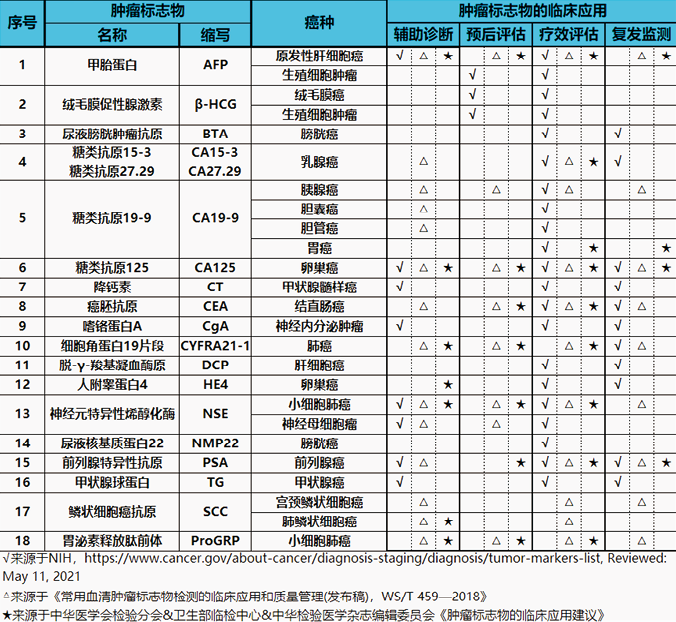
2. 恶性肿瘤临床诊疗中的应用:肿瘤标志物是恶性肿瘤辅助诊断、预后评估、疗效评估与复发监测的重要指标。本文综合了吴健民教授等2018年发布的《WS/T 459-2018常用血清肿瘤标志物检测的临床应用和质量管理(发布稿)》[1]、中华医学会检验分会&卫生部临检中心&中华检验医学杂志编辑委员会2012版《肿瘤标志物的临床应用建议》[15]和美国国家癌症研究所公布的《常用肿瘤标志物》[16]以及欧洲肿瘤标志物专家组发布的部分文件[17-18],对部分常见肿瘤标志物在恶性肿瘤临床诊疗中的临床应用进行汇总,详见表1。可见,肿瘤标志物贯穿了癌症辅助诊断与鉴别诊断、预后评估、疗效评估及复发监测等癌症治疗的全过程。
随着抗肿瘤治疗进入精准治疗时代,肿瘤标志物检测也是肿瘤个体化精准治疗非常重要的环节,有助于抗肿瘤治疗方案的有效选择。特别是随着靶向药物的出现,伴随诊断(companion diagnostic test)成为广泛应用于抗肿瘤治疗过程中特定靶点药物选择的重要手段;通过测定患者的肿瘤是否具有药物靶向的特定基因变化或肿瘤标志物,来帮助确定病人是否应该接受药物治疗。另外,伴随诊断试验还可用于发现治疗是否可能产生严重的副作用或治疗效果评估[19-20]。
3. 肿瘤标志物临床实践应用的规范化:肿瘤标志物作为肿瘤临床诊疗重要的客观指标,面临重要的发展机遇,应规范化应用肿瘤标志物来指导临床实践。
为适应临床实践需要,规范肿瘤标志物的临床应用,国家卫健委组织专家制定并于2018年12月连续发布了两个肿瘤标志物相关的推荐性卫生行业标准文件。《WS/T 459-2018常用血清肿瘤标志物检测的临床应用和质量管理》,重点关注了临床常用的9个肿瘤标志物的临床应用,包括甲胎蛋白(AFP),癌胚抗原(CEA),神经元特异性烯醇化酶(NSE),鳞状细胞癌抗原(SCCAg),细胞角蛋白19片段(Cyfra21-1),胃泌素释放肽前体(ProGRP),糖类抗原125(CA125),糖类抗原15-3(CA15-3)和糖类抗原19-9(CA19-9)等[1]。《WS/T 645.2-2018临床常用免疫学检验项目参考区间》,规定了血清AFP、CEA、CA19-9、CA15-3、CA125等5个肿瘤标志物在中国成人(≥18岁)的参考区间及其应用[21]。中国抗癌协会甲状腺癌专业委员会组织编写了《甲状腺癌血清标志物临床应用专家共识(2017版)》,加强甲状腺癌血清标志物,特别是甲状腺球蛋白(TG)和降钙素(CT)在临床的合理、规范化应用[22]。
三、肿瘤标志物应用中面临的挑战
1. 检验结果一致性的挑战:临床广泛应用的血清肿瘤标志物中,大多数缺乏国际公认的溯源体系和有证参考物质;只有AFP检测结果溯源至WHO参考标准72/225,CEA检测结果溯源至WHO参考标准73/601,hCG检测结果溯源至WHO参考标准75/589,PSA和fPSA检测结果溯源至WHO参考标准96/670和96/668[23]。其他的如CA 19-9、CA 15-3、CA 125等均无公认的溯源体系;再加上不同检测系统在针对抗原位点、抗体来源、包被方式以及发光原理等方面存在差异,导致肿瘤标志物在不同系统间的检测结果不尽相同;难以在不同检测系统间使用统一的参考区间[21]。特别是随着多个国产自动化发光免疫分析系统市场占有率的不断提高,应更加重视不同检测系统间可能存在的检验结果的差异,必要时,通过跟踪随访患者的临床诊断信息来确认检验结果的准确性。
2. 新型血清肿瘤标志物检测试剂从上市到实现临床应用的挑战:(1)肿瘤标志物临床应用前流程:国内外生产厂家生产的用于肿瘤标志物检验的体外诊断试剂,在正式上市前,需要按照国家药监局(NMPA)的相关规定,完成注册申请相关的临床试验。为指导体外诊断试剂临床试验工作,根据《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),在原国家食品药品监督管理总局发布的《体外诊断试剂临床试验技术指导原则》(原国家食品药品监督管理总局通告2014年第16号)基础上,国家药监局于2021年9月组织制定了《体外诊断试剂临床试验技术指导原则》(国家药监局通告2021年第72号),并予以正式发布[24]。该指导原则明确了临床试验的基本原则和临床试验中需要考虑的关键因素,并对临床试验质量管理提出基本要求,用于指导申办者的临床试验工作,也为技术审评部门对临床试验资料的审评提供参考。对于申办者,该指导原则明确指出,申办者应根据产品具体情况,制定合理的临床试验方案[25]。此外,一个新的肿瘤标志物检测试剂,在获准上市后,还需要经历收费物价申报,进入《医疗服务项目价格》名录;新技术新项目准入以及招标采购等环节,才能最后进入到临床应用环节。(2)上市后到临床应用的挑战:以HE4检测试剂盒为例,2012年国家药品监督管理局批准进口医疗器械注册,可以在国内进入临床应用,但是,直到3年之后临床实验室才陆续开始HE4检测。HE4从注册审批后,再历经物价申报与审批及使用医疗单位新技术准入,临床应用前大样本的验证过程才能在临床获得应用。
同样,在临床广泛应用的肿瘤标志物ProGRP为例,血清ProGRP在肺小细胞癌临床诊疗中的临床价值最早在1994年就有文献报道[26]。2012年获得国家药品监督管理局进口医疗器械注册批准,但在2013年以后国内的医疗机构才开始逐渐在临床应用。可见,从新型血清肿瘤标志物在科研实验室被发现,到真正实现在临床广泛应用,还需要一段相对比较长的时间,除了NMPA的正常的审批流程,还有很多的环节,尤其是在临床应用前的验证,包括临床医生对新型肿瘤标志物的认可实践程度等,只有充分的大数据来证明该产品在临床应用的有效性及临床意义,才能加速推进新项目在临床的落地。
3. 发展新型血清肿瘤标志物面临的挑战:目前,在临床得到广泛应用的血清肿瘤标志物包括AFP、CEA、NSE,SCC-Ag,CYFRA 21-1,CA125,CA15-3、CA19-9和Pro-GRP等,除AFP和CEA在20世纪60年代即被发现并应用于临床以外,绝大多数在20世纪80年代就被发现并应用于恶性肿瘤的临床诊疗[2-3, 27-32]。
进入21世纪以来,新发现并在肿瘤临床诊疗得到广泛应用的常见血清肿瘤标志物只有人附睾蛋白4(HE4)[33]。
当前,在肿瘤标志物研究领域,缺乏国际上普遍接受的监管指南和标准。从事新型肿瘤标志物研发的基础实验室团队普遍存在缺乏临床肿瘤诊疗经验的现状[34]。在2000年7月第一届癌症诊断国际会议期间,NCI与欧洲癌症研究与治疗组织(European Organization for Research and Treatment of Cancer,EORTC)联席会议专家组提议,着手制定肿瘤标志物研究报告指南;专家组制定并于2005年正式发布了《肿瘤标志物预后研究报告规范》(Reporting recommendations for tumor marker prognostic studies,REMARK)[35-36]。专家组又于2012年发表了《关于REMARK的解释与说明》,对REMARK中的20个项目清单进行了详细解释,包括优质的肿瘤标志物预后研究报告的案例[37]。REMARK主要侧重于单个预后指标的研究,但该规范的大部分内容同样适用于其他类型的预后研究,包括多个预后指标的研究、开发预后模型的研究和预测治疗反应的研究[38-39]。
在美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)的一份研究报告中,描述了如何开发和应用生物标志物的全流程;明确了新型标志物开发过程中面临的分析性能确认(Analytic validation)、临床性能确认(Clinical validation)和临床有效性(Clinical utility)评估的现状,指出使用组合水平的证据评分系统有助于对肿瘤标志物开展科学评估[39]。
分析性能确认(Analytic validation)关注的重点是分析测量测序的准确性、分析灵敏度和特异性;临床性能确认(Clinical validation)评估肿瘤标志物检验结果与预期临床结果之间关联的强度,包括诊断性、预后性以及预测性肿瘤标志物;临床有效性(Clinical utility)是指肿瘤标志物检验结果应用后改善临床决策和患者预后的能力[34, 39]。
4. 肿瘤标志物临床有效性验证面临的挑战:临床有效性的确定取决于几个因素,包括肿瘤标志物研究终点的确定,应用肿瘤标志物的终点差异必须有多大,支持应用肿瘤标志物的决定的证据水平,以及任何利益相关者的风险容忍度决定应用它。这些因素没有一个是绝对的决定因素,但是它们必须包括在肿瘤标志物是否具有临床效用的讨论中[40]。临床应用有效性评价需要高水平研究证据的支持,用来证实肿瘤标志物检验结果用于指导临床决策的患者将比未进行肿瘤标志物检验的患者能够获得更好的临床预期。这种高水平的研究证据,可以从以肿瘤标志物的临床有效性为主要研究目标的前瞻性随机临床试验中获得;另外,也可以使用既往前瞻性研究收集的样本,并采用设计严谨的前瞻性回顾性研究方法获得[41]。此外,在整个肿瘤标志物研发、验证过程中,还需要注重人工智能的应用。
目前,国产肿瘤标志物的研发势头良好,在配套的国产自动化免疫发光设备的研发与推广过程中,不应仅仅满足于将进口设备作为参比仪器,进行比对后投放市场;这种比对并不科学也不客观[42]。解决这个问题,只有在肿瘤标志物的研发阶段开始,组织协调好包括临床医学、病理学、统计学、实验室技术等多方面专家人才队伍,从临床肿瘤诊疗的实际需求出发,在做好分析性能确认和临床性能确认的基础上,开展前瞻性的队列研究,按照REMARK规范,完成严格的临床有效性验证。对国产自动化免疫分析设备在肿瘤临床诊断符合率、鉴别诊断、预后判断及疗效监测等方面的应用价值进行全面评估,取代以往单纯与进口设备进行结果比对的做法,进一步推动国产自动化发光免疫产品的临床应用。
四、血清肿瘤标志物未来的发展方向与展望
毫无疑问,血清肿瘤标志物作为客观的指标,贯穿于肿瘤临床诊疗及治疗后随访的全过程,为临床医生和患者提供有价值的信息;随着循证证据的积累,必将发挥越来越重要的作用。展望未来,为更有效的发挥肿瘤标志物的临床价值,笔者认为还应继续加强以下几方面研究工作:
1. 合理应用联合检测,有效改善单一肿瘤标志物的缺陷,提高检测敏感度和特异性。特别是将传统的血清肿瘤标志物与新型的分子标志物紧密结合,探寻联合检测的有效性。
2. 强调血清肿瘤标志物动态监测的重要性,开展前瞻性或前瞻回顾性研究,在大型队列研究基础上深入阐明血清肿瘤标志物动态监测在肿瘤早期诊断、预后、疗效监测中的临床意义。
3. 充分发掘大数据,开展多指标预测模型建立工作,将实验室肿瘤标志物及其他的客观指标与患者的临床病理特征、影像学特征结合起来,建立肿瘤早期诊断、预后评估、疗效评价及复发监测的预测模型。
4. 协同推动肿瘤标志物检测的量值溯源工作,保障肿瘤标志物检测质量,提高不同检测系统间肿瘤标志物检测结果的一致性。
参考文献
常用血清肿瘤标志物检测的临床应用和质量管理: WS/T 459-2018[S]. 2018.
Smith JB. Alpha-fetoprotein: occurrence in certain malignant diseases and review of clinical applications. Med Clin North Am. 1970 May; 54(3):797-803. PMID: 4192953.
Krupey J, Gold P, Freedman SO. Physicochemical studies of the carcinoembryonic antigens of the human digestive system. J Exp Med. 1968 Sep 1;128(3):387-98. doi: 10.1084/jem.128.3.387. PMID: 4299103; PMCID: PMC2138532.
李金明. 免疫测定技术的临床应用及应注意的问题[J]. 中华检验医学杂志, 2008,31(11): 1205-1208. DOI: 10.3321/j.issn:1009-9158.2008.11.001.
Arakawa H, Maeda M, Tsuji A. Chemiluminescence enzyme immunoassay of cortisol using peroxidase as label. Anal Biochem. 1979 Sep 1;97(2):248-54. doi: 10.1016/0003-2697(79)90352-x. PMID: 393131.
Boland J, Carey G, Krodel E, Kwiatkowski M. The Ciba Corning ACS:180 benchtop immunoassay analyzer. Clin Chem. 1990 Sep;36(9):1598-601. PMID: 2208699.
Ullman EF, Kirakossian H, Singh S, et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proc. Natl. Acad. Sci. U. S. A. 1994, 91 (12), 5426-5430.
马宏伟, 赵卫国, 潘柏申. 血清肌红蛋白光激化学发光免疫测定法的建立[J]. 检验医学,2006,21(1):55-57. DOI:10.3969/j.issn.1673-8640.2006.01.006.
卢培, 赵卫国, 黄秋芳, 等. 糖类抗原CA19-9光激化学发光免疫分析方法的建立[J]. 中国卫生检验杂志, 2012, 22 (2): 260-263.
Rongshou Z, Siwei Z, Hongmei Z, et al. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center 2 (2022) 1–9.
Screening Tests was originally published by the National Cancer Institute. https://www.cancer.gov/ about-cancer/screening/screening-tests
https://www.cancer.org/healthy/find-cancer-early/screening-recommendations-by-age. html#65_or_older
赫捷, 陈万青, 李霓, 等. 中国前列腺癌筛查与早诊早治指南 (2022, 北京) [J]. 中华肿瘤杂志, 2022, 44(1): 29-53. DOI:10.3760/cma.j.cn112152-20211226-00975.
赫捷, 陈万青, 沈洪兵, 等. 中国人群肝癌筛查指南 (2022, 北京) [J]. 中华肿瘤杂志, 2022, 44(8): 779-814. DOI:10.3760/cma.j.cn112152-20220720-00502.
中华医学会检验分会, 卫生部临床检验中心, 中华检验医学杂志编辑委员会. 肿瘤标志物的临床应用建议[J]. 中华检验医学杂志, 2012, 35(2): 103-116. DOI:10.3760/cma.j.issn.1009-9158.2012.02.003.
Tumor Markers in Common Use was originally published by the National Cancer Institute. https://www.cancer.gov/about-cancer/diagnosis-staging/diagnosis/tumor-markers-list, Reviewed: May 11, 2021.
Duffy MJ, Sturgeon C, Lamerz R, et al. Tumor markers in pancreatic cancer: a European Group on Tumor Markers (EGTM) status report. Ann Oncol. 2010 Mar; 21(3): 441-447. doi: 10.1093/annonc/mdp332. Epub 2009 Aug 18. PMID: 19690057.
Duffy MJ, Lamerz R, Haglund C, et al. Tumor markers in colorectal cancer, gastric cancer and gastrointestinal stromal cancers: European group on tumor markers 2014 guidelines update. Int J Cancer. 2014 Jun 1; 134(11): 2513-22. doi: 10.1002/ijc.28384. Epub 2013 Aug 27. PMID: 23852704; PMCID: PMC4217376.
https://www.fda.gov/medical-devices/in-vitro-diagnostics/precision-medicine.
https://www.fda.gov/medical-devices/in-vitro-diagnostics/companion-diagnostics.
临床常用免疫学检验项目参考区间: WS_T 645.2-2018[S]. 2018.
中国抗癌协会甲状腺癌专业委员会(CATO). 甲状腺癌血清标志物临床应用专家共识(2017版)[J]. 中国肿瘤临床, 2018, 45(1): 7-13. DOI: 10.3969/j.issn.1000-8179.2018.01.265.
Sturgeon CM, Hoffman BR, Chan DW,et al. National academy of clinical biochemistry. national academy of clinical biochemistry laboratory medicine practice guidelines for use of tumor markers in clinical practice: quality requirements. Clin Chem. 2008 Aug; 54(8): e1-e10. doi: 10.1373/clinchem. 2007. 094144. Epub 2008 Jul 7. PMID: 18606634; PMCID: PMC5564312.
国家药监局通告2021年第72号通告.《体外诊断试剂临床试验技术指导原则》
李耀华. 肿瘤标志物类定量检测试剂注册申报临床研究技术要求[J]. 中华检验医学杂志, 2011, 34(12): 1168-1170. DOI: 10.3760/cma.j.issn.1009-9158.2011.12.030.
Miyake Y, Kodama T, Yamaguchi K. Pro-gastrin-releasing peptide(31-98) is a specific tumor marker in patients with small cell lung carcinoma. Cancer Res. 1994 Apr 15; 54(8): 2136-40. PMID: 8174119.
Tapia FJ, Polak JM, Barbosa AJ, et al. Neuron-specific enolase is produced by neuroendocrine tumours. Lancet. 1981 Apr 11;1(8224): 808-11. doi: 10.1016/s0140-6736(81)92682-9. PMID: 6111674.
Kitamura M, Matsuda H, Matsuura H, et al. [Squamous cell carcinoma related antigen in serum of the patients with esophageal carcinoma]. Nihon Geka Gakkai Zasshi. 1985 Nov; 86(11): 1561. Japanese. PMID: 4079908.
Pujol JL, Grenier J, Daurès JP,et al. Serum fragment of cytokeratin subunit 19 measured by CYFRA 21-1 immunoradiometric assay as a marker of lung cancer. Cancer Res. 1993 Jan 1;53(1):61-6. PMID: 7677981.
Bast RC Jr, Klug TL, St John E, et al. A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N Engl J Med. 1983 Oct 13; 309(15): 883-7. doi: 10.1056/NEJM198310133091503. PMID: 6310399.
Gion M, Mione R, Dittadi R,et al. Carcinoembryonic antigen, ferritin, tissue polypeptide antigen, and CA15/3 in breast cancer: relationship between carcinoma and normal breast tissue. Int J Biol Markers. 1986 Jan-Apr; 1(1): 33-8. doi: 10.1177/172460088600100106. PMID: 3480322.
DelVillano BC, Zurawski VR Jr. The carbohydrate antigenic determinant 19-9 (CA 19-9): a monoclonal antibody defined tumor marker. Lab Res Methods Biol Med. 1983; 8: 269-82. PMID: 6196588.
Hellström I, Raycraft J, Hayden-Ledbetter M,et al. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res. 2003 Jul 1; 63(13): 3695-700. PMID: 12839961.
Skov J, Kristiansen K, Jespersen J, Olesen P. Status and perspectives of biomarker validation for diagnosis, stratification, and treatment. Public Health. 2021 Jan; 190: 173-175. doi: 10.1016/j.puhe.2020.11.002. Epub 2020 Dec 9. PMID: 33309006.
McShane LM, Altman DG, Sauerbrei W, et al. Reporting recommendations for tumor marker prognostic studies (REMARK). J Natl Cancer Inst. 2005; 97(16): 1180–1184.
36. McShane LM, Altman DG, Sauerbrei W, et al. Statistics Subcommittee of the NCI-EORTC Working Group on Cancer Diagnostics. REporting recommendations for tumour MARKer prognostic studies (REMARK). Br J Cancer. 2005 Aug 22;93(4):387-391. doi: 10.1038/sj.bjc.6602678. PMID: 16106245; PMCID: PMC2361579.
Altman DG, McShane LM, Sauerbrei W,et al. Reporting recommendations for tumor marker prognostic studies (REMARK): explanation and elaboration. BMC Med. 2012 May 29; 10: 51. doi: 10.1186/1741-7015-10-51. PMID: 22642691; PMCID: PMC3362748.
Sauerbrei W, Taube SE, McShane LM, et al. Reporting Recommendations for Tumor Marker Prognostic Studies (REMARK): An Abridged Explanation and Elaboration. J Natl Cancer Inst. 2018 Aug 1; 110(8): 803-811. doi: 10.1093/jnci/djy088. PMID: 29873743; PMCID: PMC6093349.
Febbo PG, Ladanyi M, Aldape KD, et al. NCCN Task Force report: evaluating the clinical utility of tumor markers in oncology. J Natl Compr Canc Netw. 2011 Nov; 9 Suppl 5: S1-32; quiz S33. doi: 10.6004/jnccn.2011.0137. PMID: 22138009.
Hayes DF. Defining Clinical Utility of Tumor Biomarker Tests: A Clinician's Viewpoint. J Clin Oncol. 2021 Jan 20;39(3):238-248. doi: 10.1200/JCO.20.01572. Epub 2020 Dec 16. PMID: 33326253.
Hayes DF, Sauerbrei W, McShane LM. REMARK guidelines for tumour biomarker study reporting: a remarkable history. Br J Cancer. 2023 Feb; 128(3): 443-445. doi: 10.1038/s41416-022-02046-4. Epub 2022 Dec 7. PMID: 36476656; PMCID: PMC9938190.
牛爱军, 杜鲁涛, 靖旭, 等. 肿瘤标志物在不同检测系统间的应用现状及建议[J]. 临床检验杂志, 2021, 39(3): 161-164. DOI:10.13602/j.cnki.jcls.2021.03.01.




