CTC 2.0时代:循环肿瘤细胞分子分型创新应用与临床诊疗价值

胡志远,教授、研究员、博士研究生导师。现任国家纳米科学中心研究员,中国科学院大学教授、北京中科纳泰生物科技有限公司创始人、董事长。入选中科院“百人计划”、科技部“创新人才推进计划”和中组部“万人计划”科技创业领军人才。现担任中国CTC产业联盟理事长,中国抗癌协会CTC技术专家委员会组长。北京市第十五、十六届人大代表。已在《Nature》子刊等国际顶级学术刊物上发表SCI论文多篇,获得发明专利30余项,入选2018精准医疗行业十大风云人物。

朱政,理学博士,北京中科纳泰生物科技有限公司医学部。曾在复旦大学附属华山医院从事博士后研究工作,现主要从事液态活检技术临床应用转化工作。
当今社会,由于人口老龄化、生活方式和生存环境等多种因素的影响,癌症已成为全球公认的一种严重性疾病,它的发病率和死亡率逐年呈上升趋势。根据2020年中国国家癌症中心发布的数据,2020年全国新诊断癌症病例数为494.6万例,死亡癌症病例数为321.8万例,已严重威胁我国人民的生命健康。循环肿瘤细胞(Circulating tumor cells,CTC)是指已经从原发肿瘤中脱落并进入血液循环的癌细胞。尽管CTC数量很少,但其重要性在于,它们可以通过血液循环在全身范围内传播,从而在远处组织形成转移灶,这是肿瘤治疗中最具挑战性的问题之一。因此,针对CTC的研究对于预防和治疗癌症具有重要的意义。作为代表性的液体活检技术,CTC检测是一项简便、无创、高灵敏度的肿瘤检测手段,能提供大量重要的分子和病理学数据,帮助医生了解患者体内肿瘤的状态和进展情况,这对于制定个性化治疗方案、选择适当的药物和监测治疗反应至关重要。现在,CTC检测技术的研究也已经走向临床转化,而且其临床应用领域也逐渐由计数向外拓展,越来越多的临床研究已集中在CTC的分子表征上,基于CTC的分子靶标探索为进一步深入揭示肿瘤的生物学机制和转移机制提供基础理论依据,也为肿瘤临床治疗提供更精准的指导。
一、循环肿瘤细胞检测的发展
CTC是指存在于外周血中的各类肿瘤细胞的统称[1],其通过从原发或转移肿瘤组织脱落至血管中进入血循环,其中少数细胞能够克服自身及血液循环中各种因素的杀伤作用,存活并且能够顺利完成侵袭转移,导致疾病的进展。1869年,澳大利亚学者Ashworth[2]在一例转移性癌症患者的血液中首次观察到了CTC,认为患者体内的实体瘤会将一些肿瘤细胞释放到血液中,而血检中发现的肿瘤细胞与实体瘤细胞具有相同的生物学特性。随着CTC在多种上皮源性肿瘤中被检测到,包括乳腺癌[3-6]、前列腺癌[7-9]、肺癌[10-12]、结肠癌[13-15]等,CTC相关的研究已经成为肿瘤临床研究中的前沿和热点。由于CTC检测的非侵入性、实时性、可以反复取样以及可动态监测肿瘤进程等优势,引起了临床工作者的广泛关注,CTC检测已经通过美国食品药品管理局(Food and Drug Administration,FDA)的认证[16]。近些年,随着CTC研究深入和临床需求扩大,CTC已成为液体活检主要材料之一;CTC检测也已从先前的细胞计数逐渐朝着细胞计数结合分子分型的综合分析发展,对肿瘤患者的预后判断、疗效预测、疗效评价及复发转移和耐药分析都具有重要意义[17]。这也使得CTC检测成为当代“精准医疗”体系中具有代表性的诊断技术。
CTC检测主要由CTC富集分离和CTC鉴定两个技术环节构成。目前唯一在欧美及中国均获得药监局批准的CTC临床检测系统——CellSearch,其技术路径是基于美国强生公司率先应用的抗体磁珠阳性富集和免疫荧光鉴定方法,但是因存在灵敏度不足、操作步骤复杂等问题而局限了CellSearch系统其在临床上的应用。近年,一些新的CTC检测技术不断涌现,主要是新的CTC富集分离平台从技术路径进行了改良,比如基于CellSearch同样技术原理,中国自主创新的TUMORFISHER多肽纳米磁珠技术采用多肽取代了磁珠上的抗体,特殊的纳米表面提升了CTC捕获的灵敏性和稳定性,并且可以用于全血的直接富集,避免红细胞裂解和离心,操作简单快捷,获得中国抗癌协会《基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)》推荐[17]。
二、CTC 1.0:循环肿瘤细胞计数的临床应用价值
尽管早在19世纪,CTC就已经被发现,其存在的重要性也越来越受临床研究者们的关注,但直到21世纪初,CTC的临床价值才得到真正体现。Cristofanilli等人于2004年进行了第一项大型、多中心临床研究,评估CTC在晚期乳腺癌患者中的预后价值。研究结果显示,同<5个CTC的患者相比,在7.5ml预处理血液中发现≥5个CTC(CellSearch平台)的患者的无进展生存期(PFS)更短[18]。在同一年,CTC正式被美国FDA批准成为乳腺癌预后标记物。随后,多项临床试验陆续证明,在其他癌种如结直肠癌、前列腺癌和肺癌等,CTC在预测预后和监测治疗效果方面也有独特优势,CTC顺利进入AJCC和NCCN等国际临床权威指南。
随后,中国的研究团队也验证了基线及治疗后的CTC能够预测晚期乳腺癌患者的预后。2017年一项来自北大肿瘤医院的针对超百名转移性乳腺癌(MBC)患者的临床试验验证[19],中位随访时间为16.3个月(范围:9.0-31.0个月),基线时≤2个CTC/2ml血液的患者的PFS显著长于>2个CTC/2ml血液的患者(17.0个月对8.0个月;P=0.002)(图1-A);在基线和首次治疗评效时,均发现≤2个CTC/2ml血液的患者相对>2个CTC/2ml血液的患者,也拥有更长的PFS(图1-B)。该临床研究中采用了中国自主创新的CTC检测技术——TUMORFISHER多肽纳米磁珠技术。
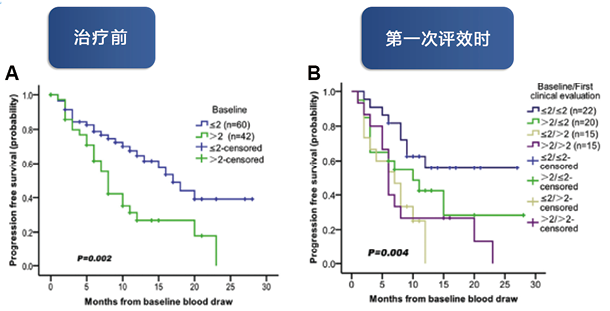
图1. 基线及治疗后CTC计数对晚期乳腺癌预后的预测作用
2022年,由原北京友谊医院王子函教授与国家纳米科学中心胡志远教授团队历时五年,通过使用TUMORFISHER多肽纳米磁珠技术检测CTC,经过长时间的随访评估,首次验证了术后CTC阳性的乳腺癌患者,及时改变治疗策略可提高CTC清除率和DFS,其研究成果已在《Frontiers in Oncology》上发表。该项临床研究表明[20],改变治疗策略的乳腺癌术后患者的1年、3年和5年DFS分别为96.6%、92.8%和69.0%,显著长于未改变治疗策略的患者(89.6%、56.9%和47.8%,p<0.01)(图2-A);CTC阳性和ER阳性或PR阳性患者,换内分泌治疗药物者1年、3年、5年DFS分别为94.1%、84.7%、60.5%,明显长于那些没有改变方案的患者(92.3%、63.3%和31.6%,p=0.02)(图2-B);CTC阳性、ER阴性和PR阴性患者中,增加使用卡培他滨者的1年、3年和5年DFS分别为100.0%、90.0%和90.0%,显著长于未改变治疗方案患者(94.1%、52.9%和47.1%,p=0.02)(图2-C);通过改变治疗方案,CTC阳性患者和CTC阴性患者之间的DFS就没有显著差异了(图2-D)。该项研究提示,临床根据CTC的结果,早期改变治疗方案可能会有效改善乳腺癌患者的预后。
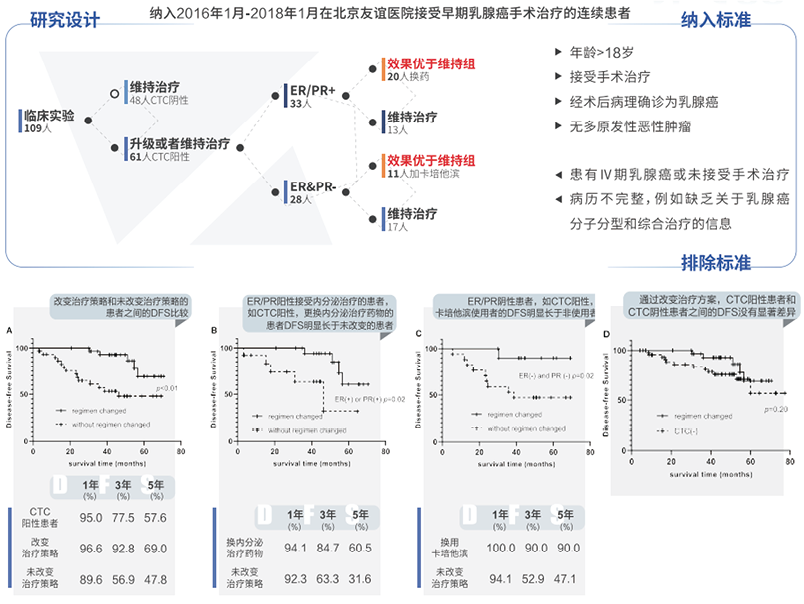
图2. 改变治疗方案对CTC阳性乳腺癌患者预后的影响
除了乳腺癌,2021年中华医学会《循环肿瘤细胞临床应用与实验室检测专家共识》明确说明CTC计数可用于乳腺癌、前列腺癌、结直肠癌、肝癌等实体肿瘤的疗效评价和预后评估。并特别指出,追踪手术前后或综合治疗过程中CTC的动态变化可为肿瘤疗效评价和预后评估提供实时监测信息,这也提示了CTC的计数从最早期的临床预后评估向疗效评价的应用拓展,甚至可以指导治疗策略的制定。另外,中国抗癌协会《基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)》指出CTC计数对早期和转移性乳腺癌均有良好的预后价值,其中早期乳腺癌CTC计数≥1个代表有微小残留病灶(MRD)的存在或提示较差的预后。由于MRD可能是导致局部复发或明显转移的主要原因[21],因此,CTC的监测对于乳腺癌患者术后转移复发的预防具有很高的临床应用价值。
三、 CTC 2.0:循环肿瘤细胞走向分子分型应用时代
由中华医学会发布的2021年《循环肿瘤细胞临床应用与实验室检测专家共识》,其中明确阐述了CTC分子分型可为全面评估肿瘤状态和肿瘤精准诊疗提供重要的实时信息;基于治疗靶标的CTC分型分析有助于提示药物疗效从而指导治疗决策,如ARV7(前列腺癌内分泌治疗)、HER-2/EGFR/KRAS(靶向用药)、PD-L1(免疫治疗)等。中国临床肿瘤学会(CSCO)推出的《乳腺癌诊疗指南》(2020版)就指出CTC HER-2在预测抗HER-2靶向治疗疗效中发挥重要作用。前列腺癌NCCN指南2021.v2版已明确推荐CTC ARV7检测用于辅助阿比特龙/恩杂鲁胺治疗方案的选择。
2022年,由中国人民解放军总医院第五医疗中心江泽飞教授团队和国家纳米科学中心胡志远教授团队合作的一项针对乳腺癌患者CTC上雌激素受体(Estrogen Receptor,ER)表达与内分泌治疗的预后相关性研究在《Frontiers in Oncology》上发表。该项临床研究[22]通过采用TUMORFISHER多肽纳米磁珠技术捕获CTC,并建立CTC荧光定量系统检测ER表达,结果显示,在接受内分泌治疗的BC患者中,相比较CTC ER阴性(CTC ER-)患者,CTC ER阳性(CTC-ER+)患者的无进展生存期(PFS)和总生存期(OS)更长(图3),表明乳腺癌患者CTC上ER检测可能为内分泌治疗提供有价值的预测作用。
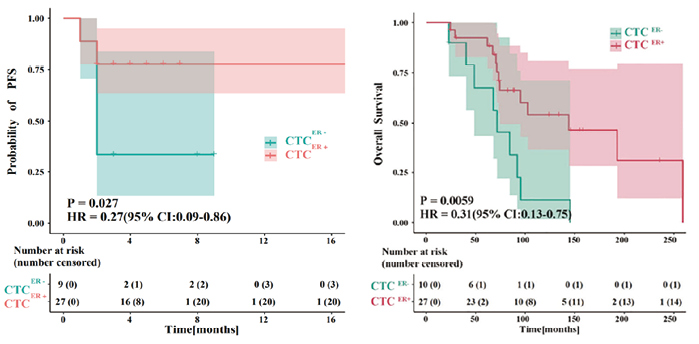
图3. 乳腺癌患者CTC上ER表达对内分泌治疗的预后影响
目前,尽管临床使用靶向PD-1/PD-L1的免疫检查点抑制剂(ICIs)的前景可观,但大多需要通过侵入性操作获取组织样本用于伴随诊断,且预测的准确性有限。过往一直不清楚PD-L1在CTC上的表达是否具有更精准的预测和预后价值,近年来多项临床研究逐渐证明CTC上PD-L1的检测有助于ICIs治疗的精准指导,并提供有价值的预测作用。近期,中国人民解放军总医院第五医疗中心王涛教授团队携手国家纳米科学中心胡志远教授团队,通过采用TUMORFISHER多肽纳米磁珠技术捕获CTC和建立免疫评分系统,证明了CTC PD-L1阳性表达在转移性乳腺癌(MBC)患者抗PD-1免疫治疗中是频繁和动态的;CTC PDL1阳性的比例分布结合所定义的临界值可能有助于预测免疫治疗的效果,如预测PFS和OS。所有这些观察结果提示PD-L1在CTC上的表达可能具有重要的应用价值,是筛选出最有可能受益于抗PD-1免疫治疗的MBC患者的重要工具。该研究成果入选了2022年圣安东尼奥乳腺癌研讨会(SABCS)壁报交流。
此外,来自北京大学肿瘤医院的沈琳教授、张小田教授和国家纳米科学中心胡志远教授课题组合作,不久前在分析化学领域顶级刊物《Analytical Chemistry》上发表了一项重要研究,通过采用TUMORFISHER多肽纳米磁珠技术,首次证明了在胃肠道肿瘤患者中,CLDN18.2 RNA阳性CTCs比率与免疫组化CLDN18.2表达水平一致[23],意味着未来基于CTC CLDN18.2的RNA检测有望成为评估CLDN18.2抑制剂在胃肠道肿瘤治疗中的有效手段。
四、循环肿瘤细胞检测在 PD-1/PD-L1抑制剂精准用药中的应用前景
2016年,意大利罗马第一大学某研究组在《Scientific Reports》发表文章,对参与Nivolumab治疗的24名IV期非小细胞肺癌(NSCLC)患者,在基线和开始治疗后3和6个月分别进行CTC和CTC上PD-L1表达情况的评估。研究发现[24],在治疗3个月时CTC及其PD-L1的表达与患者不良反应的结果相关;在治疗后6个月后,CTC上PD-L1表达阴性患者都获得好的治疗效果,而CTC上PD-L1表达阳性患者的疾病都进展了。这表明PD-L1阳性CTC的持久存在能够反映出免疫治疗的逃逸机制。
2018年,军事医学科学院附属医院(解放军307医院)消化道肿瘤科徐建明主任和国家纳米科学中心胡志远教授、杨延莲教授团队合作在肿瘤免疫领域权威期刊《Oncoimmunology》上发表文章,首次证明PD-L1阳性高表达的CTC比例可用于预测PD-1单药治疗效果。该项临床研究针对36名接受PD-1单抗IBI308(信达生物)治疗的晚期消化道肿瘤患者,采用TUMORFISHER多肽纳米磁珠捕获技术对患者用药前、后分别进行CTC富集和检测,其中35名都可以检测到1-70个(中位数为8)的CTC,并构建一套半定量免疫荧光方法用于PD-L1蛋白表达水平的评估。研究发现[25]:(1)在30例评效合格的患者中,有11例用药获益(DC),19例发生进展(PD);在11例获益患者中,73%的患者CTC数目减少,而在19例进展患者中,相应CTC数量升高的患者比例高达为89%。这表明CTC数目动态变化可用于PD-1疗效评估。(2)用药前检出PD-L1阳性高表达(PD-L1 high)CTC的21例患者中,48%对治疗发生响应(DC),而在无PD-L1 high CTC的14例患者中,响应比例只有14%。研究人员进一步统计了CTC PD-L1 high的比例,结果发现,PD-L1 high比例≥20%的患者响应率高达64%,而比例<20%的患者的响应率只有14%,即外周血中有PD-L1阳性高表达CTC的患者更容易从PD-1药物中获益,而且这类细胞比例越高,响应率越高。这表明用药前CTC PD-L1表达情况可预测PD-1药物疗效。(3)进一步观察,对于CTC PD-L1 high比例≥20%的患者,其中位无进展生存期为4.27个月,而比例<20%的患者仅为2.07个月(图4)。这表明PD-L1阳性高表达CTC比例高的患者在用药后有着更好的预后。该研究是国内首次验证CTC上PD-L1的表达对消化道肿瘤ICIs治疗疗效极具预测价值,这一预测性标记物的前瞻性研究结果应用令人期待。
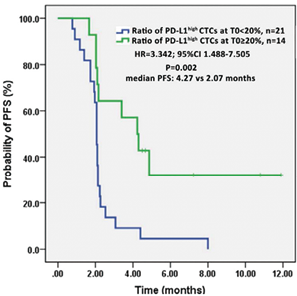
图4. CTC PD-L1阳性高表达水平对接受PD-1单抗治疗患者预后的影响
同期,解放军307医院徐建明主任团队的另一项针对国产PD-1免疫检查点抑制剂SHR-1210联合阿帕替尼治疗晚期肝癌、胃癌和胃食管交界处癌I期临床研究取得了突破性进展,其研究成果发表在著名肿瘤学术期刊《Clinical Cancer Research》上。该研究[26]中另一个重大的突破是采用外周血CTC PD-L1高表达水平作为疗效预测生物标志物。研究通过TUMORFISHER多肽纳米磁珠技术,捕获人体外周血中极其痕量的CTC,并定量分析PD-L1表达水平。41例患者在治疗前,39例(95.1%)血液中检测到CTC;35名可评估患者中29名(82.9%)患者有PD-L1阳性高表达的CTC。依据该团队之前研究确定的20%阈值[25],PD-L1阳性高表达CTC比例≥20%的患者用药后客观缓解率(ORR)接近48%,而比例<20%的患者用药后ORR为0%(意味阴性预测值NPV为100%)(图5-A)。此外,PD-L1高表达CTC比例≥20%的患者用药后PFS显著延长(P=0.0002),OS也更长(P=0.0601)(图5-B)。该研究再次表明了,PD-L1阳性高表达CTC与PD-1免疫检查点抑制剂的治疗疗效相关,基线时PD-L1阳性高表达CTC可以作为ICIs疗法中对可能受益的患者进行分层的生物标志物。
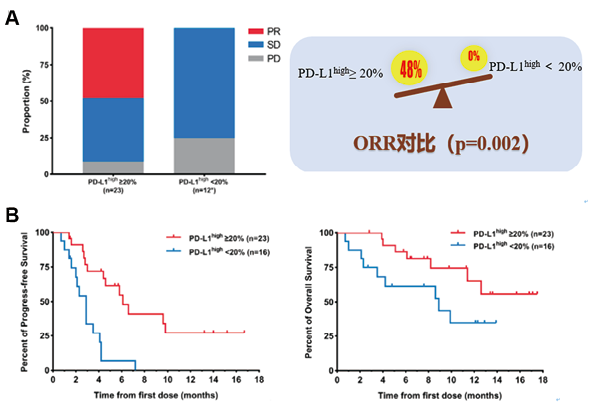
图5. PD-1单抗联合阿帕替尼治疗中CTC PD-L1阳性高表达水平对疗效的预测价值
此外,2021年,《The Oncologist》上发表了一篇针对155例接受PD-1/PD-L1免疫抑制剂治疗的消化道肿瘤患者CTC PD-L1表达水平的研究[27],结果又一次验证了CTC上PD-L1的阳性高表达水平能够独立影响肿瘤ICIs治疗的客观响应。治疗前具有PD-L1高表达水平CTC的患者对PD-1/PD-L1抑制剂表现出更高的ORR(相对非CTC PD-L1高表达水平患者,32.44%对13.64%,P=0.018)和DCR(75.68%对40.91%,P<0.0001),且拥有更长的PFS(P<0.0001)和OS(P=0.0235)(图6)。该研究同样采用了TUMORFISHER多肽纳米磁珠技术对患者的外周血CTC进行了精准捕获。
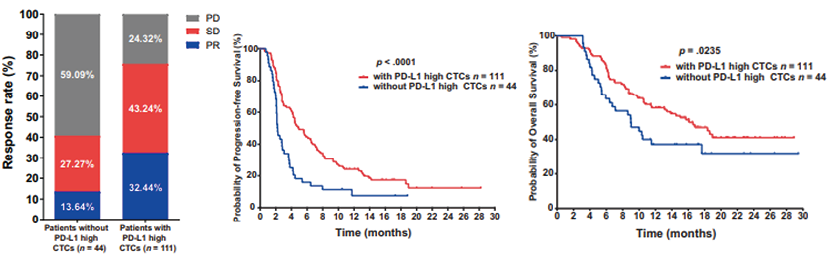
图6. CTC PD-L1的阳性高表达水平对消化道肿瘤ICIs治疗疗效的影响
上述这些研究结果都表明,CTC上的PD-L1表达水平可能是极具价值的潜在预测因子,帮助临床精准的选择ICIs治疗受益最大的消化道肿瘤患者,并通过CTC上PD-L1表达水平的动态变化,更好的评估和监测治疗效果。因此,针对消化道肿瘤ICIs治疗,聚焦开发基于CTC PD-L1检测的伴随诊断技术体系和IVD产品,可能会是CTC 2.0时代临床创新应用的一大闪光点。为此,国家纳米科学中心胡志远教授团队创新性的提出了CTC中关于PD-L1表达的相关参数(表1),其中临床相关性最高的参数是cTPS(Circulating tumor proportion score,循环肿瘤细胞PD-L1阳性比例分数),类似目前基于IHC伴随诊断的TPS概念(Tumor proportion score,肿瘤细胞PD-L1阳性比例分数),特指PD-L1阳性表达的CTC占总CTC的比例,进而定义了Δ cTPS,即基线时(T0)cTPS与首次免疫治疗后(T1)cTPS的差值。这些参数概念的提出有助于指导研发人员在未来CTC PD-L1伴随诊断体系建立过程中探索和定义临床关键性阈值。

五、结论
CTC作为液体活检的“明星分子”,它的临床应用一直被大家所关注。在临床上,CTC计数的意义已经非常明确,对于患者预后判断、疗效评价和个体化治疗都有着重要的指导作用。随着CTC富集和分离技术的不断改进和下游检测技术的发展,完整捕获的CTC因带有整套的膜蛋白表达信息和基因组序列,使其应用可以拓展到伴随诊断和肿瘤全流程诊疗过程中。2023年,由中国抗癌协会发布的《中国肿瘤整合诊治技术指南(CACA)-液体活检》是国际上首部系统阐述肿瘤液体活检技术在临床应用的指南,指南对近年CTC技术的临床应用创新做了具体介绍,例如,利用中国自主研发的TUMORFISHER纳米技术可以从血液中高灵敏度的获得CTC细胞,并可开展CTC上PD-L1的蛋白检测并定义cTPS指标和阈值,不仅可预测消化道癌和乳腺癌PD-1药物疗效,而且可以动态监测用药后的疗效[17]。CACA指南也指出通过CTC细胞上的PD-L1、HER2、AR-V7、CLDN18.2等蛋白检测来进行伴随诊断,判断药物是否适用于患者,可供临床参考。由此可见,以循环肿瘤细胞分子分型为代表的临床创新应用意味着CTC 2.0时代的到来,这将会为更多癌症患者带来生存希望,续写更多华丽的生命乐章。
参考文献
Wang X, Qiang S, Liu Q, et al. CTC immune escape mediated by PD-L1[J]. Med Hypotheses, 2016, 93: 138–139.
Ashworth TR. A case of cancer in which cells similar to those in tumors were seen in the blood after death[J]. Aust Med J, 1869, 14: 146-149.
Meunier A, Hernandez C, Javier A, et al. Combination of mechanical and molecular filtration for enhanced enrichment of circulating tumor cells[J]. Anal Chem, 2016, 88 (17): 8510-8517.
Aceto N, Bardia A, Miyamoto DT, et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis[J]. Cell, 2014, 158(5 ): 1110-1122.
Errico A. Breast cancer: CTCs-a predictive approach for targeted cancer therapy[J]. Nat Rev Clin Oncol, 2014, 11(1): 501.
Helissey C, Berger F, Cottu P, et al. Circulating tumor cell thresholds and survival scores in advanced metastatic breast cancer: the observational step of the CirCe01 phase Ⅲ trial[J]. Cancer Lett,2015, 360 (2): 213-218.
Goldkorn A, Ely B, Tangen CM, et al. Circulating tumor cell telomerase activity as a prognostic marker for overall survival in SWOG 0421: a phase Ⅲ metastatic castration resistant prostate cancer trial[J]. Int J Cancer, 2015, 136 (8):1856-1862.
Loh J, Jovanovic L, Lehman M, et al. Circulating tumor cell detection in high-risk non-metastatic prostate cancer[J]. J Cancer Res Clin Oncol, 2014, 140 (12): 2157-2162.
Thalgott M, Rack B, Eiber M, et al. Categorical versus continuous circulating tumor cell enumeration as early surrogate marker for therapy response and prognosis during docetaxel therapy in metastatic prostate cancer patients[J/OL]. BMC Cancer, 2015, 15: 458 [2016-09-10].
Nicolazzo C, Raimondi C, Mancini M, et al. Monitoring PD-L1 positive circulating tumor cells in non-small cell lung cancer patients treated with the PD-1 inhibitor Nivolumab[J/OL]. Sci Rep, 2016, 6:31726[2016-09-10]. doi: 10.1038/srep31726.
Hodgkinson CL, Morrow C J, Li YY, et al. Tumorigenicity and genetic profiling of circulating tumor cells in small-cell lung cancer[J]. Nat Med, 2014, 20(8):897-903. doi: 10.1038/nm.3600.
Myung JH, Roengvoraphoj M, Tam KA, et al. Effective capture of circulating tumor cells from a transgenic mouse lung cancer model using dendrimer surfaces immobilized with anti-EGFR[J]. Anal Chem, 2015, 87(19):10096-102. doi: 10.1021/acs.analchem.5b02766.
Welinder C, Jansson B, Lindell G, et al. Cytokeratin 20 improves the detection of circulating tumor cells in patients with colorectal cancer[J]. Cancer Lett, 2015, 358(1): 43-46.doi: 10.1016/j.canlet.2014.12.024.
Fabbri F, Carloni S, Zoli W, et al. Detection and recovery of circulating colon cancer cells using a dielectrophoresis-based device: KRAS mutation status in pure CTCs[J]. Cancer Lett, 2013, 335(1): 225-231. doi: 10.1016/j.canlet.2013.02.015.
Tsai WS, Chen JS, Shao HJ, et al. Circulating tumor cell count correlates with colorectal neoplasm progression and is a prognostic marker for distant metastasis in non-metastatic patients[J/OL]. Sci Rep, 2016, 6:24517. doi: 10.1038/srep24517.
Siravegna G, Marsoni S, Siena S, et al. Integrating liquid biopsies into the management of cancer[J]. Nat Rev Clin Oncol, 2017, 14:531–548.
樊代明, 邢金良, 宋现让, 等.《中国肿瘤整合诊治技术指南(CACA)-液体活检》[M]。天津:天津科学技术出版社, 2023: 060, 065, 102.
Cristofanilli M, Budd GT, Ellis MJ, et al.Circulating tumor cells, disease progression, and survival in metastatic breast cancer[J]. N Engl J Med, 2004, 351(8):781-791.
Liu XR, Shao B, Peng JX, et al. Identification of high independent prognostic value of nanotechnology based circulating tumor cell enumeration in first-line chemotherapy for metastatic breast cancer patients[J]. The Breast, 2017, 32: 119-125. doi: 10.1016/j.breast.2017.01.007.
Wang ZH, Xu W, Yang YL, et al. Impact of changing treatment strategy based on circulating tumor cells on postoperative survival of breast cancer[J]. Front Oncol, 2022, 12:1006909. doi: 10.3389/fonc.2022.1006909.
Tachtsidis A, McInnes LM, Jacobsen N, et al. Minimal residual disease in breast cancer: an overview of circulating and disseminated tumour cells [J]. Clin Exp metastasis, 2016, 33(6):521-550. doi: 10.1007/s10585-016-9796-8.
Zhou Y, Zhou JM, Xiao JY, et al. Prognostic Relevance of Estrogen Receptor Status in Circulating Tumor Cells in Breast Cancer Patients Treated With Endocrine Therapy[J]. Front Oncol, 2022, 12:866293. doi: 10.3389/fonc.2022.866293.
Fan LY, Chong XY, Zhao MZ, et al. Ultrasensitive Gastric Cancer Circulating Tumor Cellular CLDN18.2 RNA Detection based on a Molecular Beacon[J]. Anal. Chem. 2021, 93, 665−670. doi:10.1021/acs.analchem.0c04055.
Chiara N, Cristina R, Marialaura M, et al. Monitoring PD-L1 positive circulating tumor cells in non-small cell lung cancer patients treated with the PD-1 inhibitor Nivolumab. Sci Rep, 2016, 6: 317–326. doi: 10.1038/srep31726.
Yue CY, Jiang YB, Li P, et al. Dynamic change of PD-L1 expression on circulating tumor cells in advanced solid tumor patients undergoing PD-1 blockade therapy[J]. OncoImmunology, 2018, 7(7):e1438111. doi: 10.1080/2162402X.2018.1438111.
Xu JM, zhang Y, Jia R, et al. Anti-PD-1 Antibody SHR-1210 combined with Apatinib for Advanced Hepatocellular Carcinoma, Gastric or Esophagogastric Junction Cancer: An Open-label, Dose Escalation and Expansion Study [J]. Clin Cancer Res, 2019, 25(2):515-523. doi: 10.1158/1078-0432.CCR-18-2484.
Tan ZL, Yue C, Ji S, et al. Assessment of PD-L1 expression on Circulating Tumor Cells for Predicting Clinical Outcomes in Patients with Cancer Receiving PD-1/PD-L1 Blockade Therapies[J]. Oncologist, 2021, 26(12):e2227-e2238.doi: 10.1002/onco.13981.




