新血栓四项检测在急诊患者中的临床诊断价值

范志能,本科,主管技师。中国医学科学院阜外医院深圳医院检验科技术主管,深圳市医院协会检验医学分会常委,深圳市抗癌协会检验医学专业委员。专业方向:血栓与止血、心肌损伤标志物。
血栓是一种起病隐匿、发病突然、致死致残率较高的疾病,可见于几乎各临床科室,其病理过程涉及血管内皮、凝血和纤溶三大系统。研究已经证实机体处于血栓前状态时,血管内皮、凝血和纤溶系统已经发生改变,新型凝血分子标志物,包括凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、纤溶酶-α2抗纤溶酶复合物(α2-Plasmininhibitor-Plasmin Complex,PIC)、血栓调节蛋白(thrombomodulin,TM)和组织型纤溶酶原激活物-纤溶酶原激活抑制物-1复合物(tissue plasminogen activator-plasminogen activator inhibitor-1 complex,t-PAIC)是反应机体血管内皮、凝血和纤溶系统早期改变的有效指标,适用于各临床学科血栓高危人群血栓早期诊断、风险评估和治疗疗效评价及健康人群血栓风险筛查。应用于急诊主要有以下几个方面:
一、重症患者凝血功能障碍
根据《重症患者凝血功能障碍标准化评估中国专家共识》推荐使用新型凝血分子标志物判断重症患者凝血功能障碍的类型及预后(推荐强度A,证据等级Ⅲ)。
TM是血管内皮细胞表面的凝血酶受体,可结合凝血酶并抑制凝血酶的活性,同时促进蛋白C活化发挥抑制凝血因子Ⅴ、Ⅷ活性及纤溶酶原激活物抑制剂-1(plasminogen activator Inhibitor-1,PAI-1)。血浆TM正常值为3.8~13.3 TU/ml。血管内皮损害时,TM释放入血导致血浆TM水平明显升高,是血管内皮损伤的敏感指标。已有较多文献证实,肾功能损害患者TM水平可明显升高[1]。凝血酶活化后可与抗凝血酶结合形成TAT。TAT的血浆正常值<4ng/ml,TAT升高可反映凝血酶生成,灵敏度较高[2]。PIC是纤溶酶活化后与α2-抗纤溶酶结合形成的复合物,是直接反映纤溶系统激活程度的生物标志物。因为D二聚体及FDP是纤溶酶活化后降解纤维蛋白(原)后形成的物质,因此PIC升高理论上早于D二聚体及FDP,是目前监测纤溶酶活性最敏感的指标。PIC的血浆半衰期约6h,血浆正常值<0.8μg/ml。血浆PIC水平显著升高可提示纤溶亢进[3]。t-PAIC是血管内皮细胞损伤时,释放t-PA与PAI-1共同入血形成的复合物。t-PAIC的正常值根据性别有不同,男性血浆正常值<17.0ng/ml,女性<10.5ng/ml。理论上t-PAIC是内皮损伤及纤溶系统激活的产物,临床研究中发现t-PAIC对休克严重状态特别是脓毒症休克的诊断价值很高[4]。已有研究显示,脓毒性休克患者的t-PAIC水平显著高于脓毒症患者,t-PAIC水平与乳酸及序贯器官衰竭评分(Sequential Organ Failure Assessment,SOFA)评分均呈正相关。Winter等[5]研究发现,合并器官衰竭特别是心衰患者的t-PAIC水平明显高于无器官功能障碍的患者。
脓毒症时,内毒素导致内皮细胞损伤,促进凝血酶活化,此时可表现为TM及TAT升高,随着脓毒症演进为脓毒症休克,出现组织低灌注导致器官功能损害,此时t-PAIC可显著升高,而PIC因为纤溶抑制作用升高不明显[6]。创伤时,出血导致凝血酶大量活化发挥止血效应,可表现为TAT显著升高;内皮细胞释放大量活化蛋白C抑制PAI-1活性,引起纤溶亢进,表现为PIC显著升高。如创伤失血发展至休克阶段,出现广泛内皮损害,可表现为TM升高;如休克加重出现明显器官功能障碍,可出现t-PAIC显著升高[7]。脓毒症及创伤分别作为血栓型DIC及纤溶型DIC的典型代表疾病,也说明新型凝血分子标志物在区分DIC亚型方面的重要作用,特别在创伤失血型休克向脓毒症休克转化时有重要诊断价值[8]。新型凝血分子标志物在重症患者凝血功能障碍中的表现见表1。
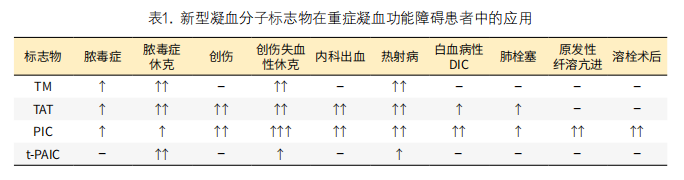
二、热射病
根据《中国热射病诊断与治疗专家共识》,直接热损伤和热相关肝功能异常均会导致凝血功能障碍,临床表现为皮肤瘀点、瘀斑及穿刺点出血、结膜出血、黑便、血便、咯血、血尿、颅内出血等。合并弥散性血管内凝血(disseminated intravascular coagulation,DIC)者约占45%,提示预后不良[9]。热射病合并凝血功能障碍时,在发病几小时内即可出现TM、t-PAIC、TAT和PIC等均升高的现象。TM和t-PAIC显著升高,提示血管内皮损伤;TAT升高提示促凝活动启动,PIC升高提示纤溶亢进。
热射病患者病情危重,实施实验室检查时应遵照重症患者管理的一般原则,以便于病情的动态评估。由于热射病常伴有多器官功能损伤,进行实验室检查时应尽可能全面,并动态观察各指标的变化。
共识推荐采用凝血分子标志物联合TEG等全血功能监测设备判断抗凝时机。如TAT、D-二聚体(DD)、纤维蛋白降解产物(FDP)和PIC显著升高,全血功能监测结果显示显著低凝,同时合并显著脏器功能损害的情况下,即可在启动目标导向替代治疗的同时启动抗凝治疗。抗凝过程中需动态监测凝血功能,评估抗凝效度和出血风险。如有活动性出血(如颅内出血、消化道大出血等),需在出血基本控制后再评估抗凝治疗时机[10]。
三、急性出血性凝血功能障碍
根据《急性出血性凝血功能障碍诊治专家共识》,急性出血性凝血功能障碍指血液凝结能力受到急性损害的病理生理状态。出血是其最常见的临床表现,也可仅表现为凝血指标异常而无出血。由于止血机制复杂,某些情况下可同时存在血栓形成。血小板减少症、口服抗凝药、脓毒症、急性中毒、肝功能损害、严重创伤等都可以造成急性出血性凝血功能障碍,上述疾病常见于急诊和重症监护室(ICU),常导致严重临床后果,需要临床医生及时做出正确诊断和实施适当的治疗。
专家意见4:对于临床情况复杂的患者,推荐使用新型血栓分子标志物做早期评估。新型血栓分子标志物:
1. TAT:体内凝血酶形成后,部分迅速与抗凝血酶(antithrombin,AT)结合形成TAT,该指标是反映凝血酶生成的分子标志物,可灵敏地反映凝血系统的激活程度,直接反映凝血系统启动[11-12]。凝血酶在血液中半衰期仅数秒,直接测定困难。TAT的血浆半衰期为3~15min,可以直接测定,TAT血浆正常值为4ng/ml提示凝血酶合成增多。TAT升高可早期预测血栓形成和复发风险、早期预测DIC风险。
2. PIC:是纤溶酶与抑制因子α2抗纤溶酶以1:1结合形成的复合物,是直接反映纤溶系统激活程度的生物标志物。PIC血浆半衰期约6h,可直接测定,血浆正常值为0.8μg/mL常提示纤溶系统激活。纤溶激活程度因DIC基础疾病不同而有所差异,且与DIC分型密切相关,可用于早期预测高凝状态,也可用于溶栓治疗监测[13]。
3. tPAIC:血管内皮细胞损伤时,tPAIC同时释放到血液中,tPAIC能够反映内皮细胞的损伤,是纤溶系统激活的分子标志物,男性血浆正常值<17.0ng/ml,女性<10.5ng/ml。tPAIC对DIC、动静脉血栓均有提示作用,是静脉血栓栓塞症(vein thromboembolism,VTE)及心梗的风险指标,此外该指标对DIC诊断具有重要价值,血浆水平升高提示DIC可能、血管内皮细胞损伤、血栓形成[13-15]。
4. TM:为内皮细胞表面的凝血酶受体,抑制凝血酶的活性,增强蛋白C活化性能,血浆TM正常值为3.8~13.3 TU/ml。当内皮细胞受损或功能障碍时,TM表达降低,部分TM被蛋白酶水解至血浆中[16-17]。因此,TM是内皮细胞受损的标志物。TM升高提示血管内皮损伤,可见于脓毒症、肾功能受损、急性肺损伤等。
四、脓毒症
根据《脓毒症并发弥散性血管内凝血诊治急诊专家共识》,弥散性血管内凝血(disseminated intravascular coagulation,DIC)不是独立的疾病,而是一种获得性凝血功能紊乱综合征,以全身凝血系统的止、凝血机制失衡与过度激活、纤溶系统严重紊乱,以及多个器官内微血栓形成等为特征,可发生广泛出血和多器官功能衰竭(multiple organ failure,MOF)而导致死亡[18]。
脓毒症并发DIC的发病机制包括促凝物质上调〔例如组织因子(tissue factor,TF)〕、抗凝物质下调〔例如AT、TM、组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)和蛋白C)〕,以及纤维蛋白溶解机制受损等,其中以促凝物质上调导致高凝状态最为重要[15, 19-20];除此之外,还与脓毒症本身的特征有关,如病原微生物侵入机体,内、外毒素的作用并由此激发了炎性介质的级联反应扩散,这些炎性介质作用于毛细血管内皮,使血管内皮生理性抗凝血物质减少或功能下降,血管内血细胞促凝血机制加强,纤溶系统受损,加剧了凝血过程[21]。微血管痉挛、缺血缺氧致使毛细血管通透性增加,血管中有形物质渗出,使得液体外漏,血流淤滞形成微血栓DIC。
参考文献
Katayama S, Nunomiya S, Koyama K, et al. Markers of acute kidney injury in patients with Sepsis: the role of soluble thrombomodulin[J]. Crit Care, 2017, 21(1): 229.
Nielsen JB, Nielsen AV, Carson RH, et al. Analysis of thrombin-antithrombin complex formation using microchip electrophoresis and mass spectrometry[J]. Electrophoresis, 2019, 40(21): 2853-2859.
Henriksson AE, Nilsson TK, Jansson U, et al. Experimental haemorrhage and blood component transfusion in humans: no change in plasma concentration of thrombin-antithrombin complex and plasmin-antiplasmin complex[J]. Thromb Res, 1996, 82(5): 409-415.
Niwano H, Takahashi H, Tatewaki W, et al. Behaviour of tissue plasminogen activator, plasminogen activator inhibitor 1 and their complex in various disease states[J]. Blood Coagul Fibrinolysis, 1992, 3(4): 389-393.
Winter MP, Kleber ME, Koller L, et al. Prognostic significance of tPA/PAI-1 complex in patients with heart failure and preserved ejection fraction[J]. Thromb Haemost, 2017, 117(3): 471-478.
Zeng QB, He LP, Zhang NQ, et al. Prediction of 90-day mortality among Sepsis patients based on a nomogram integrating diverse clinical indices[J]. Biomed Res Int, 2021, 2021: 1023513.
Hu YJ, Zhang YM, Song JC, et al. Clinical value of thrombin-antithrombin complex combined with α2-plasmin inhibitor-plasmin complex in the diagnosis of traumatic disseminated intravascular coagulation[J]. J Med Postgrad, 2020, 33(12):1283-1287.
Zhang J, Xue MM, Chen Y, et al. Identification of soluble thrombomodulin and tissue plasminogen activator-inhibitor complex as biomarkers for prognosis and early evaluation of septic shock and Sepsis-induced disseminated intravascular coagulation[J]. Ann Palliat Med, 2021, 10(10): 10170-10184.
DematteJE,O’Mara KJ BuescherJJ et a1.Near—fatal heat stroke during the 1995 heat wave in Chicago[J].Ann Intern MedJ 1998J 129(3):173- 181.
Mei H,Jiang x Luo L,et a1.evaluation the combined diagnostic value of TAT,PIC,tPAIC,and sTM in disseminated intravascular coagulation: A multi—center prospective observational study[J].Thromb ResJ 2019,173:20一26.
Pelzer H, Schwarz A, Heimburger N. Determination of human thrombin-antithrombin III complex in plasma with an enzyme-linked immunosorbent assay[J]. Thromb Haemost, 1988, 59(1): 101-106.
Mei H, Jiang Y, Luo L, et al. evaluation the combined diagnostic value of TAT, PIC, tPAIC, and sTM in disseminated intravascular coagulation: A multi-center prospective observational study[J]. Thromb Res, 2019, 173: 20-26. DOI: 10.1016/ j.thromres.2018.11.010.
IbaT, Thachil J.Clinical significance of measuring plasminogen activator inhibitor-1 in sepsis[J]. J Intensive Care, 2017, 5: 56. DOI: 10.1186/s40560-017-0250-z
Tipoe TL, Wu WKK, Chung L, et al. Plasminogen Activator Inhibitor 1 for Predicting Sepsis Severity and Mortality Outcomes: A Systematic Review and meta-Analysis[J]. Front Immunol, 2018, 9: 1218. DOI: 10.3389/fi mmu.2018.01218.
Iba T, Thachil J. Present and future of anticoagulant therapy using antithrombin and thrombomodulin for sepsis-associated disseminated intravascular coagulation: a perspective from Japan[J]. Int J Hematol, 2016, 103(3): 253-261. DOI: 10.1007/s12185-015-1904-z.
Fowler AA, 3rd, Truwit JD, Hite RD, et al. Effect of Vitamin C Infusion on Organ Failure and Biomarkers of Inflammation and Vascular Injury in Patients With Sepsis and Severe Acute Respiratory Failure: The CITRIS-ALI Randomized Clinical Trial[J]. JAMA, 2019, 322(13): 1261-1270. DOI: 10.1001/jama.2019.11825.
Ito T, Thachil J, Asakura H, et al. Thrombomodulin in disseminated intravascular coagulation and other critical conditions-a multi-faceted anticoagulant protein with therapeutic potential[J]. Crit Care, 2019, 23(1): 280. DOI: 10.1186/s13054-019-2552-0.
Wada H, Matsumoto T, Yamashita Y. Diagnosis and treatment of disseminated intravascular coagulation (DIC) according to four DIC guidelines [J]. J Intensive Care, 2014, 2 (1): 15. DOI: 10.1186/2052-0492-2-15.
Iba T, Yamada A, Hashiguchi N, et al. New therapeutic options for patients with sepsis and disseminated intravascular coagulation [J]. Pol Arch Med Wewn, 2014, 124 (6): 321-328.
Semeraro N, Ammollo CT, Semeraro F, et al. Coagulopathy of Acute Sepsis [J]. Semin Thromb Hemost, 2015, 41 (6): 650-658. DOI: 10.1055/s-0035-1556730.
Levi M, van der Poll T. Coagulation and sepsis [J]. Thromb Res, 2017, 149 : 38-44. DOI: 10.1016/j.thromres.2016.11.007.




