患者尿微量总蛋白异常偏低的原因分析

李阳,学士学位,现任职于绍兴文理学院附属医院检验科生化室,主要从事临床生化检验专业,对室内质控具有较深入研究。主持临床生化检验项目作业指导书的编写工作。
尿蛋白已作为肾脏功能损害的标志物,当血中的蛋白质出现在尿中,是由肾小管的重吸收功能障碍或肾小球滤过功能损伤引起。肾后性的蛋白尿是由感染、出血或恶性疾病导致。尿液蛋白质总量测定常用于泌尿系统疾病的过筛诊断、病情、病程、预后判断和疗效观察等。尿液中出现超过参考区间的蛋白,是肾脏受损的早期诊断指标。临床确诊的糖尿病患者应定期检查微量蛋白,以利于早期发现糖尿病并发症。当尿液中蛋白量超过300mg/L时,这说明已进入临床蛋白尿期,此时肾脏的损伤已不可逆转。
临床上除了健康体检时偶然可见,一般在临床实验室不易检到生理性蛋白尿,包括功能性蛋白尿、体位性蛋白尿和摄食性蛋白尿。功能性蛋白尿是一种暂时性良性蛋白尿,常见于剧烈运动、寒冷、情绪激动和发热等情况,这是由于肾血管痉挛或充血,肾小管通透性增加所致。一般24h尿液总蛋白含量不大于2g。体位性蛋白尿是一种与体位有密切关系的蛋白尿,患者清晨无蛋白尿,起床活动后出现蛋白尿,主要是脊柱前凸时,直接或通过肝脏压迫下腔静脉,使肾静脉淤血所致。大多体位性蛋白尿是良性的,但也应该注意观察是否存在肾脏疾病。摄取性蛋白尿是静脉输注蛋白制剂或进食过多蛋白时,尿中蛋白排出可增多。
病理性蛋白尿根据尿液中蛋白的来源区分为肾前性蛋白尿、肾小球性蛋白尿、肾小管性蛋白尿、混合型蛋白尿和肾后性蛋白尿等数种,出现在尿液中的蛋白质种类和量各有不同,但尿液总蛋白测定不能区分,必须配合其他特殊检查,例如尿液蛋白的SDS凝胶电泳等。
一、病例诊疗过程
患者女性,年龄43岁,尿微量总蛋白结果异常降低,低于了BA400仪器的检测限,如图1所示:
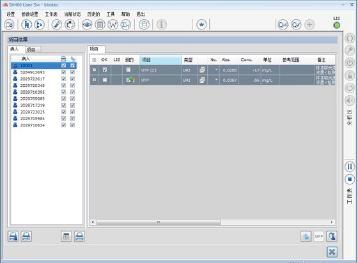
图1. 总蛋白低于检测限
患者尿微量总蛋白竟然低于0.1mg/L,这结果可信吗?笔者立即查找原因,查看当天质控并无失控,标本状态也无明显异常,重新混匀离心后结果仍不变,仪器最近无影响检测系统的维修记录,更换试剂后仍低于检测限,且同批标本均无此类异常现象,基本上可以排除仪器和试剂的影响。究竟是什么原因导致尿微量总蛋白如此低呢?
本院检验科的尿微量总蛋白方法学为邻苯三酚红钼酸法,蛋白质在酸性环境中与焦焙酚红和钼酸盐进行化学反应产生有色复合物被比色测定,在20μl样本和1ml试剂A(试剂A:焦焙酚红60umol/L,钼酸钠40umol/L,丁二酸盐50mmol/L,PH2.3,表面活性剂)37度孵育10分钟后,在600nm处测定吸光度的变化,颜色可稳定30分钟。
经查看该患者总蛋白的吸光度曲线,如图2所示,可以发现随着时间的变化,吸光度不但没有上升,反而有所下降。
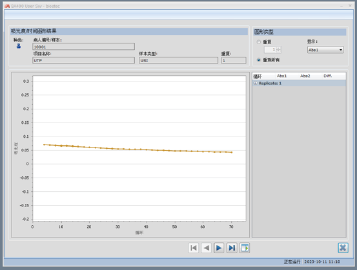
图2. 总蛋白吸光度
总蛋白低于检测限,首先考虑患者的总蛋白含量确实过少,但仪器中自动使用5倍样本量进行复查,此时吸光度曲线如图3所示,相较图2,吸光度随时间的下降不但没有减缓反而更加明显,据此基本排除总蛋白含量过少的影响。
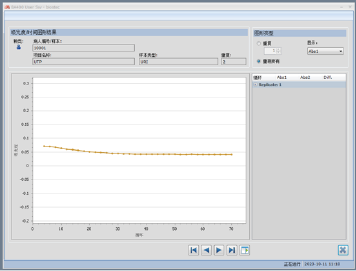
图3. 增加5倍样本量后总蛋白吸光度
这有没有可能是总蛋白含量太高引起的仪器误判呢?取样本经手工稀释十倍后,再次进行检测,吸光度曲线结果如图4所示,此时吸光度基本没有变化,但仍略有下降,据此基本排除总蛋白含量太高的影响。
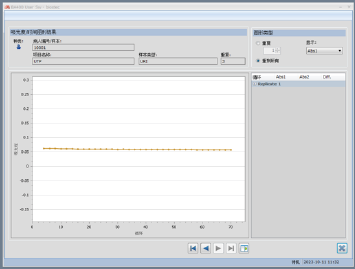
图4. 样本稀释10倍后总蛋白吸光度
为进一步验证吸光度降低的准确性,取5支离心管,按表1所示操作,结果显示第1支呈橙红色,第2支橙红色褪去,第3支相较第一支红一些,第4支则呈现紫色。加入患者的样本后试剂A颜色褪去,这与上述仪器检测到吸光度下降的现象基本相符。
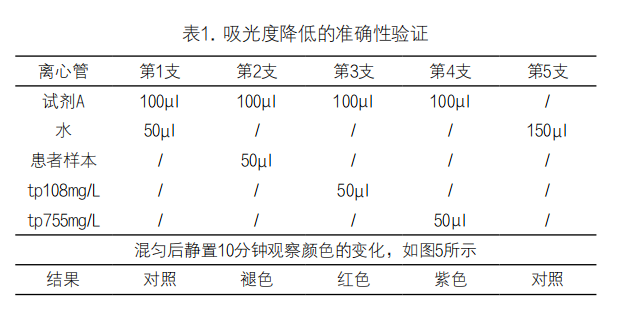

图5. 颜色比较
患者既不是总蛋白过低也不是总蛋白过高,这是其他什么因素在影响尿总蛋白的检测?带着疑惑笔者查看了该患者的电子病历,患者的基本情况:
患者女,年龄43岁,慢性病程,患者15年前妊娠期出现血糖升高,当时予胰岛素控制,产后血糖未监测,平时体检时测空腹血糖波动在10mmol/L左右,患者未重视,未进行治疗。近半年患者自觉身体较前消瘦,体重有所下降,今晨测空腹血糖10.3mmol/L,余无明显不适,现为进一步诊治,来我院就诊。检查患者尿常规尿白蛋白(干化学法)为10-29mg/L,白蛋白作为总蛋白的一部分,在有白蛋白存在的情况下总蛋白却无法检测到,这是检验科出错了吗?
再次取患者的样本,检测其尿微量蛋白五项,结果为β2微球蛋白0.16mg/L,α1微球蛋白2mg/L,免疫球蛋白g<0.1mg/L,转铁蛋白6.67mg/L,白蛋白7.7mg/L,进一步验证了患者尿蛋白的存在。
查看患者其他检验结果,如图6、图7、图8所示:
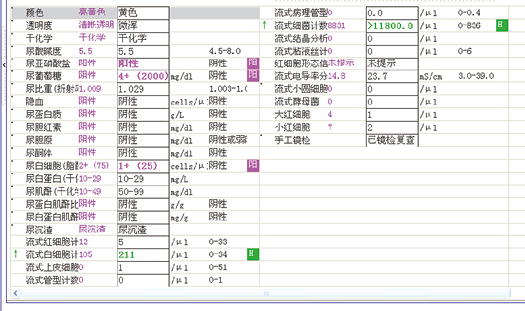
图6. 尿常规
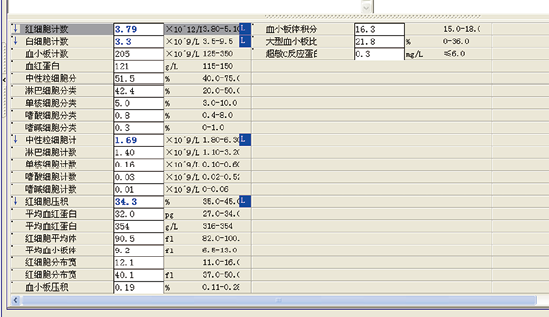
图7. 血常规
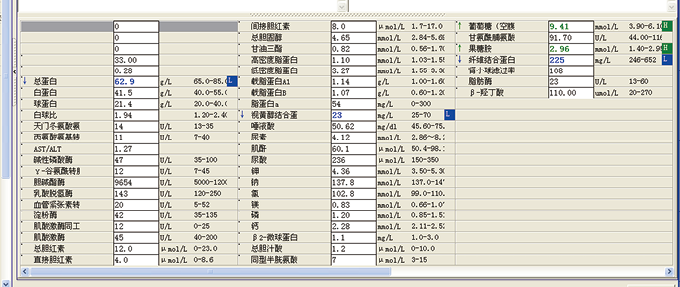
图8. 生化全套
检验结果显示,患者血糖尿糖较高,尿亚硝酸盐阳性,尿细菌较多,其他各项检查无明显异常。查患者用药记录,如图9所示,该患者仅有用氯化钠,葛根素,胰岛素,阿卡波糖,且均为糖尿病患者常用药物。
图9. 用药记录
二、查阅相关文献分析
 1. 大量文献表明邻苯三酚红对氧化剂非常敏感,被氧化后褪色,常作为氧化性的检测分子[1,2]。
1. 大量文献表明邻苯三酚红对氧化剂非常敏感,被氧化后褪色,常作为氧化性的检测分子[1,2]。
 2. 内源性活性氧物质(例如过氧自由基,过氧亚硝酸盐和次氯酸盐)的形成依赖于酶或由酶(微粒体脂质过氧化,髓过氧化物酶形成次氯酸盐)[3]。
2. 内源性活性氧物质(例如过氧自由基,过氧亚硝酸盐和次氯酸盐)的形成依赖于酶或由酶(微粒体脂质过氧化,髓过氧化物酶形成次氯酸盐)[3]。
 3. 在暴露于高葡萄糖的小鼠近端肾小管细胞中观察到胶原蛋白IV表达增加,线粒体功能障碍和ROS生成过多。多不饱和脂肪酸(PUFA)可以诱导包括原代人系膜细胞在内的各种细胞类型中的过氧亚硝酸盐生成[4]。
3. 在暴露于高葡萄糖的小鼠近端肾小管细胞中观察到胶原蛋白IV表达增加,线粒体功能障碍和ROS生成过多。多不饱和脂肪酸(PUFA)可以诱导包括原代人系膜细胞在内的各种细胞类型中的过氧亚硝酸盐生成[4]。
 4. 早期糖尿病中一氧化氮的过量产生和脂质过氧化的增加[5]。
4. 早期糖尿病中一氧化氮的过量产生和脂质过氧化的增加[5]。
 5. 邻苯三酚红(PGR)可被亚硝酸(HONO)在胃条件下漂白[6]。
5. 邻苯三酚红(PGR)可被亚硝酸(HONO)在胃条件下漂白[6]。
 6. 多种细菌如大肠杆菌可以产生亚硝酸盐。
6. 多种细菌如大肠杆菌可以产生亚硝酸盐。
因此,考虑邻苯三酚红的褪色主要原因1、活性氧2、亚硝酸盐。维生素C是人体内常见的还原剂,能清除活性氧同时也能还原亚硝酸盐。
经取60mg维生素C放于3ml水中,溶解混匀后取100μl溶液并加入900μl水(稀释10倍)和20μl溶液并加入980μl水(稀释50倍)。取6支离心管,按表2所示操作,结果显示第1支呈橙红色,第2支橙红色褪去,第3支则呈现蓝色,第4支相较第一支稍红一些,第5支则呈现蓝色,第6支橙红色褪去。加入维生素C后可以防止试剂A的褪色,这与维生素C清除活性氧以及还原亚硝酸盐的功能相符。
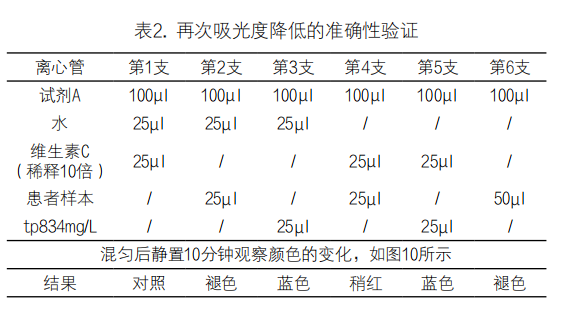
注:2小时后观察第3支离心管蓝色褪去,第5支离心管蓝色仍存在,5小时后第5支仍呈蓝色
图10. 颜色比较
再取两支离心管,均加入50μl患者标本并分别加入50μl维生素C(稀释50倍)和50μl维生素C(稀释10倍),再次使用BA400仪器检测总蛋白含量,如图11,图12,图13,图14所示,此时吸光度减少消失,基本保持不变,但总蛋白浓度仍低于检测限,在仪器内选择使用十倍样本量进行检测,如图15,图16所示,此时呈现正常的总蛋白吸光度曲线,且总蛋白浓度分别为16mg/L、15mg/L,由于患者标本与维生素C等比例混合,因此两次检测患者的总蛋白浓度为32mg/L、30mg/L。
图11. 样本+维生素C(稀释50倍)吸光度
图12. 样本+维生素C(稀释50倍)总蛋白浓度低于检测限
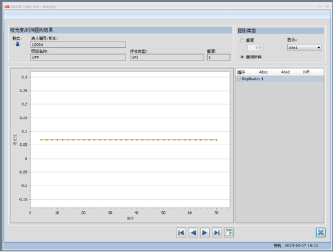
图13. 样本+维生素C(稀释10倍)
图14. 样本+维生素C(稀释10倍)总蛋白浓度低于检测限
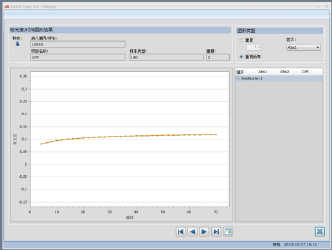
图15. 10倍样本量【样本+维生素C(稀释50倍)】吸光度
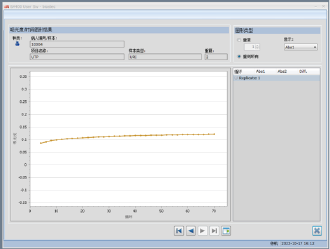
图16. 10倍样本量【样本+维生素C(稀释10倍)】吸光度
另外,取该患者标本100μl两份,分别与已知总蛋白浓度为852mg/L和已知总蛋白浓度为108mg/L的标本等比例混合,结果为该患者标本总蛋白浓度为852mg/L的标本混合后,浓度为444mg/L,而与108mg/L的标本混合后,浓度为23mg/L,这表明该干扰物质对高浓度的总蛋白影响较小,低浓度的总蛋白影响较大。
三、经验与注意的问题
 1. 样本与维生素C(稀释50倍)和维生素C(稀释10倍)等比例混合,两次结果基本一致,可大致认为维生素C对尿液总蛋白的影响较小,可忽略不计,但仍需对照验证。
1. 样本与维生素C(稀释50倍)和维生素C(稀释10倍)等比例混合,两次结果基本一致,可大致认为维生素C对尿液总蛋白的影响较小,可忽略不计,但仍需对照验证。
 2. 获取维生素C溶液的方法为溶解维生素C药片,主要成分是维生素C但可能有其他成分的干扰,使用纯的维生素C溶液会更有说服力。
2. 获取维生素C溶液的方法为溶解维生素C药片,主要成分是维生素C但可能有其他成分的干扰,使用纯的维生素C溶液会更有说服力。
 3. 尚未能区分患者标本内主要是活性氧还是亚硝酸盐在干扰检测。(1)使用不同浓度的亚硝酸盐和活性氧滴定试剂A,观察褪色情况。(2)定量检测该患者的亚硝酸盐和活性氧,分别对不同已知浓度的标本,加入等同于患者标本定量检测到的亚硝酸盐或活性氧,再次使用BA400仪器进行检测,观察总蛋白结果。
3. 尚未能区分患者标本内主要是活性氧还是亚硝酸盐在干扰检测。(1)使用不同浓度的亚硝酸盐和活性氧滴定试剂A,观察褪色情况。(2)定量检测该患者的亚硝酸盐和活性氧,分别对不同已知浓度的标本,加入等同于患者标本定量检测到的亚硝酸盐或活性氧,再次使用BA400仪器进行检测,观察总蛋白结果。
 4. 结论:该患者在本身总蛋白含量较低的情况下,又有干扰物质的存在,以至于出现总蛋白含量检测不到的情况。
4. 结论:该患者在本身总蛋白含量较低的情况下,又有干扰物质的存在,以至于出现总蛋白含量检测不到的情况。
参考文献
Balavoine GG, Geletii YV. Peroxynitrite scavenging by different antioxidants. Part I: convenient assay. Nitric Oxide. 1999; 3(1): 40-54. doi: 10.1006/niox.1999.0206. PMID: 10355895.
Geletiĭ IuV, Balavoine GG, Efimov ON, et al. Opredelenie summarnoĭ kontsentratsii i aktivnosti antioksidantov v pishchevykh produktakh [The determination of total concentration and activity of antioxidants in foodstuffs]. Bioorg Khim. 2002 Nov-Dec; 28(6): 551-66. Russian. doi: 10.1023/a:1021249717025. PMID: 12528467.
Robaszkiewicz A, Bartosz G. Estimation of antioxidant capacity against pathophysiologically relevant oxidants using Pyrogallol Red. Biochem Biophys Res Commun. 2009 Dec 18; 390(3): 659-61. doi: 10.1016/j.bbrc.2009.10.023. Epub 2009 Oct 13. PMID: 19833093.
Zhang HM, Dang H, Kamat A, et al. Geldanamycin derivative ameliorates high fat diet-induced renal failure in diabetes. PLoS One. 2012; 7(3): e32746. doi: 10.1371/journal.pone.0032746. Epub 2012 Mar 6. PMID: 22412919; PMCID: PMC3295767.
Hoeldtke RD. Nitrosative stress in early Type 1 diabetes. David H. P. Streeten Memorial Lecture. Clin Auton Res. 2003 Dec; 13(6): 406-21. doi: 10.1007/s10286-003-0139-x. Retraction in: Kaufmann H, Mathias CJ. Clin Auton Res. 2007 Jun; 17(3): 197. PMID: 14673690.
Hugo E, Reyes J, Montupil E, et al. Kinetics of the Reaction of Pyrogallol Red, a Polyphenolic Dye, with Nitrous Acid: Role of NO and NO2. Molecules. 2015 Jun 8; 20(6): 10582-93. doi: 10.3390/molecules200610582. PMID: 26060920; PMCID: PMC6272421.




