生殖激素和免疫抗体检测
生育力泛指个体或群体生育子代的能力,是种群延续、物种进化的基础,也是人类繁衍、社会发展的保证[1]。女性生育力是指女性产生卵母细胞、卵细胞并孕育胎儿的能力[2],男性生育力则指育龄男性能够使其配偶自然妊娠的能力或概率[3]。良好的生育力是顺利完成妊娠的保障,不孕不育则是一种低生育力状态,目前约12.6%~17.5%[4]的育龄夫妻受到不孕不育症的困扰。
世界卫生组织将一年以上未采取任何避孕措施,性生活正常而没有成功妊娠的人群定义为患有不孕不育症的人群。不孕不育的病因非常复杂,包括生殖系统器质性病变、性激素分泌紊乱、免疫功能异常等。免疫因素所致的不孕不育,临床表现不具明显特征,常靠实验诊断明确病因,检测血清、宫颈粘液中的与生殖有关的自身抗体,如抗精子抗体、抗子宫内膜抗体、抗卵巢抗体、抗心磷脂抗体等,是常用的诊断免疫性不孕的手段。
一、生育力评估
女性生育力的评估[5]涉及卵巢储备功能、子宫内膜容受性、全身因素等的评价,卵巢储备功能是最重要的影响因素。精液参数则通常作为男性生育力评估的替代指标[3]。
1. 抗缪勒氏管激素(AMH):抗缪勒氏管激素是转化生长因子-β超家族成员之一,因其能引起缪勒氏管退化,又称缪勒氏管抑制素(MIS)[6]。在男性中,AMH主要由睾丸的支持细胞分泌,诱导缪勒氏管退化;而在女性中则主要由卵巢的颗粒细胞分泌,调控卵泡生成。有研究[7]发现,25岁之后的女性血清AMH水平随着年龄的增长随之显著降低,绝经后检测不出。2010年ESHRE提出将提示卵巢储备功能减退的AMH截断值水平定义在0.5~1.1µg/L,2016年波塞冬标准将AMH<1.2µg/L作为卵巢反应不良的预测指标之一,这表明AMH是预测绝经年龄与评价卵巢储备的重要指标(图1)。
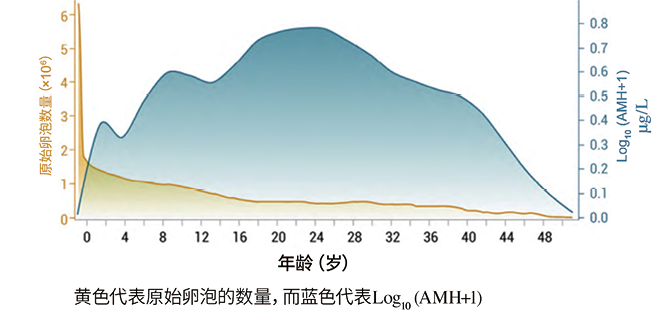
图1. AMH水平的动态变化和闭锁卵泡数量随年龄的变化
AMH不仅可用于生育力评估,也可指导病理诊断。AMH在PCOS诊断、分型、预后、治疗等方面均有重要价值。AMH也是卵巢颗粒细胞瘤(GCT)的标志物之一,与抑制素B联合检测灵敏度和特异性显著提高。同时与其他指标结合还可进行青春期性腺发育异常的鉴别和诊断。
2. 抑制素(inhibin):抑制素是下丘脑-垂体-性腺轴调控系统的重要激素,是一种多肽糖蛋白二聚体,属于转化生长因子β超家族中的一员[8]。抑制素由抑制素α亚基通过二硫键分别与βA亚基和βB亚基连接而成,α和βA亚基结合构成抑制素A,α与βB亚基结合构成抑制素B。抑制素是垂体-性腺轴负反馈回路的一部分(见图2),可调节促卵泡激素(FSH)的合成以及卵巢卵泡和类固醇生成。
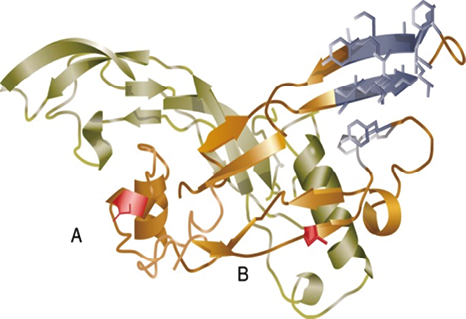
图2. 抑制素结构示意图[9]
(1)抑制素A(InhA):妊娠期间,母体血清、羊水及胎儿循环中的抑制素A主要是由胎盘合体滋养细胞合成并分泌[10],参与女性生殖生理的内分泌调节,与子宫内膜蜕膜化、胚胎植入、滋养细胞增殖分化有关[11],影响妊娠的发生、发展、维持以及胎盘和胎儿的生长发育等。抑制素A在男性体内浓度很低、不易被检出,且无生物活性(见图3)。
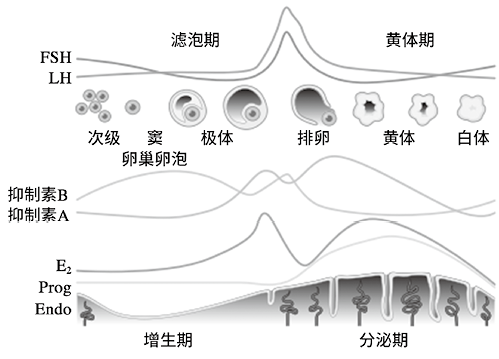
图3. 月经周期内抑制素的变化[12]
在正常妊娠中,抑制素A的来源先是黄体,5周后转为胎盘,且从4-10周开始增加,15-20周较为稳定,然后再次升高,分娩后迅速下降[10]。但是妊娠期间的抑制素A的过度释放是胎盘对外界不良环境的适应性反应,与多种妊娠相关疾病有关。已有研究[13]发现,母体高水平的血清抑制素A是子痫前期、妊娠期高血压、妊娠期糖尿病、巨大儿、出生低体质量儿和早产儿的独立危险因素。
(2)抑制素B(InhB):抑制素B在女性体内由卵巢颗粒细胞分泌,随着月经周期的变化而变化。有研究[14]发现,月经第三天进行外源性FSH卵巢储备试验后,卵巢反应不良患者的InhB显著降低。因此卵巢窦卵泡颗粒细胞分泌的InhB可作为卵巢储备功能的直接指标,反映女性的生育能力。InhB水平降低在多囊卵巢综合征、早发性卵巢功能不全等疾病中也有重要的临床诊断意义。
抑制素B在男性体内则由睾丸支持细胞分泌,男性体内InhB则与精子发生息息相关,InhB与睾丸大小呈正相关,且其水平反映了生殖细胞的数量,因此InhB是睾丸生精功能的重要评价指标[15]。精索静脉曲张、无精症、隐睾症等多种男性生殖疾病中可观察到InhB水平的变化,可作为男性不育原因分析的指标之一[16]。

图4.《男性不育诊疗指南》建议InhB可用于睾丸生精功能的评估
二、生殖免疫抗体
生殖免疫抗体可从精子活性、精卵结合、胚胎着床、胚胎发育等多个途径干扰生殖过程,是引起免疫性不孕的重要因素。
1. 抗精子抗体(ASAb):抗精子抗体是引起不孕不育常见的免疫性原因之一,在男女双方体内都可能产生。在男性中,血液睾丸屏障的发育异常或屏障的创伤可能导致男性体内产生抗精子抗体[17]。对女性而言,在生殖道感染或黏膜损伤时,精子会刺激机体免疫,从而产生抗精子抗体;也有女性对精子过敏从而产生抗精子抗体。抗精子抗体主要从精子输送、受精以及影响受精卵[18]三个方面对生殖过程造成影响,从而导致不孕不育(图5)。
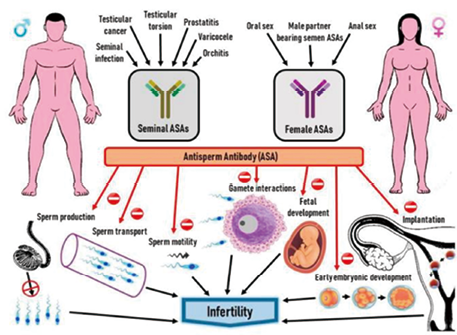
图5. 抗精子抗体的产生机制以及影响[19]
有研究表明,抗精子抗体阳性的患者在不孕不育患者中约占20%[20]~30%[21],且不受年龄影响,在生育的主要年龄段均可引起不孕。此外在继发性不孕和原发性不孕患者中也无显著差异,对两种不孕类型均有影响。
2. 抗子宫内膜抗体(EMAb):子宫内膜是胚胎着床和生长发育之地,正常情况下子宫内膜对机体无抗原性,但在机体免疫环境失调、子宫内膜异位症患者受到异位内膜的刺激、经血倒流等因素导致免疫应答紊乱或人工流产刮宫时损伤和炎症时,机体受到刺激产生抗子宫内膜抗体。抗子宫内膜抗体已被认为是子宫内膜异位症的特异性标志物,约70%~80%[22]的子宫异位症患者血清中可检出EMAb,使用EMAb诊断子宫内膜异位症敏感度86.6%,特异度64.0%[23]。
抗子宫内膜抗体主要通过抑制排卵、干扰精子和卵子的运送、阻碍精卵结合等导致不孕。此外,抗子宫内膜抗体还可造成子宫内膜发育不良,从而不利于受精卵着床和胚胎的发育,导致不孕[22]。
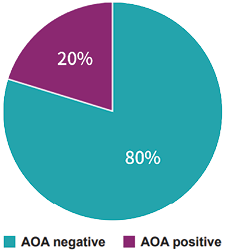
图6. 早发性卵巢功能不全患者中抗卵巢抗体阳
3. 抗卵巢抗体(AOAb):卵巢中卵泡的发育、成熟、排卵及分泌雌孕激素是一个复杂的生理过程,正常妇女体内会存在一定数量的抗卵巢抗体,不过是非致病性的。当机体受到创伤或者感染时,卵巢释放卵巢抗原,引起卵巢局部的抗原抗体反应刺激机体产生大量抗卵巢抗体。卵母细胞的细胞质、透明带、颗粒细胞、促性腺激素及其受体以及3β-羟基类固醇脱氢酶[24]是抗卵巢抗体几个公认的靶点。抗卵巢抗体作用于相应的靶细胞,引起卵巢局部过度的免疫应答,产生体液及细胞的免疫反应,导致卵巢病理性甚至不可逆的损伤,甚至卵巢早衰,引起不孕或流产。抗卵巢抗体还可包裹在卵细胞周围,阻止精卵结合;或者产生细胞毒作用,破坏卵细胞,防止受精;还可导致卵泡发育异常[25]。
抗卵巢抗体还是自身免疫性卵巢疾病的独立标志物,自身免疫性卵巢炎表现为多种免疫细胞浸润,包括B细胞、T细胞、巨噬细胞以及NK细胞,提示其发病机制与复杂的免疫过程相关[27],自身免疫性卵巢疾病同样会对生殖造成影响。
4. 抗心磷脂抗体(ACAb):抗磷脂抗体是一系列以负电荷磷脂为靶抗原的自身抗体,而抗心磷脂抗体是其中最有辨识度,与临床问题关系最密切的抗磷脂抗体之一。心磷脂是一种带负电荷的复合磷脂,当心磷脂从细胞膜质双分子层的内层暴露时,就会刺激机体产生抗心磷脂抗体,引起一系列免疫应答反应,造成机体损伤[28]。

三、抗磷脂抗体导致病理妊娠[29]
抗心磷脂抗体可与精子表面或滋养细胞表面的心磷脂结合,干扰受精过程和胚胎着床;还可与子宫内膜发生免疫炎症反应,使受精卵发育不良[22];抗心磷脂抗体还可作用于血管内皮细胞和血小板膜上的心磷脂,损伤血管内皮,造成血栓,导致不良妊娠结局[30]。最近有研究[31]表明,不孕症及反复流产患者的抗心磷脂抗体阳性率分别为56.45%和51.61%,且IgG、IgM对生育能力影响较大,IgA对反复流产影响较大。
低生育力状态严重影响生殖健康,临床上选择合适的项目对患者做全面的评估,为患者的生育策略提供有力的参考和依据。免疫性不孕目前仍是排除性诊断,全套筛查能更准确找出问题所在,对症治疗。
从生育力评估到不孕不育筛查再到胚胎发育情况监测,沃文特提供独家全面的评估项目,全程呵护生殖健康。沃文特的化学免疫分析系统拥有高准确度、高灵敏度、完善的参考区间等优势,同时可灵活组合所需项目,方便、快捷、准确,为临床诊疗提供有力的参考依据。展望未来,沃文特也将继续不断创新,为国家生育政策尽自己的一份力。
参考文献
周灿权, 黄孙兴. 重视女性生育力的保护与保存[J]. 中国实用妇科与产科杂志, 2022, 38(6): 3.
中华医学会计划生育学分会, 中国优生优育协会生育健康与出生缺陷防控专委会. 早期妊娠手术流产围术期女性生育力保护中国专家共识(2023年版)[J]. 中国实用妇科与产科杂志, 2023.
谷翊群. 男性生育力与精液参数的变化趋势[J]. 中华男科学杂志, 2014, 20(12): 4.
Njagi P, Groot W, Arsenijevic J, et al. Financial costs of assisted reproductive technology for patients in low- and middle-income countries: a systematic review[J/OL]. Human Reproduction Open, 2023, 2023(2).
侯振, 刘嘉茵. 女性生育力评估及其影响因素的评价[J]. 实用妇产科杂志 2021年37卷10期 726-729页 ISTIC PKU CSCD CA, 2022.
中国医师协会生殖医学专业委员会. 抗米勒管激素临床应用专家共识 (2023 年版)[J/OL]. 中国实用妇科与产科杂志, 2023, 39(4).
Rosen M P, Johnstone E, McCulloch C E, et al. A characterization of the relationship of ovarian reserve markers with age[J/OL]. Fertility and Sterility, 2012, 97(1): 238-243.
张丽娟, 屈新中. 抑制素与妊娠[J]. 中国妇幼健康研究, 2005(5): 292-295.
Makanji Y, Zhu J, Mishra R, et al. Inhibin at 90: From discovery to clinical application, a historical review[M/OL]//Endocrine Reviews. Endocrine Society, 2014: 747-794.
宋绮颖, 沈宗姬. 抑制素A和激活素A与妊娠[J]. 国际妇产科学杂志, 2011, 38(2): 5.
Yue C Y, Zhang C Y, Ni Y H, et al. Are serum levels of inhibin A in second trimester predictors of adverse pregnancy outcome?[J/OL]. PLoS ONE, 2020, 15(5).
Larryjameson J, Jameson, 胡仁明, et al. 哈里森内分泌学[M]//科学出版社. 2018.
陆子贇, 岳朝艳, 应春妹. 妊娠中期血清抑制素A在预测妊娠并发症或不良结局中的作用[J]. 国际检验医学杂志, 2022(010): 043.
Dzik A, Lambert-Messerlian G, Mario Izzo V, et al. Inhibin B response to EFORT is associated with the outcome of oocyte retrieval in the subsequent in vitro fertilization cycle[R]. 2000.
Pierik F H, Burdorf A, De Jong F H, et al. Inhibin B: A novel marker of spermatogenesis[M/OL]//Annals of Medicine. 2003: 12-20.
FRANK H. PIERIK, JAN T. M. VREEBURG, THEO STIJNEN, et al. Serum Inhibin B as a Marker of Spermatogenesis[R]//Internal Medicine III (F. Journal of Clinical Endocrinology and metabolism. 1998.
Shibahara H, Shiraishi Y, Suzuki M. Diagnosis and treatment of immunologically infertile males with antisperm antibodies[R]//Reproductive Medicine and Biology: Vol. 4. 2005.
丛羽. 不孕不育妇女7项自身免疫抗体的检测研究[J]. 长春中医药大学学报, 2007, 23(5): 2.
Vickram A S, Dhama K, Chakraborty S, et al. Role of antisperm antibodies in infertility, pregnancy, and potential for contraceptive and antifertility vaccine designs: Research progress and pioneering vision[M/OL]//Vaccines. MDPI AG, 2019.
马玉兰, 王芬, 陈红霞. 不孕不育妇女289例血清生殖免疫抗体检测的分析[J]. 中华临床医师杂志(电子版), 2011(09): 2748-2750.
山书玲, 周建华, 周平. 生殖免疫抗体检测在女性不孕不育诊断中的临床意义[J]. 中国计划生育学杂志 2009年17卷1期 48-49页 ISTIC, 2009.
蔡智慧, 冯丽, 高新萍, et al. 生殖免疫性抗体产生及导致不孕机制相关研究进展[J]. 医学研究与教育, 2012, 29(6): 5.
何宏月, 任小苗, 呼红英, et al. 血清ENA-78,EMAb水平与子宫内膜异位症患者病变特征的相关性[J]. 疑难病杂志, 2021, 20(7): 5.
Kirshenbaum M, Orvieto R. Premature ovarian insufficiency (POI) and autoimmunity-an update appraisal[M/OL]//Journal of Assisted Reproduction and Genetics. Springer, 2019: 2207-2215.
抗卵巢抗体导致不孕相关性研究进展[C]//第4次贵州省中西医结合妇产科学术年会第4次贵州省中医药学会妇科专业学术年会. 2019.
Pogačnik R K, Meden-Vrtovec H, Vizjak A, et al. Possible Role of Autoimmunity in Patients with Premature Ovarian Insufficiency Article in International Journal of Fertility and Sterility · Possible Role of Autoimmunity in Patients with Premature Ovarian Insuf f iciency[R/OL]. (2014).
梁伟莹, 杨燕宁, 谢梅青. 早发性卵巢功能不全的免疫因素分析[J]. 中国实用妇科与产科杂志, 2023, 39(9).
吴琪, 陈丹青. 抗心磷脂抗体与不良妊娠结局的关系研究进展[J]. 国际妇产科学杂志, 2017, 44(6): 4.
中国医师协会风湿免疫科医师分会自身抗体检测专业委员会, 国家风湿病数据中心, 国家免疫疾病临床医学研究中心. 抗磷脂抗体检测的临床应用专家共识[J/OL]. 中华内科杂志, 2019, 58(7).
Shetty S, Ghosh K. Anti-phospholipid antibodies and other immunological causes of recurrent foetal loss - A review of literature of various therapeutic protocols[M/OL]//American Journal of Reproductive Immunology. 2009: 9-24.
李耀伟. 抗心磷脂抗体检查在不孕症和反复性流产诊断中的应用价值[J]. 临床医学, 2023, 43(5).




