恶性肿瘤的自身免疫反应与 抗体检测的临床诊疗意义

刘丽丹,德国维尔兹堡大学博士,胡曼智造联合创始人兼CTO。多重流式检测领域资深科学家,完成了第一代多重流式荧光编码微球的应用开发,采用纳米磁性材料通过溶胀结合荧光染料的技术方案,打破国外技术壁垒,第二代基于量子点编码的微球已进入研发阶段。曾主导开发400余种原料及近千种试剂,建立了完善的试剂与原料开发平台及流程。曾任国内知名流式企业CTO,带领团队突破现有技术壁垒,运用多重检测技术,开发近千种新产品。以第一作者在Nature杂志发表论文(IF:42.778)。
【摘要】特异性抗肿瘤免疫反应在实体瘤的肿瘤发生和发展中起着关键作用,这些反应也可能具有自身免疫性质,甚至有时在疾病发作之前就存在自身抗体。自身抗体的产生是由于基因产物突变、蛋白质异常表达和转录后修饰、促免疫环境、抗癌治疗、肿瘤特异性淋巴细胞的交叉反应、表位扩散、微生物群和遗传因素等。实体瘤中的自身抗体可作为癌症的早期检测以及预后和治疗反应的生物标志物。
免疫抑制个体和免疫功能低下的重度联合免疫缺陷(SCID)小鼠患癌症的风险升高,这证实了免疫反应在癌症中的重要性。自身免疫反应产生的自身抗体(aAb)在一定情况下具有促进肿瘤发生和发展的作用;而在某些肿瘤(如黑色素瘤)中,aAb则发出有效的抗肿瘤反应信号,并与更好的疾病结果相关。自身抗体在明显的癌症发作之前就已经存在。在某些情况下,癌症早期可能会出现副肿瘤综合征形式的自身免疫表现。如果这些自身免疫反应能够被快速检测到,可用于癌症早期诊断,以挽救患者生命。最近的研究也提出了癌症自身抗体谱可用作诊断和区分转移性和非转移性疾病生物标志物的可能性。
一、肿瘤学中自身免疫反应的起源
癌症自身免疫反应是多因素诱发的,包括宿主遗传因素、宿主炎症环境、肿瘤相关抗原(TAA)的性质以及癌症治疗干预的影响等综合因素(见图1)。
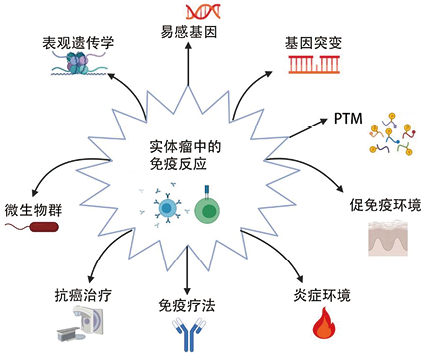
图1. 癌症自身免疫反应诱发因素
1. 共同的遗传因素:实体瘤和自身免疫性疾病都涉及遗传因素, 自身免疫和癌症之间的共同遗传成分可能是功能缺失和功能获得基因突变以及单核苷酸多态性(SNPs)。
TP53是一种典型的促凋亡基因,在某些形式的癌症中检测到了针对该蛋白的aAb反应。在人类研究中,类风湿性关节炎(RA)患者的p53表达较低,Th17数量升高,这表明在Treg/Th17平衡中,p53将平衡推向Tregs。TP53中的SNPs也与某些自身免疫性疾病(如炎症性肠病)的较高风险相关。在癌症和自身免疫性疾病(即系统性红斑狼疮(SLE)和干燥综合征)患者的血清中检测到抗p53负调节因子MDM2的aAbs。这些aAbs已被建议作为癌症和自身免疫性疾病的生物标志物。
Akt(蛋白激酶B,PKB)是一种丝氨酸/苏氨酸蛋白激酶,也是磷酸肌醇3激酶(PI3K)通路中的关键介质。该通路的激活为癌细胞和效应T细胞赋予了促生存优势,同时降低了Treg分化,显示出另一种参与自身免疫和实体瘤的通路。
Bcl-2在一些实体瘤中发生突变,例如皮肤癌和肺腺癌。某些Bcl-2基因型与狼疮相关。所以,遗传因素导致的Bcl-2过表达既可以促进癌的发生,也可以促进自身免疫反应。MHC分子对于抗原呈递至关重要,MHC位点的变异也与许多不同的自身免疫性疾病密切相关,例如强直性脊柱炎与HLA-B27的强相关性。
2. 自身免疫反应相关的肿瘤免疫疗法:在过去的十年中, 肿瘤免疫疗法主导了肿瘤治疗领域。免疫检查点抑制剂(ICI)释放免疫细胞的“松开”,使其能够攻击肿瘤块,在不同类型的实体瘤(如肾细胞癌和晚期黑色素瘤)中显示出显著的临床效果。然而,ICI以及其他一些免疫治疗方法非特异性地刺激免疫系统,触发自身反应性淋巴细胞的激活,自身免疫攻击可能会导致皮肤损伤、结肠炎和甲状腺炎等免疫相关不良反应(irAE),从而削弱了这些治疗方式的益处。irAE 通常具有自限性,在停止治疗后就会消失。
3. 自身抗原的变化:肿瘤相关aAb的靶标可以是突变或截短、异常表达(时间、地点和数量)或具有不同翻译后修饰(PTM)模式的自身抗原。常见突变基因产物p53的抗体已在多种实体瘤类型中观察到,这些aAb也可以在SLE中观察到,可能具有病理生理学重要性。Muc-1 aAb对肺癌等具有预后意义,NY-ESO-1 aAb是NSCLC中抗PD-1更好治疗反应的良好生物标志物,存在于7-31%的食道癌、肺癌、肝细胞癌、胃癌、结直肠癌、前列腺癌和乳腺癌病例中。然而,健康对照中没有人具有这些aAb,这使得针对该抗原的aAb成为高度特异性的潜在癌症生物标志物。最近的一项研究筛查鼻咽癌患者, 表明NY-ESO-1(连同细胞周期蛋白B1、生存素和IMP3)可以作为检测此类癌症的生物标志物。
二、实体瘤中自身免疫反应的意义
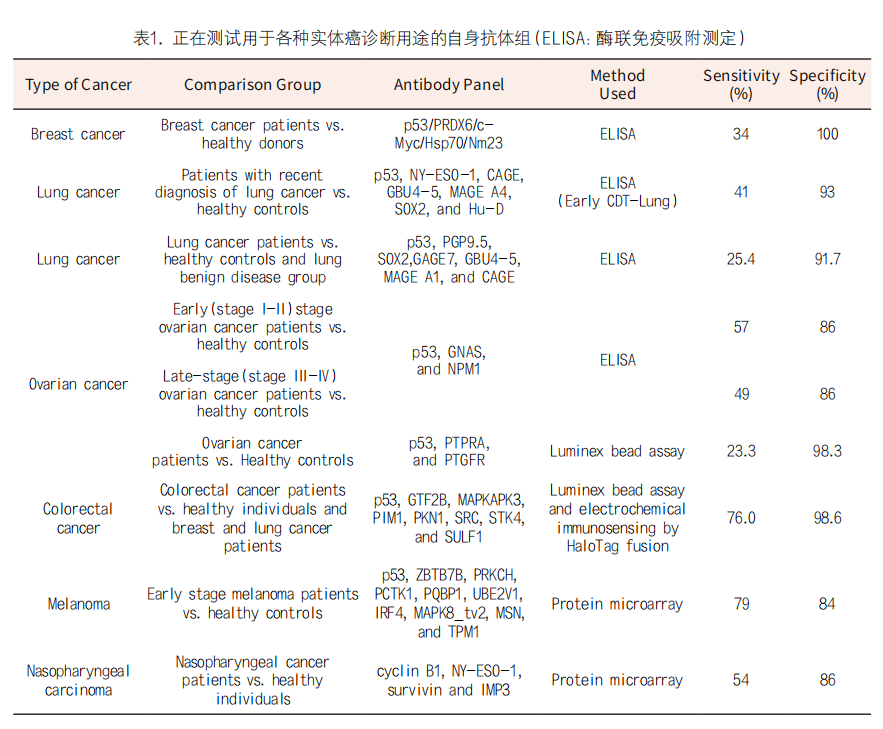
在癌症发病前几个月检测到抗体,预示着免疫系统和新兴癌细胞之间早期的“拉锯战”。aAb作为生物标志物,它提供最佳的灵敏度和特异性,已经有基于血液检测的aAbs商业化试剂盒包括, 筛选一组aAb,例如用于肺癌诊断的早期CDT-lung,还有将自身抗体panel与血清蛋白标志物结合起来用于乳腺癌诊断的Videssa Breast。
aAb水平与肺癌患者的较长生存期相关,结直肠癌中的抗dsDNA aAb也与更好的结果相关。抗核抗体(ANA)与更好的生存相关,ANA可以在细胞凋亡过程中与其暴露的抗原结合,并可能优化这些细胞状态,从而促进抗肿瘤免疫反应。针对DNA拓扑异构酶I的aAb也与I、II和IV期NSCLC更好的总体生存率相关。另一项研究表明,针对人DNA拓扑异构酶I的抗体是乳腺癌良好预后的生物标志物,并且该抗体在ER+和三阴性人乳腺癌细胞系的体外研究中诱导ADCC,它证明了aAb与抗肿瘤免疫反应之间的直接联系。
aAb是否对身体其他结构造成自身免疫损伤,当免疫系统试图通过吞噬细胞上存在的Fc受体清除免疫复合物时,或者当补体级联通过这些免疫球蛋白等机制被激活时,就会出现这种损害。在一些自身免疫性疾病与癌症伴随发生可能与破坏性自身免疫反应有关。在皮肌炎中发现了类似的情况,其中抗NXP2和抗转录中间因子1 γ aAb的存在与皮肌炎发作之前或之后的癌症发展相关。此外,皮肌炎的进展与癌症的进展平行,共同复发或共同消退。可以推测,这些aAb可能是早期失败的抗肿瘤免疫反应的残余物,导致了自身免疫病理。
癌症中的另一种自身免疫攻击见于副肿瘤综合征。这种综合征很少发生(大约每10,000名癌症患者中就有1人),并且表现出的症状并不直接归因于肿瘤。神经副肿瘤综合征中aAb的靶标通常包括肿瘤神经元抗原,例如Hu抗原或抗双载蛋白。抗Hu aAbs以及副肿瘤性神经病和脑病的存在与更好的治疗反应相关,这表明神经元抗原和TAA之间存在潜在的交叉反应。
三、结论与观点
自身免疫与癌症之间的关系是双向的,某些自身免疫性疾病如SLE、RA和SS会增加患癌症的风险。这种效应可能是由慢性炎症和疾病治疗介导的。aAb可以作为稳定、易于测定的特异性生物标志物用于癌症诊断,只需要少量的患者样本。用aAb组合来区分不同的肿瘤阶段和级别、评估治疗反应以及制定治疗选择。在设计、检测方法、切点和病例特征方面标准化的大型前瞻性研究对于能够比较不同研究的结果也很重要。
临床实践中报道使用aAb进行肺癌筛查与诊断较传统肺癌标志物有更高的敏感性及特异度,被认为是一种极具潜力的肺癌生物标志物。单独使用某一aAb对肺癌进行诊断,敏感性、特异度往往不甚理想,但综合多个点位进行联合诊断可以获得满意的结果。
免疫印迹是传统的多重检测技术,随着诊疗技术的不断迭代,医学实验室对于全自动、定量、快速回报结果的检测技术越来越感兴趣。多重流式荧光技术完美解决这一技术升级的问题。胡曼智造以流式荧光技术为核心,搭建了全自动流式荧光定量检测平台,同时兼容自身抗体、过敏原、炎症等多系列指标检测,致力于为临床客户提供高通量、高灵敏度、多指标并行的流式荧光检测技术,聚集重大免疫疾病、疑难杂症及罕见病的诊断,为医疗机构提供自动化、高效、高质量的整体解决方案。
部分内容编译自:《International Journal of Molecular Sciences》, 2021, 22, 8030.




