抗磷脂综合征最新观点与临床研究动向
抗磷脂综合征(antiphospholipid syndrome,APS)是一种以反复血管性血栓事件、复发性流产、血小板减少等为主要临床表现的自身免疫病,伴有抗磷脂抗体谱(aPLs)持续中高滴度阳性。
1983年,Hughes等首先报道一组特殊类型的系统性红斑狼疮(SLE)患者,以血栓事件、复发性流产和狼疮抗凝物(LA)阳性为主要特征,故又称之为Hughes综合征。1999年国际APS专家共识会首次提出了APS分类标准,即Sapporo标准(札幌分类标准)。2004年在悉尼进行第二次专家共识会上,对该标准进行了修订并于2006年发表。时隔16年,“2023 ACR/EULAR APS分类标准”近日发表于Arthritis & Rheumatology。本文将围绕APS最新分类标准,结合2023年10月发表于影响因子16.04的Thrombosis and Hemostasis最新评论,同时参考相关指南共识及研究的观点,阐述APS国际新观点。
一、2023 ACR/EULAR APS分类标准的解读
APS最新分类标准的目的
(1)建立具有高度特异性的新APS分类标准,识别同质研究队列,用于观察性研究和临床试验。(2)最大化特异性是该分类标准的特点,新的APS分类标准通过对单个项目进行加权,最大限度地提高识别APS的特异性。(3)新分类标准可以更好地确保未来对APS患者进行高质量和风险分层的流行病学研究及临床试验。
APS最新分类标准的内容
新分类标准包括入选标准,在确定aPLs相关临床标准后3年内至少一项aPLs检测呈阳性;然后是附加加权标准,综合队列研究结果和文献综述及专家共识的讨论,最终确定了8个独立领域(包括6个临床领域和2个实验室领域)的定义和权重。总积分归类:临床领域和实验室领域各需累积≥3分的患者才被归类为APS。
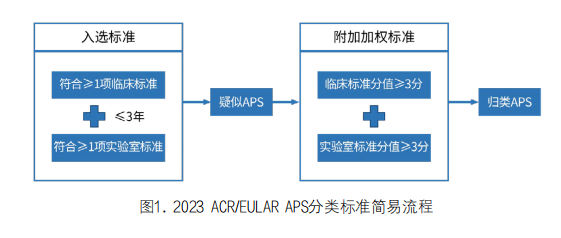
其中,最新分类标准将临床特征的发生时间由札幌标准的5年调整为3年,最终入选标准要求在3年内至少同时出现一项临床标准和一项实验室标准。评论指出准入标准时间限制为3年内,可以显著提高APS分类的确定性。如果aPLs结果阳性与临床表现间隔时间分别<12周或超过3年,应避免归类为APS。
在八大领域(D1-D8)分值范围均为1-7分,六个临床领域包括大血管静脉血栓栓塞、大血管动脉血栓形成、微血管、病理妊娠、瓣膜病变和血液学;两个实验室领域包括LA(凝血功能测定)和固相检测aCL抗体和/或抗β2糖蛋白I抗体的IgG/IgM(ELISA)。

APS最新分类标准的定义
D1:大血管-静脉血栓栓塞(VTE):(1)静脉血栓栓塞(其他原因不明,但通过适当的检查证实);包括(但不限于)肺栓塞、下肢/上肢深静脉血栓、内脏血栓、肾静脉血栓、脑静脉血栓和视网膜静脉血栓/闭塞。(2)高风险VTE定义为≥1个主要危险因素或≥2个次要危险因素,如果时间线/严重程度基于研究者判断与事件相关(根据一般人群指南提供的时间线)。
1. VTE主要危险因素(在事件发生时有以下任何一种情况):(1)未接受治疗或未接受治愈性治疗的活动性恶性肿瘤,正在接受包括激素治疗在内的治愈性治疗;或在事件发生时尽管接受了治愈性治疗,但仍有复发或进展。(2)事件发生前3个月内,因急症住院卧床(仅限使用卫生间)至少3天。(3)事件发生前1个月内,发生重大创伤伴骨折或脊髓损伤。(4)事件发生前3个月内,接受全身/脊髓/硬膜外麻醉>30min的手术。
2. VTE次要危险因素(在事件发生时有下列2个或以上情况):(1)活动性系统性自身免疫性疾病或活动性炎症性肠病(使用当前建议的活动性标准)。(2)根据指南确定的急性/活动性严重感染,如败血症、肺炎、SARS-CoV-2。(3)事件发生在中心静脉置管的同一血管位置。(4)激素替代疗法,含雌激素的口服避孕药,或正在接受辅助生殖治疗。(5)长途旅行(≥8小时)。(6)肥胖(体重指数BMI≥30kg/m2)。(7)妊娠或产后6周内。(8)上述未涉及的长期制动,如腿部受伤导致活动能力下降,或院外卧床≥3天。(9)事件发生前3个月内,接受全身/脊髓/硬膜外麻醉<30min的手术。
D2:大血管-动脉血栓形成(AT):(1)动脉血栓形成(其他原因不明,但通过适当的检查证实):包括(但不限于)心肌梗死(冠状动脉血栓形成),外周/内脏/视网膜动脉血栓形成,基于国际定义的中风,以及在没有可见血栓情况下的其他器官梗死(如肾、肝脏、脾)。(2)高危CVD定义为≥1个CVD高危因素或≥3个CVD中度危险因素,如果时间线/严重程度基于研究者判断与事件相关(可根据一般人群指南提供时间线)。
1. CVD高危因素(≥1项):(1)动脉高血压伴收缩压(BP)≥180mmHg或舒张压≥110mmHg。(2)慢性肾脏疾病,eGFR≤60ml/min/1.73m2,持续超过3个月。(3)伴有器官损害或病程长的糖尿病(1型≥20年,2型≥10年)。(4)高脂血症(严重),伴总胆固醇≥310mg/dl(8mol/L)或低5. CVD高危因素(≥1项)。
2. CVD中度危险因素(≥3项):(1)治疗中的动脉高血压,或持续收缩压≥140mmHg或舒张压≥90 mmHg。(2)具有吸烟现病史。(3)无器官损害且病程短的糖尿病1型<20年,2型<10年)。(4)治疗中的高脂血症(中度)或伴总胆固醇高于正常范围但<310mg/dL(8mol/L),或低密度脂蛋白胆固醇<190mg/dl(4.9mol/L)。(5)肥胖(BMI≥30kg/m2)。
为了确定血栓事件是否发生在具体VTE或CVD高风险的患者中,研究者应尽一切努力根据患者报告或者病例审查来收集和审查危险因素数据。如果在历史血栓发生时,临床相关VTE或CVD危险因素在数据源中未知,那么应将可能的最低非零权重分配给大血管事件,以避免高估aPLs对血栓形成的贡献。
D5:心脏瓣膜:(1)瓣膜增厚(其他原因无法解释):根据世界心脏联合会超声心动图标准,二尖瓣增厚定义为>4mm(年龄在20-39岁之间);>5mm(年龄在40岁以上),>3mm(其他任何年龄);瓣膜增厚可能与瓣膜功能障碍(反流或狭窄)有关。(2)赘生物(其他原因无法解释):根据美国超声心动图学会指南,赘生物被定义为蓬乱状、分叶状或圆形的肿块,通常位于房室瓣膜的心房侧(二尖瓣和三尖瓣)或主动脉瓣的心室侧,但也可以位于任何一侧的阀门(大小高度可变,但通常<1cm);在超声心动图上,尽管“回声结构”和aPLs相关赘生物的位置类似于感染性心内膜炎,但与真正的感染性心内膜炎相比,它们可能表现得更不定形、更圆,且与瓣膜破坏无关;可能与瓣膜功能障碍(反流或狭窄)有关。
D6:血液学:新分类标准增加了血小板减少症的考量,以获取和量化异质性APS表现的程度,血小板计数20-130×109/L对于APS诊断更有特异性。
D8:实验室标准-aPLs的固相检测法:(1)抗心磷脂(aCL)抗体和抗β2-糖蛋白I(β2-GPI)抗体的中滴度(40-79个单位)和高滴度(≥80个单位)阈值的确认应基于标准化的ELISA结果,而不是其他检测方法,如基于各种固相(如磁微粒和微球)和各种检测系统,如化学发光免疫测定(CLIA)、多重流式免疫测定(MFI)的新型自动化平台。(2)ELISA中/高滴度阈值与自动化平台之间的数值相关性差异很大。如根据国际血栓和止血学会科学标准化委员会(ISTH SSC)LA/aPLs的一项研究,aCL IgG ELISA 40-79个单位对应CLIA的200-400个单位和MFI的700-2000个单位。虽然这些数据可能为未来提供指导,但目前还没有直接应用,因此需要更多的验证研究。(3)保持临床研究的同质性、一致性和可比性的建议,包括:(a)不同检测平台的结果不应混在一起进行分析评估;(b)在有进一步研究结果和ISTH SSC LA/aPLs发布ELISA和自动化平台的aCL/anti-β2-GPI中/高滴度阈值半定量比较的官方指导建议以前,不建议使用自动化平台进行APS分类;(c)如果只能使用自动化平台,研究者应努力确认和验证所用平台的中/高滴度阈值,并与ELISA法的阈值相比较。
注意事项:委员会建议不要使用“次要APS”一词,在原发性APS和继发性APS两类患者中,尚未发现aPLs临床后果存在差异(证据等级I)。大多数继发性APS患者同时患有SLE,目前尚不清楚APS和SLE是否是个体中同时发生的两种疾病,潜在的SLE是否为APS的发展提供了环境,或者APS和SLE是否代表同一过程的两个要素。这与其区分“原发性”和“继发性”APS患者,不如记录SLE(或其他疾病)的共存更有利于分类。
新分类标准的验证
在验证阶段,共收集了来自29个国际临床中心的568个潜在APS病例,包括欧洲16个中心(55%)、北美11个中心(38%)、南美1个中心(3%)和亚洲1个中心(3%),以评估初步分类标准的性能效果。
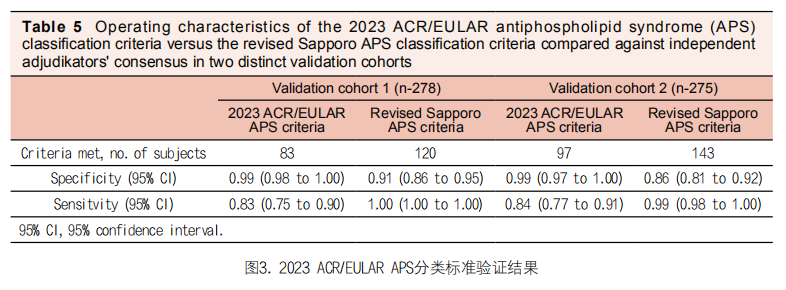
在验证队列中,新的APS标准与2006年悉尼修订的札幌分类标准相比,特异性为99% vs 86%,敏感性为84% vs 99%。
二、APS分类标准与诊断标准不同
分类标准与诊断标准之间的区别
正如分类标准指出的,“被诊断患有特定疾病的患者可能符合也可能不符合该疾病的分类标准”,但是“不正确应用分类标准可能导致误诊”,因此有必要扩大“分类标准”和“诊断标准”之间的区别。“分类标准”是用于确定“确定的APS”,以便于将患者纳入“观察性研究和试验”。这确保了患者队列的同质性,有助于实现评估潜在治疗方法或改进治疗方法。
既往发现,“分类标准”被许多临床医生作为“诊断标准”,部分文献报道也存在该问题。比如,有文献直接描述“LA,aCL抗体和抗β2-GPI抗体检测是正式的实验室分类/诊断标准。”虽然共识建议将LA,aCL抗体和抗β2-GPI抗体检测包含在分类标准和诊断标准中,但二者并不是一回事,需要纠正将“分类标准”称为“诊断标准”的情况。此外,还有多篇文章出现表达混淆错误的情况,比如Kamal Eldin等在他们对SLE患者的抗β2-GPI抗体的研究中发现,尽管“抗β2-GPI抗体IgA不在札幌的诊断标准之内,但在发病机制上它似乎有助于SLE血栓形成,并且可能是一个有用的指标,特别是当标准内aPLs检测阴性时。同样,Kriseman等人“讨论了仅表现为皮肤病的患者诊断APS的困难,因为这些皮肤表现的特异性不足以将APS纳入札幌诊断标准”。虽然上述研究的结论真实无误,但在其描述中,显然错误地将“分类标准”等同于“诊断标准”,需要引起足够重视。
 分类标准与诊断标准本质区别
分类标准与诊断标准本质区别
(1)从本质上讲,临床医生能够使用“分类标准”(包括临床标准和实验室标准)诊断APS,但APS的诊断不仅限于“分类标准”中存在的项目。(2)“分类标准”建立了一个有限的临床和实验室参数列表,识别具有一些确定APS表现的患者,拟纳入未来的研究;但更广泛的临床症状和实验室标准可用于帮助诊断APS。(3)新分类标准纳入了许多之前被定义为“非标准”的临床表现,与早期分类标准相比,大大扩展了临床标准,并为不同的标准赋予了权重。
APS实验室分类标准的探讨
(1)新分类标准要求在临床标准3年内,aPLs检测阳性。在个别情况下,这与临床表现相隔多年的阳性检测有错误分类的风险,因为事件和检测之间的因果关系将受到怀疑。(2)新分类标准显著差异包括积分的纳入,根据ISTH SSC对LA/aPLs标准的LA持续阳性的要求不再是强制性,但LA持续阳性赋予更高积分。(3)ISTH SSC建议计算实验室的第99百分位数并没有出现在新的分类标准中。(4)新分类标准针对固相检测aPLs(aCL抗体和抗β2-GPI抗体)仍然局限于ELISA,定义了中、高滴度阳性分别为40-79个单位和≥80个单位。鉴于支持或反对aPLs“持续阳性”定义的数据有限,本次仍要求aPLs持续阳性,即两次检测阳性至少间隔12周。
【关于aPLs新检测方法】
新标准指出因缺乏使用自动化检测系统的临床研究,所以未纳入aPLs其他固相检测方法。这也是分类标准和诊断标准的明确分离。
由于没有金标准,新检测方法在可行的情况下,应评估检测结果与血栓形成及妊娠并发症之间的关联。
临界值(cutoff)的确定
(1)使用已确认或已验证的本地cutoff值,用于本地试剂及仪器的组合使用。(2)对至少120例当地健康人群的血浆或血清进行检测,并计算第99百分位。(3)或者对至少20名当地健康人群进行检测,验证生产商的临界值,如果标明了统计方法,并且健康群体与当地人群相当,则可以采用生产商的临界值。(4)在可行的情况下,临床实验室应通过临床方法检查当地人群与血栓形成/妊娠并发症的关联。(5)aPLs的结果应根据临床情况进行解释,根据采用的方法学和实验室特定的临界值说明结果是阳性还是阴性。(6)鉴于检测方法的可变性,半定量结果的报告很难定义。每个高于临界值的检测结果都应被视为阳性并定量报告。然而,实验室间和方法间的差异性不允许在数值之间进行比较。应考虑该方法的不精确性,特别是对于临界值左右的结果。
相关研究显示,第99百分位的临界水平似乎比APS分类的>40GPL值更敏感,因为它包括了具有aCL抗体阳性的受试者以及妊娠并发症的患者。而且,由于血管血栓形成与滴度<40GPL单位之间以及妊娠并发症与滴度<40GPL单位之间存在显著关联,因此根据患者的临床特征使用不同的临界值似乎是目前最好的解决方案。
三、小结:正确使用分类标准
分类标准可用于诊断APS,但临床医生不应将APS的诊断限制为仅这些分类标准。建议最好不要使用分类标准来诊断APS,除非该患者计划纳入临床试验。相反,临床医生应遵循其他专家指南,例如ISTH SSC针对LA/aPLs的指南。根据ACR分类和应答标准分委会,诊断被定义为通过评估单个患者的体征、症状和支持性检测来确定疾病的原因或性质。因此,诊断标准是一组体征、症状和检测,用于常规临床护理,以指导患者的个体化临床决策。而分类标准是标准化的定义,主要用于为临床研究创建定义明确、相对同质的患者队列,是捕获具有疾病关键共同特征的患者。
参考文献
Barbhaiya M, Zuily S, Naden R, et al. 2023 ACR/EULAR antiphospholipid syndromeclassification criteria. Ann Rheum Dis. 2023; 0: 1-13.
Emmanuel JF, Leonardo P, Giuseppe L.Classification Criteria for the Antiphospholipid Syndrome: Not the Same as Diagnostic Criteria for Antiphospholipid Syndrome. thrombosis and hemostasis. 2023 Oct. DOI: 10.1055/s-0043-1776318.
J Thromb Haemost. 2014 May; 12(5): 792-5. doi: 10.1111/jth.12537.
A protocol for determination of anticardiolipinantibodies by ELISA. Nature Protocols. 2008 VOL. 3 NO.5.
Laboratory criteria for antiphospholipid syndrome:communication from the SSC of the ISTH. Journal of Thrombosis and Haemostasis, 16: 809-813.




