心血管疾病手术患者围术期出凝血管理重点

陶翠华,教授、主任技师。现任武汉亚洲心脏病医院、武汉亚心总医院输血科主任。主要学会任职:湖北省微循环学会血液治疗专业委员会常委,中国医师协会输血科医师分会儿童血型专业学组委员,中国心胸血管麻醉学会血液管理分会第三届委员会委员,湖北省输血协会常务理事,湖北省输血科质控中心专家,湖北省血液管理专家委员会委员,白求恩基金会输血医学专委会常委,武汉市医学会临床输血专业委员会常委,白求恩精神研究会检验医学分会凝血与止血专业委员会委员,《中国输血杂志》审稿专家,近几年来以第一作者在《Transfusion》、《中国输血杂志》、《临床血液学杂志》等国内外期刊发表论文30余篇。主持课题2项,参与课题4项。作为副主编参译《心血管疾病生物标志物》,参编《检验与临床沟通》、《湖北省输血指南专家共识》、《临床输血个案精选》、《红细胞血清学技术》等专著。

杨杰,副主任技师,现任武汉亚心总医院输血科组长,从事临床输血治疗指导和输血管理,擅长疑难血型血清学检测和疑难特殊配血、临床输血治疗、临床大量出血与急性出血性休克的有效输血控制与合理成分输血。从事临床输血工作多年,具有丰富的临床输血治疗工作经验,主持武汉市科研项目2项,发表论文多篇。目前负责医院贫血管理小组日常工作。主要社会兼职:湖北省输血协会理事。
心血管手术是临床公认的“用血大户”,围术期出血显著,除了心脏本身供血丰富及手术操作外,体外循环、低体温、术前和术中药物的影响,以及大出血引起的凝血因子丢失和消耗等诸多因素均可导致凝血异常增加围术期出血[1-2]。如不能有效的止血和控制出血,患者二次手术风险、异体输血需求、住院时间及病死率都会明显增加[3]。通过围术期患者血液管理可改善患者临床转归、节约血液资源,患者血液管理中凝血功能异常的早期识别和改善尤为重要,现从以下四个方面阐述心血管手术患者围术期出凝血管理。
一、心血管手术出血或凝血功能异常的原因
1. 心血管疾病患者在术前使用各种抗凝治疗,大部分抗凝药物会增加术后出血风险。
2. 心血管外科手术多数是在体外循环(cardiopulmonary bypass,CPB)下完成的,CPB后常会导致异常出血,其发生率为5%~20%[4],凝血功能障碍和术中止血不彻底是心脏手术后出血的两个重要原因。其中CPB导致凝血功能障碍的主要原因如下:(1)消耗性凝血病:血液与人工材料表面接触、术中组织损伤等激活凝血系统,消耗凝血因子及血小板,导致消耗性凝血异常(病)。(2)血小板损伤:CPB可导致血小板数量减少和功能损伤。体外循环开始后,多种原因如体外循环期间血液稀释、机械性破坏等,使心脏手术患者血小板计数下降30%~50%[5]。另外,体外循环期间血小板被激活,引起A颗粒及内容物释放,加之血小板膜糖蛋白Ib和血小板膜糖蛋白IIb/IIIa的减少和损失等,使血小板功能受损。给予鱼精蛋白后,单核-吞噬细胞系统的吞噬作用使循环系统内血小板数量进一步下降;肝素-鱼精蛋白复合体也会抑制血小板功能,血小板功能一般在术后6~12h恢复正常,但血小板计数需数日才能正常。此外,激活的白细胞释放出的产物也可诱发血小板聚集,并释放炎性介质。(3)低温:体外循环多和低温相结合,低体温常可导致凝血功能异常,如体温降至18~26℃,外周血小板明显减少,血小板隐退到门静脉循环中。低温可导致细胞膜功能受损,同样可以加重凝血功能紊乱,显著增加异常出血的发生率。(4)激活纤维蛋白溶解系统:CPB时纤溶活性升高,血管内皮细胞释放大量组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA),t-PA激活纤溶酶原成纤溶酶,可引起出血。(5)体外循环后肝素残余或反跳:肝素的存在会导致凝血因子含量的降低及功能受损,从而导致凝血障碍,引起术后出血增多。(6)鱼精蛋白过量:鱼精蛋白本身也有抗凝作用。过量的鱼精蛋白可以抑制血小板功能,损伤凝血因子功能,并激活纤溶系统酶,增加出血。(7)出血致凝血因子丢失。
3. 手术部位出血:(1)胸骨切开:绝大部分心血管手术需要切开胸骨,在切开胸骨时会发生意外出血,尤其是再次胸骨切开时。(2)建立体外循环时切开动静脉插管可能发生意外失血。(3)手术切口例如切开主动脉的手术、主动脉夹层动脉瘤切除人工血管置换术、动脉调转术、心脏移植术等。主动脉切开吻合术后经常发生意外失血。
4. 术后出血:术后大出血是心血管手术患者致病率和死亡率升高的独立危险因素。首先应当区分是否外科因素出血。(1)外科因素出血:需要再次开胸止血手术。(2)非外科因素出血:根据临床观察、实验室检查和床旁检验(point of care testing,POCT)技术(如血栓弹力图等)明确出血的具体原因,例如血小板功能损伤或数量减少,纤维蛋白原功能降低或数量减少,凝血酶生成不足(血液稀释、肝素残留或反跳、鱼精蛋白过量),纤维蛋白溶解系统亢进等。
二、术前出凝血管理
1.病史:重点关注的病史包括:(1)患者及其家族的出血性疾病史;(2)慢性肝肾功能不全等可能影响出凝血功能的疾病;(3)目前服药情况。
2. 体格检查:重点关注出血性疾病相关体征,包括但不限于:紫癜、淤斑、皮下血肿等。在多数情况下,病史采集及体格检查给患者带来的益处甚至高于传统的APTT、INR和血小板计数等术前检查。
3. 凝血监测:对于有出血史或出血性疾病史患者建议术前进行标准实验室检查(Standard Laboratory Test,SLT),包括凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)、血小板计数、D-二聚体(D-dimer)等,以评估手术出血风险并调整术前用药。有条件的情况下,可以联合使用血液粘弹性检测(Viscoelastic Hemostatic Assay,VHA)以获得更多信息。
4. 粘弹性测试:传统内外源性凝血功能实验如PT/APTT基于离心血浆进行,不能体现血小板及纤维蛋白功能,只能反映凝血过程中某一阶段或某种凝血产物,不能阐明凝血全过程,因而不能准确判定出血或血栓形成的风险。因此,传统的凝血检测在凝血功能障碍诊断方面存在一定的局限性,而粘弹性测定仪弥补了此缺陷,可评估凝血全貌,预测出血风险。目前国内用得比较多的粘弹性测定仪是血栓弹力图(Thromboelastography,TEG)和Sonoclot凝血和血小板功能分析。(1)TEG:研究表明[6],术中术后根据TEG检测结果合理输注血制品及凝血物质,可以明显减少术中出血量,减少红细胞、血浆等血液制品的输入量。(2)Sonoclot凝血和血小板功能分析:Sonoclot分析作为一种准确、即时凝血功能监测手段,也属于粘弹性测试的一种。该分析仪同TEG一样,能够提供凝血进程的主要信息:从纤维蛋白形成,纤维蛋白单体聚合,血小板的相互作用,最终到血凝块的回缩和溶解,并能够评估血小板功能和纤溶系统的变化。
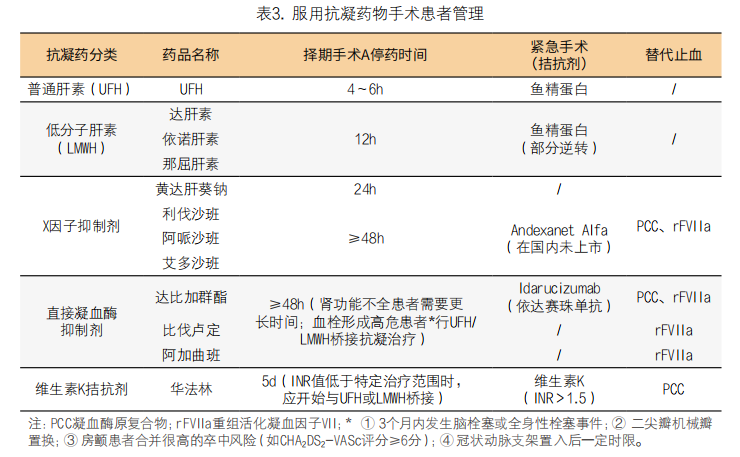
5. 术前凝血异常管理:(1)术前凝血筛查通常采用标准实验室检测,包括PT\APTT\Fib\TT\PLT\D-dimer,将凝血结果结合患者既往病史、体格检查以及肝肾功能等情况进行综合判断,评估凝血异常原因。标准实验室凝血检测结果解读见表1。(2)疑为血管性血友病、甲型、乙型血友病以及其他罕见出血疾病等的患者需转诊至血液病医师处,进行评估,并作出干预。(3)术前纤维蛋白原<1.0g/L时,将增加手术的出血风险[7],纠正后再行手术,可选择纤维蛋白原浓缩物或者冷沉淀进行治疗,提升到纤维蛋白原>1.0g/L再行手术。或者在体外循环结束后再行补充。(4)术前血小板计数<50×109/L时,首先应查明血小板减少原因,针对病因进行处理。如决定手术,选择在术前1天内或者体外循环结束后鱼精蛋白中和后输注血小板[8];血小板计数在50~75×109/L之间时,需提前备血小板,当发生因血小板方面原因导致围术期出血时输注。
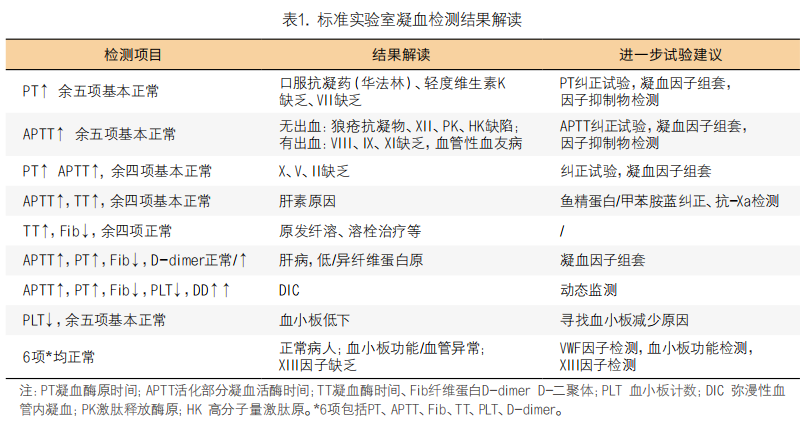
6. 抗栓治疗患者术前管理:围术期服用抗血栓药物预防血栓的患者日益增多。临床上常用的抗血栓药分为抗凝药、抗血小板药等。(1)服用抗血小板药物的手术患者管理:双联抗血小板治疗(dual antiplatelet therapy,DAPT)是冠状动脉疾病(coronary artery disease,CAD)的基础治疗方案,通常包括阿司匹林(acetylsalicylic acid,ASA)加上一种二磷酸腺苷(adenosine diphosphate,ADP)受体抑制剂(也称为P2Y12受体抑制剂)。在实践中,最常用的ADP受体抑制剂是氯吡格雷、替格瑞洛和普拉格雷。阿司匹林、氯吡格雷等药物均不可逆的抑制血小板功能,DATP治疗患者如直接进行心血管外科手术存在一定的出血风险。为降低出血风险,可根据患者围术期血栓栓塞风险级别和外科手术出血风险级别进行综合评估选择合适的停药管理方案,停药管理兼顾心脏保护利益最大化及出血并发症最小化原则,建议无急性冠脉综合征(acute coronary syndrome,ACS)的择期非冠脉旁路移植术患者术前停用阿司匹林;冠脉旁路移植术(CABG)患者术前不停阿司匹林,停用ADP受体抑制剂;高出血风险的手术术前需停用阿司匹林和ADP受体抑制剂,具有高血栓风险的患者(经皮冠状动脉腔内成形术<2周,心肌梗死<6周,金属裸支架<6周,药物洗脱支架<6个月)停用DATP后,可使用短效静脉抗血小板药物GPIIb/IIIa抑制剂治疗桥接,桥接治疗可完全预防支架内血栓形成,不改变围术期出血风险。术前停药时间根据药物的半衰期和患者代谢快慢程度来决定,比如应至少停用替格瑞洛3天,氯吡格雷5天和普拉格雷后7天后才能手术,对于使用GPIIb/IIIa抑制剂桥接治疗的患者,比如替罗非班和依替巴肽,术前4小时停止用药[9],停药具体信息参考表2,其中使用DAPT的CABG患者可以采取图1的原则进行术前管理。
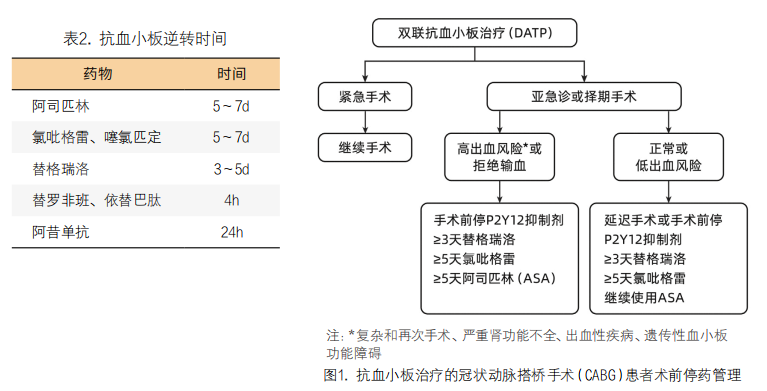
最近研究显示,服用DATP或者P2Y12受体抑制剂的患者由于抗血小板作用的强弱和持续时间的个体差异,使用血小板功能测试可能有助于优化手术时机或确定停药时间不明的患者的血小板抑制程度[10-11],进行个体化管理。目前检测血小板功能的常用方法有TEG和血小板聚集试验(platelet agglutination test, PAgT),根据拟行手术的紧急程度,总结出以下管理措施。1)择期手术:对于正在进行双联抗血小板治疗的择期手术患者通过血小板功能检测来选择最佳手术时间。TEG评估手术时间[10]:MAADP<35mm 5天后手术;30mm<MAADP<50mm 3天后手术;MAADP>50mm,1天内手术。PAgT评估手术时机[11]:ADP%>50%时可以手术。2)紧急手术:对于抗血小板治疗的ACS患者拟行急诊CABG手术,或服用P2Y12受体抑制剂的患者实施紧急手术(如主动脉夹层),需及时通过TEG检测评估手术出血风险,提前制定止血策略和备足血小板等血液制品[12-15](具体见图2)。不建议术前预防性血小板输注,预防性输注并不能改善血小板功能。只有在围术期出血时,考虑是药物所致,可通过血小板输注进行治疗性输注,并通过去氨加压素和氨甲环酸等药物进行止血。3)无血小板功能检测设备时,按抗血小板药物的逆转时间来选择手术时机,见表2和图2。
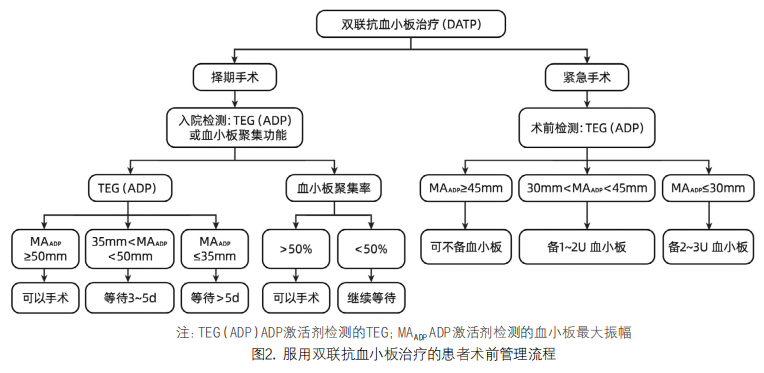
(2)服用抗凝药物的手术患者管理:1)择期手术:对于服用华法林患者,术前5天停用。手术前测量国际标准化比率(INR),如果INR>1.5,给予口服维生素K或者凝血酶原复合物(PCC);术前口服普通肝素(UFH)/低分子肝素(LMWH)抗凝剂仅适用于血栓风险较高的患者。术前12h停用预防性的LMWH,术前24h停用磺达肝素; 对于肾功能受损的患者,可能需要更长的间隔;对于服用直接口服抗凝剂(DOAC),根据患者肝肾功能情况选择术前48~72h停药[16],具体见表3。2)紧急手术:对于服用华法林患者,选择维生素K或者PCC逆转至INR低于1.5;UFH和LMWH可用鱼精蛋白中和,但鱼精蛋白不能完全逆转LMWH的抗凝作用;对于服用DOAC,给予DOAC特异性逆转剂(比如通过Darucizumab逆转达比加群,通过Andexanet-α逆转阿派沙班和利伐沙班),具体见表3。
7. 术前贫血管理:术前中、重度贫血患者与心脏手术死亡比例增加相关。术前血红蛋白(Hb)<100g/L的择期手术病人,明确贫血原因(慢性失血、缺铁性、肾性还是炎症性贫血),并进行病因治疗。比如缺铁性贫血,通过补铁(口服或静脉注射)来治疗;未知原因或经治疗无效的贫血,建议用促红细胞生成素(erythropoietin,EPO)。如严重贫血短期内无法通过药物提高Hb水平,可通过输血快速提高,输血指征为血红蛋白<80g/L,输血时机在心脏手术前或开始使用CPB前进行[17]。
三、术中凝血管理
1. 肝素抗凝与鱼精蛋白中和CPB中应保证充分肝素抗凝,防止发生消耗性凝血。体外循环结束后用鱼精蛋白中和肝素。鱼精蛋白本身具有抑制血小板和抗凝作用,不可过量使用。建议中和肝素时鱼精蛋白首次剂量按体内肝素总用量(包括CPB期间的用量)的1.0:0.5计算,例如肝素总用量为4万U时,鱼精蛋白首次剂量为200mg。在首次中和后需要间断补充或持续泵注鱼精蛋白,在手术结束时鱼精蛋白总量与肝素总用量之比达到1:1左右。从给鱼精蛋白开始到术后6h内,应随时评估是否存在肝素的残余作用,并及时补充鱼精蛋白[18]。
2. POCT:对异常出血或疑似存在凝血功能障碍的患者,应用TEG、SONOCLOT等血液粘弹性检测方法明确出血原因,指导治疗,减少围术期异体血输注量和改善患者预后。
四、术后凝血管理
维持正常的凝血功能以防止术后出血,采取目标导向的输血和止血策略。
1. 红细胞输注策略:心血管手术患者是否需要输注红细胞,除了实验室指标,如血红蛋白水平、血细胞比容、血流动力学参数(如混合静脉血氧饱和度、超声心动图等)外,还应结合患者的临床表现与其他一些相关因素,如患者贫血的严重程度、年龄、基础疾病等进行综合评估后再作出输血决策。(1)对于血液动力学稳定的住院成年患者,采用限制性输血策略[19-20]。接受心脏手术的患者和既往有心血管病史的患者输红细胞阈值定为Hb75~80g/L[21];大于70岁的老年及重症患者,可结合临床表现及血氧饱和度综合评估,如中心静脉血氧饱和度低于正常(ScvO2≤65%[22]),排除其它因素(氧耗增加、心排出量低、组织灌注不足等),即使Hb已达到上述标准,也可输入一定量的红细胞。(2)对于血液动力学稳定的先天性心脏病儿童,根据心脏异常和手术修复阶段选择输血阈值20:双心室修复阈值为Hb70g/L、单心室姑息治疗阈值为Hb90g/L、未纠正的先天性心脏病)阈值为Hb70~90g/L。(3)CPB过程中输红细胞阈值Hb60g/L,或存在脑缺血风险(如脑血管病发作史、糖尿病、脑血管病、颈动脉狭窄等)的患者阈值为Hb70g/L;Hb<70g/L,但预计超滤停机后可能Hb>80g/L,则CPB中患者不输注红细胞。
2. 新鲜冰冻血浆和凝血因子制剂输注策略:(1)输注新鲜冰冻血浆的主要目的是补充凝血因子,而心血管手术患者并不需要常规输注新鲜冰冻血浆,现有证据不支持把常规心血管手术中预防性血浆输注作为血液保护策略的一部分,更不能应用血浆来扩充血容量。血浆是所有血液成分的风险最高的部分,输血浆所导致的副作用包括:输血循环超负荷(TACO)、输血相关性急性肺损伤(TRALI)、输血免疫抑制(TRIM)以及过敏反应等。对无凝血功能障碍的心血管手术患者,术前预防性补充血浆不但不能减少术中出血,反而可能会给患者带来不必要的风险[23-24]。新鲜冰冻血浆适用于凝血因子缺乏或活性不足引起的出血或出血倾向。对心血管手术围术期出血患者进行凝血功能监测,包括使用SLT和TEG等,根据凝血结果分析出血原因,调整止血方案,输注有效的血液成分,提高治疗效果。输注策略如下:1)PT或APTT>参考值区间上限1.5倍(排除肝素影响)、INR>1.7,伴有出血,应输注;2)TEG-R值延长(排除肝素影响),提示凝血因子缺乏,伴有出血,应输注;3)严重出血、大量输血时,凝血结果不可获得时,可输注;4)无凝血酶原复合物时,紧急对抗华法林的抗凝作用,可输注;5)无抗凝血酶制品时,治疗抗凝血酶缺乏性疾病(如肝素耐药);6)输注剂量:剂量10~15ml/kg;严重出血患者需15~25ml/kg。(2)凝血因子制剂的使用:1)接受口服抗凝药治疗的患者,在没有严重出血时,口服或肠外给予维生素K纠正异常的PT、APTT或INR[16]。2)PCC是逆转华法林药物作用的一线用药,使用华法林抗凝的患者发生严重出血或颅脑损伤疑有颅内出血应立即应用PCC;需要急诊手术的患者考虑使用PCC逆转华法林抗凝作用。对于凝血因子缺乏引起出血的患者,应给予PCC或新鲜冰冻血液以减少出血和输血,当需要凝血因子快速正常时,PCC可于30分钟内快速纠正,可能优于新鲜冰冻血浆,建议使用PCC(20~30IU/kg)[25]。3)因子XIII(FXIII)是凝血阶段的终端酶,是交联纤维蛋白单体形成稳定、坚固的纤维蛋白凝块所必需的。CPB下的心脏手术,XIII因子水平可降至30%~50%,研究显示[9]术后血浆XIII因子水平低下与出血增加有关。当出血过程中伴有凝血因子XIII活性降低(<60%),建议输注凝血因子XIII30IU/kg。当XIII因子浓缩制剂难以获得时,可以通过冷沉淀输注进行补充。4)在心血管手术中不建议预防性使用重组人凝血因VIIa(rFVIIa),仅考虑在用其他促凝剂无效的持续性出血患者中使用。CPB下的心血管手术后,对常规止血措施反应性差的非手术原因的顽固性出血:如体外循环后持续出血致使手术室内无法关胸;体外膜肺氧合(extracorporeal membrance oxygenation,ECMO)患者出现威胁生命的大出血等,可考虑使用rFVIIa。应用rFVIIa前应注意纠正外科性出血,低体温和酸中毒,维持纤维蛋白原≥1g/L,血小板≥30×109/L和正常血钙水平[4]。心血管手术后出血患者使用rFVIIa可显著降低再次手术率和输血量,但也可能增加卒中等严重不良事件发生率。因此,其应用前提需保证收益显著超过潜在风险,尤其是用于难治性凝血功能障碍引起的持续出血的急救治疗时。rFVIIa用法:推荐在补充纤维蛋白原、新鲜冰冻血浆和血小板的基础上,单次静脉注射低剂量rFⅦa(20~40μg/kg),在发挥止血作用的同时可降低血栓并发症的风险。
3. 冷沉淀和纤维蛋白原输注策略:(1)冷沉淀可用于治疗因缺乏凝血因子VIII(血友病A),Fib,凝血因子XIII,血管性血友病因子以及纤维结合蛋白数量减少或功能缺陷导致的出血,通过补充外源性凝血因子达到止血目的。尽管冷沉淀应用广泛,但研究及指南均严格限制其应用,因其未经病毒灭活处理,所以优选可以获得凝血因子浓缩制剂。在心血管手术围术期,输注冷沉淀的目的主要用于补充Fib。Fib减少分先天性和获得性。获得性较多见,主要由失血后消耗与液体复苏稀释所致。大出血时,Fib是出血和血液稀释过程中首先耗尽的因子。心脏手术前Fib<1.5g/L和低纤维蛋白血症与术后出血增加有关[8]。因此,Fib补充被认为是心脏术后出血患者的主要止血目标之一。当Fib下降至1.5g/L时,给予冷沉淀或纤维蛋白原浓缩物可有效恢复纤维蛋白原浓度。复杂的心血管手术,应用TEG监测指导纤维蛋白原的输注,以减少围术期出血;如果没有TEG进行凝血监测,可根据传统的出凝血实验来指导止血剂的应用。冷沉淀分预防性输注和治疗性输注。1)预防性输注:a)接受有创操作或手术、有临床显著性出血风险的患者,当Fib<1.0g/L,可进行预防性输注;b)Ⅷ因子严重缺乏患者拟实施手术;c)无出血、不接受有创操作或手术、无临床显著性出血风险的患者,即使Fib低下,不需要预防性输注。2)治疗性输注:a)严重出血、大量输血时,Fib<1.5g/L;b)血栓弹力图(TEG)显示K值延长、α角缩小并伴有明显出血时;c)Ⅷ、vWF和ⅩⅢ因子缺乏导致出血,无凝血因子浓缩物时可输注。3)冷沉淀输注剂量:1~1.5U/10kg(1U:由400ml全血分离的血浆制备);4)纤维蛋白原浓缩物输注剂量:纤维蛋白原浓缩物(FC)剂量(g)=拟升高Fib水平(g/L)×血浆容量(L)。
4. 血小板输注策略:(1)血小板数量减少和或功能障碍是CPB后最常见的非外科出血原因之一。体外循环后,几乎所有患者均会出现不同程度的血小板计数下降和功能异常,故判断患者大量出血是血小板因素所致还是外科止血欠佳导致是制定后续治疗方案的基础。术中及术后大量出血时,可通过SLT和TEG联合检测指导血液成分输注[26-27]。1)预防性输注:a)择期心血管手术患者PLT<50×109/L;b)心血管手术后,血小板持续下降,无出血,不接受有创操作,首先查找血小板减少病因,针对病因治疗,如存在其他止血异常(如:遗传性或获得性凝血障碍等)或存在高出血风险因素(如:发热、败血症、贫血等),输注阈值为PLT<30×109/L。2)治疗性输注:a)心血管手术围术期发生出血且PLT<50×109/L;b)血小板计数50×109/L~100×109/L,伴有大量微血管出血时,宜输注;c)TEG显示MA<45mm伴有明显出血,应输注;d)对于术前服用抗血小板药物患者,术前TEG-MAADP<45mm,围术期出血时,应输注。3)特殊情况及说明:a)预防性血小板输注时,应首先查明血小板减少原因,针对病因治疗;b)血栓性血小板减少性紫癜(TTP)、肝素诱导的血小板减少症(HIT)是预防性血小板输注禁忌症,除非发生危及生命的出血时考虑血小板输注;c)免疫性血小板减少症(ITP),单纯血小板输注效果不佳,首选激素治疗。4)输注剂量:a)成人:1个治疗剂量;活动性出血,需要更大剂量。成人输注1个治疗量血小板大约提升(20~40)×109/L。b)儿童:体重≤15公斤0.3治疗剂量;体重15~20公斤0.4治疗剂量;体重20~30公斤 0.5治疗剂量;较大儿童 1个治疗剂量。
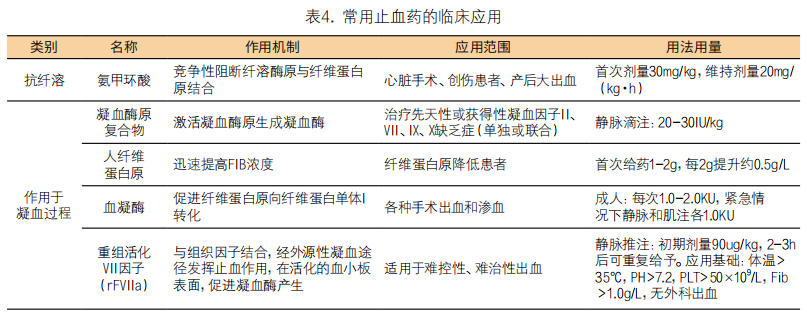
5. 其他止血药:(1)氨甲环酸:氨甲环酸通过抑制纤溶系统而发挥作用,主要用于纤溶活性升高所致的出血。在心血管手术患者中IA级推荐使用氨甲环酸,可降低围术期出血的风险[28]。临床应用应综合考虑患者的年龄、肾功能、手术方式和手术时间等因素。其具体用量尚无统一标准,目前推荐的剂量和方案有:低危出血风险手术(例如单纯的瓣膜成型术、瓣膜置换术和CABG)负荷量10mg/kg,维持量1~2mg·kg-1·h-1;高危出血风险手术患者负荷量30mg/kg,维持量16mg·kg-1·h-1。有研究表明[28],总剂量超过50mg/kg可能与术后癫痫样抽搐发生率增加有关。因此,不建议对非出血高危风险患者氨甲环酸总剂量超过50mg/kg。在此强调指出,CPB心脏手术抗纤溶药应当预防应用。无论选择何种剂量方案,需要在CPB开始前达到有效血药浓度,氨甲环酸至少在CPB前静脉给药10mg/kg,CPB中维持有效血药浓度,CPB结束后可停止给药。(2)钙离子(Ca2+)大量输血时,如果Ca2+浓度过低,建议输注钙剂(氯化钙或者葡萄酸钙),以维持正常的Ca2+(≥1.1mmol/L)。(3)去氨加压素(DDVAP)是目前唯一能够治疗CPB心脏手术后因血小板功能异常导致出血的药物,其作用机制是促使体内的血管性血友病因子(vWF)和Ⅷ因子前体迅速合成有生物活性的凝血物质,建议手术前7d内服用抗血小板药物或CPB时间超过140min的CABG患者常规使用[29]。DDAVP静脉注射后1h起效,作用时间约6h,用药剂量为0.3μg/kg,体重在100kg以下者建议剂量不超过15μg,停CPB前1小时(复温时)应用。注意:给药速度快可引起严重低血压,应缓慢静脉推注;重复给药效果减低;尚不建议预防性使用DDVAP,但对于有遗传性或获得性出血性疾病或血小板功能障碍的出血患者来说,其应用可能是有益的。(4)酚磺乙胺:酚磺乙胺通过促进凝血过程而发挥作用。能增加血液中血小板聚集性和粘附性,促进凝血物质的释放,以加速凝血。临床上用于预防和治疗外科手术出血过多,血小板减少性紫癜或过敏性紫癜以及其他原因引起的出血。(5)血凝酶:血凝酶用于需减少流血或止血的各种医疗情况,血液中缺乏血小板或某些凝血因子时,宜在补充血小板、凝血因子或输注新鲜冰冻血浆的基础上应用。

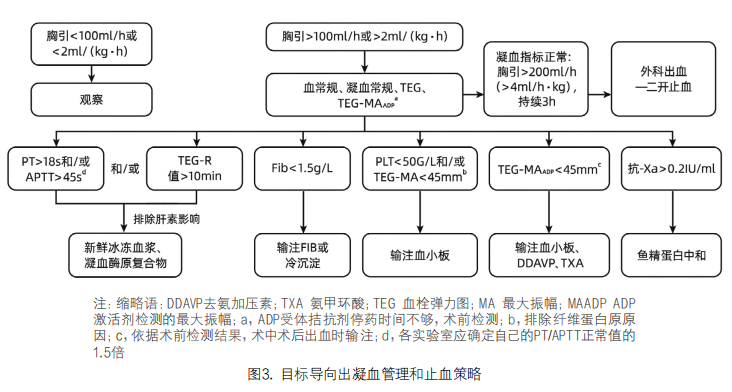
6. 目标导向出凝血管理和止血策略:心血管手术患者围术期凝血异常导致出血的原因复杂且多样,需要通过实验室检测手段及时找到出血原因,并采取目标导向的止血策略(见图3)。将基于血浆基础凝血理论的常规凝血实验及基于细胞基础凝血理论的粘弹性实验结合起来,可全面评估凝血功能障碍的类型、严重程度和出血原因,及时纠正凝血功能并快速有效的止血[30-35]。如果凝血指标均正常同时出血量很大,需要考虑是否存在外科出血,如怀疑外科出血需及时开胸探查止血。心血管外科术后开胸探查指征如下:① 术后持续大量出血。成人出血>200mL/h,持续时间>3h;儿童出血>4mL·h-1·kg-1,持续时间>3h。② 心包填塞。患者术后有血压下降,心律增快,静脉压增高,代谢性酸中毒、乳酸增高及尿量减少等循环不稳定的表现,经过常规处理无效,对血管活性药物不敏感,不能用心功能不全或低心排综合征来解释,应考虑到心包填塞的可能性较大,经床旁心脏超声或者胸片显示心包积液可证实,需要积极开胸探查。③ 急性大量出血。术后早期出血较少,之后突发的大量出血(>300mL/h)通常提示吻合口或较大动/静脉破裂出血,需要紧急开胸探查。
7. 应用抗栓药物以防止术后血栓性并发症:术后抗凝在心脏外科一直以来都备受争议,过早抗凝可能增加患者出血风险,而抗凝不足则可能增加患者栓塞的风险。指南[8, 16]建议,从术后1d直至出院,在止血满意后尽早采用药物预防血栓。(1)使用华法林患者的术后管理:术后重启华法林的最佳时间,在大多数情况下,华法林可以在不复杂且低出血风险的手术术后当晚安全的重新开始使用,根据术后止血程度的不同,可以考虑在术后24~72h恢复LMWH或UFH,并持续到INR达到治疗水平。(2)接受肝素桥接治疗的患者的术后管理:对于因择期手术以治疗剂量静脉用普通肝素或者低分子肝素进行桥接治疗的患者,术后≥24小时再恢复使用。(3)使用直接口服抗凝药患者的术后管理:术后何时开始重启抗凝药,最重要的是评估手术部位的止血情况,通常对于大多数低出血风险的外科手术,可以在手术结束当晚重新开始使用,对于高出血风险的外科手术,建议等待48~72h。(4)抗血小板药物治疗患者的术后管理:对于接受阿司匹林或P2Y12抑制剂治疗、行心脏搭桥手术的患者,建议术后24小时内恢复使用阿司匹林或P2Y12抑制剂。
结语:心血管手术围手术期出凝血管理,涉及到术前、术中和术后。干预措施从术前就开始,确定可能有较高出血风险的患者。包括检测任何潜在的(遗传性或获得性)凝血功能异常,停用抗血栓药物,重大手术前检测并治疗贫血;术中术后重在针对凝血异常的纠正以及目标导向的止血策略和合理使用血液制品等。对出凝血功能的评价及临床与实验室监测,必须贯穿于整个围术期,以便及时了解病情的变化,采取有效的治疗措施。
参考文献
Hastings S, Myles P, Mcllroy D. Aspirin and coronary artery surgery: A systematic review and meta-analysis[J]. Br J Anaesth, 2015, 115: 376-385.
Serraino GF, Murphy GJ. Routine use of viscoelastic blood tests for Diagnosis and treatment of coagulopathic bleeding in cardiac surgery: updated systematic review and meta-analysis[J]. Br J Anaesth, 2017, l18: 823-833.
胡盛寿, 纪宏文, 孙寒松, 等. 心血管手术患者血液管理专家共识[J]. 中国输血杂志, 2018, v.31(04): 7-11. DOI: CNKI:SUN:BLOO.0.2018-04-001.
中国医师协会心血管外科医师分会, 中国医师协会心血管外科分会大血管外科专业委员会. 心脏外科手术血液管理专家共识[J]. 中华胸心血管外科杂志, 2015, 31(012): 715-718.
郑歌, 郗虹娇, 刘传绪, 等. 心脏手术围术期血液保护的研究进展[J]. 临床医学进展, 2021, 11(9): 14.DOI:10.12677/ACM.2021.119569
迟艳新, 赵伟, 朱洪鸣, 等. 血栓弹力图在心胸外科围术期输血中的意义及红细胞输注危险因素分析[J]. 中国实验诊断学, 2021, 25(8): 3.
Grottke O, Mallaiah S, Karkouti K, et al. Fibrinogen Supplementation and Its Indications. Semin Thromb Hemost[J]. 2020 Feb; 46(1): 38-49.
Tibi P, McClure R. S, Huang J, et al. STS/SCA/AmSECT/SABM Update to the Clinical Practice Guidelines on Patient Blood Management[J] Ann Thorac Surg 2021; 112(3): 981-1004.
Pagano D, Milojevic M, Meesters M I, et al. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery[J].Journal of Cardiothoracic and Vascular Anesthesia, 2017: 88-120.DOI: 10.1053/j.jvca.2017.06.026.
杨军, 刘晓辉, 李玲, 等. 血栓弹力图评估血小板功能有助于缩短患者冠状动脉搭桥术前等待时间[J]. 中华检验医学杂志, 2017, 40(2): 5.
冠状动脉旁路移植术围术期抗血小板治疗共识专家组. 冠状动脉旁路移植术围术期抗血小板治疗专家共识[J]. 中华胸心血管外科杂志, 2016, 32(1): 8. DOI: 10.3760/cma.j.issn.1001-4497.2016.01.001.
Modified Hartmann J, Curzen N. Modified Thromboelastography for Peri-interventional Assessment of Platelet Function in Cardiology Patients: A Narrative Review[J]. Semin Thromb Hemost. 2023; 49(2): 192-200.
Chowdhury M, Shore-Lesserson L, Mais A M, et al. Thromboelastograph With Platelet MappingTM Predicts Postoperative Chest Tube Drainage in Patients Undergoing Coronary Artery Bypass Grafting[J]. Journal of Cardiothoracic & Vascular Anesthesia, 2014; 8(2): 217-223.
Elisabeth M, Udaya S, Michael S, et al. Platelet Function Testing in Patients on Antiplatelet Therapy before Cardiac Surgery. Anesthesiology 2020; 133: 1263.
李何昊, 盛凯辉. 血栓弹力图指导抗血小板治疗在冠状动脉支架植入术后患者中的应用[J]. 血栓与止血学, 2022, 28(4): 3.
Perioperative Management of Antithrombotic Therapy: An American College of Chest Physicians Clinical Practice Guideline. Chest, August 11, 2022.
国家卫生健康委员会颁布, 中华人民共和国卫生行业标准(WS/T 796-2022围手术期患者血液管理指南2022
Linda, Shore-Lesserson, Robert A, et al.STS/SCA/AmSECT Clinical Practice Guidelines: Anticoagulation during Cardiopulmonary Bypass.[J].The journal of extra-corporeal technology, 2018.
Hu RT, Royse AG, Royse C, Scott DA, Bowyer A, Boggett S, Summers P, Mazer CD. Health-related quality of life after restrictive versus liberal RBC transfusion for cardiac surgery: Sub-study from a randomized clinical trial.[J]. Transfusion. 2022 Oct; 62(10): 1973-1983.
Patel NN, Murphy GJ. Evidence-based red blood cell transfusion practices in cardiac surgery.[J]. Transfus Med Rev 2017; 31: 230-5.
Carson J L,Stanworth S J,Guyatt G,et al. Red Blood Cell Transfusion 2023 AABB International Guidelines[J]. JAMA. doi: 10.1001/jama.2023.12914 Published online October 12, 2023.
Zeroual N, Blin C,Saour M, et al. Restrictive Transfusion Strategy after Cardiac Surgery[J]. Anesthesionlogy 2021; 134: 370-380.
Warner MA, Frank RD, Weister TJ, et al. Higher intraoperative plasma transfusion volumes are associated with inferior perioperative outcomes.[J]. Transfusion, 2018.
Meesters MI, Koning NJ, Romijn JW, Loer SA, Boer C. Clinical decision versus thromboelastometry based fresh frozen plasma transfusion in cardiac surgery. [J]. Br J Anaesth. 118(3). England, 2017. 458-459.
Goldstein J N, Refaai M A, Jr T J M, et al. Four-factor prothrombin complex concentrate versus plasma for rapid vitamin K antagonist reversal in patients needing urgent surgical or invasive interventions: a phase 3b, open-label, non-inferiority, randomised trial[J]. The Lancet, 2015. DOI: 10.1016/S0140-6736(14)61685-8.
Van Baarle F L F, Van d W E K K, van der Velden, W. J. F. M, et al. Platelet Transfusion before CVC Placement in Patients with Thrombocytopenia[J]. The New England journal of medicine, 2023.
Hess AS, Ramamoorthy J, Hess JR. Perioperative Platelet Transfusions.[J]. Anesthesiology. 2021; 10. 1097/ALN. 0000000000003670.
Koster A, Hulde N, Zittermann A. High-vs Low-Dose Tranexamic Acid Infusion and Need for Red Blood Cell Transfusion and Adverse Events in Cardiac Surgery[J]. JAMA, 2023, 329(1): 97. DOI: 10.1001/jama.2022.20277.
Michael J R Desborough, et al.Desmopressin for patients with spontaneous intracerebral haemorrhage taking antiplatelet drugs (DASH): a UK-based, phase 2, randomised, placebo-controlled, multicentre feasibility trial[J]. Lancet Neurol. 2023, 22(7): 557-567. doi: 10.1016/S1474-4422(23)00157-6.
Kleinveld DJB, Curry N, levy JH. Coagulation support during perioperative bleeding management[J]. Intensive Care Med. 2023. 49, 1110-1113. https://doi.org/10.1007/s00134-023-07089-6
Helms J, Iba T, Connors JM, et al. How to manage coagulopathies in critically ill patients.[J]. Intensive Care Med. 2023 Mar; 49(3): 273-290.
宋景春, 张伟, 张磊, 等. 重症患者凝血功能障碍标准化评估中国专家共识[J]. 解放军医学杂志, 2022(002): 047..
Kietaibl S, Ahmed A, Afshar A, et al. Management of severe peri-operative bleeding: Guidelines from the European Society of Anaesthesiology and Intensive Care[J]. Eur J Anaesthesiol 2023; 40: 226-304.
Lee C, Columbo J A, Stone DH, et al. Preoperative evaluation and perioperative management of patients undergoing major vascular surgery[J]. Vascular Mdeicine. 2022, 27(5): 496-512.
Kozek-Langenecker S A, Ahmed A B, Afshari A, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016[J]. European Journal of Anaesthesiology (EJA), 2017, 34. DOI: 10.1097/EJA. 0000000000000630.




