血小板功能检测的临床应用和检验方法学原理及不同特点

刘晓辉,医学博士,副主任医师。毕业于苏州大学血液内科,主要从事血栓与止血的检验与临床研究。武汉亚洲心脏病医院血栓与止血管理小组核心成员,负责检验与临床的沟通,长期参与临床查房、会诊及特殊病例讨论,为临床提供相关咨询与诊疗建议。参与并完成国家自然科学基金、湖北省、武汉市课题等多项研究,发表学术论文多篇。
血小板在维持正常止血中起着关键作用,同时也被认为是动脉血栓形成的重要因素。如今,血小板功能检测被用于多种不同的临床目的。首先,用于检测急性出血中的血小板功能障碍,诊断有长期出血倾向患者的血小板功能紊乱;第二,用于血栓风险增加患者进行抗血小板治疗的疗效检测。此外,对血小板功能检测是否可用于预测(例如,在大手术之前)出血风险也是讨论的焦点。自光透射聚集测定法问世以来,世界各地的实验室一直致力于血小板功能检测,在过去的几十年中,各种新方法层出不穷。本文除介绍血小板功能检测的临床应用外,还根据检测目的不同,对不同方法的检测原理及优缺点进行论述。血小板功能检测的一个关键步骤是分析前因素,这些因素会对测试结果产生重大影响。因此,本文还概述了各种分析前变量,包括与患者相关的因素,如抽血前吸烟、咖啡和运动,以及抗凝剂的选择,针头规格和从采血到分析的时间。最后,本文对血小板功能检测在临床和研究中的应用前景进行了展望。
一、初期止血
血管病变引起的血管收缩主要由受损内皮合成的内皮素-1介导。同时,内皮下胶原暴露,内皮细胞释放血管性血友病因子(von Willebrand factor,VWF)和三磷酸腺苷(adenosine triphosphate,ATP)[1, 2]。随后,血小板通过与VWF和内皮下胶原的剪切作用粘附在内皮上,导致血小板活化[3, 4]。这会导致血小板的形状转变为多伪足形式,从而增加血小板的表面积。其次,血小板分泌细胞质颗粒。
血小板胞浆颗粒包括5-羟色胺(serotonin)、血小板活化因子和二磷酸腺苷(adenosine diphosphate,ADP)等,其中ADP是一种重要的生理激动剂。ADP与血小板膜受体P2Y1和P2Y12结合,辅助血小板聚集。此外,活化的血小板会从花生四烯酸合成血栓素A2,这是由环氧化酶1催化的反应。血栓素A2从血小板磷脂膜上释放,进一步刺激新的血小板活化并促进血小板聚集[5, 6]。在糖蛋白(GP)Ⅱb/Ⅲa受体的连接下,血小板与纤维蛋白原一起形成初级血小板血栓。最后,当纤维蛋白原通过以凝血酶为主要参与者的继发性止血作用转化为纤维蛋白时,脆弱的初级血小板栓子就稳定下来了[7]。
二、血小板功能检测的临床应用
20世纪60年代,Born和O’Brien[8, 9]提出了光学比浊法(LTA)血小板功能检测,使血小板疾病的诊断方法发生了革命性变化。直到现在,该方法依然是金标准,但自20世纪80年代末以来,又有一些新的方法问世。
血小板功能检测可用于不同的临床情况:急性出血患者、遗传性血小板功能障碍性疾病的诊断以及抗血小板治疗的疗效检测。一些血小板功能试验对血小板疾病的检测具有足够的特异性和敏感性,可用于研究血小板疾病,而另一些具有较低的敏感性,仅适用于血小板功能筛查或抗血小板治疗的疗效评估。
1. 血小板功能检测:常见因素,如上所述,通过一个或多个途径激活静息的血小板可导致多个过程,包括与内皮细胞的粘附、与其他血小板的聚集和脱颗粒,这些过程由表面受体和下游信号介导。因此,在尝试体外评价血小板功能时,血小板功能测试的结果取决于哪些通路被激活以及(例如,聚集或表面受体表达)哪些过程被涉及。目前使用的实验室检查能反映血小板功能的不同方面;但没有一种检测可以反映整个过程的所有部分。特别是,目前的方法无法评估血管对血小板活化和聚集的作用。

在患者样本中加入激动剂可启动体外血小板活化。加入激动剂后,与血小板相关受体结合从而激活血小板。不同激动剂诱导的聚集程度可用于区分血小板疾病或量化其严重程度。最常用的聚集激动剂见表2。在研究抗血小板药物的效果时,会使用针对受阻受体的激动剂。如果评估阿司匹林的效果,则花生四烯酸被用作激动剂,而ADP被用于ADP受体抑制剂的疗效测试。

血小板功能可以在全血或富血小板血浆(platelet-rich plasma,PRP)中进行评估。分析抗凝全血中的血小板聚集,由于减少了样本处理,具有节省时间的优势。此外,全血可以被视为更符合生理的环境,可以更真实地反应血小板聚集的潜力;然而,血小板与血管壁的相互作用在这两种方法中均未被评估。相反,分析PRP中的血小板功能也可能存在处理过程中因离心而带来的血小板活化或血小板亚群丢失的风险[10]。
2. 光学法血小板聚集率检测:使用LTA,通过测量加入血小板激动剂后PRP透光度的变化来评估血小板聚集。在分析前,测定患者贫血小板血浆(PPP)的最大透光率(100%),从而根据血浆中的其他吸收成分调整测量值。初始基线建立后,将PRP加入激动剂以进行检测。然后连续记录光透过率,因血小板聚集而逐渐增加。结果报告为最大聚集百分比[11]。
LTA测定的血小板聚集可以被多种激动剂和不同浓度的激动剂所诱导[12],这使我们能够评估聚集过程的许多方面,包括两相聚集和解聚。LTA被认为是血小板聚集检测的金标准,其与支架内血栓、缺血性心脏事件和出血风险的相关性已经得到了很好的验证[12]。
由于LTA是目前应用最广泛的血小板聚集检测方法,因此在实验室间进行了多次方法学标准化的尝试。然而,由于没有国际标准试剂,这个问题仍然没有解决[13]。LTA的另一个缺点是使用PRP。其他血液成分的缺乏和试验的低剪切力条件导致了与生理性血小板激活和聚集对血管壁损伤的反应不同[14]。LTA对低血小板计数也很敏感。此外,由于PRP和PPP的产生,LTA分析需要相对较大的血容量,特别是同时使用几种激动剂时。最后,该测试比较耗时,并且需要熟练的工作人员来分析性能和进行结果解释。
3. 自动化实验室LTA的改进:LTA分析中的上述缺点促进了更易管理的、需要更小血容量的高通量分析的发展。这些试验代表了改良的LTA试验,并要求与LTA相同的样品制备,但它们要么使用标准96孔板,要么在一些自动凝血分析仪上进行检测。在第一种测试中,PRP被添加到预先涂有激动剂或含有激动剂溶液的孔板中,加入PRP后,平板被搅拌,导致血小板聚集和随后的光吸收变化,结果以聚集百分比报告,与传统的LTA相同,但不测量透光率,而是测量光吸收[15, 16]。
这种方法保持了LTA的灵活性,但可以一次性快速评估多个患者的不同激活途径。此外,它只需要标准的基于ELISA(酶联免疫吸附测定法)的设备,但仍然需要有经验的人员来执行测试和结果解释。
光透射法检测血小板聚集最近也被引进到自动凝血分析仪(例如,Sysmex CS2000、2500和5100系列)上[17]。对于所有这些方法,仍然需要制备PRP;然而,自动化方法具有PRP和试剂自动移液的优点,因此比传统的聚集仪需要更少的人工操作。该方法已经在健康个体和疑似出血性疾病的个体中进行了测试,与其他方法的相关性较好[18-20],但仍有待进一步的临床验证。
4. 全血聚集测定法:第一台可评估全血中血小板聚集的仪器是Chrono-log[21],它于1980年首次推出,采用了多电极聚集测量法[22]。该设备可通过阻抗变化测量血小板聚集,此外,使用荧光素-荧光素酶试剂时,该方法还可同时测定ATP的释放[23]。随后,半自动仪器Multiplate分析仪对Chrono-log进行了补充[24]。这种基于阻抗的分析方法可测定未经处理的血液中血小板的聚集情况。将全血或稀释后的全血加入含有两个电极的测试池中。加入激动剂后,血小板聚集并粘附在电极上,导致电极之间的阻抗(或电阻)增加,被持续记录并转换为任意聚集单位(AU)。根据制造商的建议,血小板聚集通常以AU*min为单位的曲线下面积进行报告[25],但也会记录最大聚集幅度(以AU为单位)和聚集曲线的斜率,即聚集速度(AU/min)[26]。
全血聚集测定法的主要优点是能在相当自然的环境中分析血小板。此外,由于省略了样本(PRP、PPP)制备,该方法所需的样本量比LTA少,耗时短,比LTA更容易操作。检测结果不受血脂或胆红素血症的影响,但受血小板计数的影响[27]。另一方面,有些方法非常昂贵(一次性试剂盒)或分析范围有限(即标准多板检测板)。
5. 血小板功能分析仪:血小板功能分析(PFA 100/200)于1995年推出,是对Thrombostat 4000检测的改进[22]。与阻抗聚集仪一样,它也能评估全血中的血小板聚集情况。分析时,通过膜上的一个小穿孔吸入血液,产生高剪切力。膜上包被有聚集激动剂,主要有两种:肾上腺素和胶原(CEPI盒)或ADP和胶原(CADP盒)[28]。激动剂与高剪切应力一起激活通过膜的血小板,导致聚集和粘附,从而形成血栓并堵塞穿孔。膜闭合的时间以闭合时间(CT)为单位进行测量和报告,单位为秒。
PFA 100/200是一项全面的止血功能检测,能够检测或排除严重的血管性血友病、血小板紊乱和影响血小板的药物(主要是阿司匹林)。该检测对VWF水平高度敏感,因为血栓的形成在很大程度上依赖于VWF,特别是在高剪切应力条件下[29]。此外,该分析对血小板计数和红细胞压积也很敏感,但由于是对血小板(和VWF)的全面检测,因此无法区分特定的疾病[10]。另外,CT可能会因摄入某些食物或补充剂以及非处方药物而延长。
6. VerifyNow:VerifyNow是一种即时检测仪器,可通过基于比浊法的光学检测对全血中的血小板功能进行检测。血液样本无需任何前处理即可装入仪器。将全血吸取到含有纤维蛋白原包被磁珠和聚集激动剂的孔中。当血小板粘附并聚集到纤维蛋白原包被的珠子上时,透光率就会增加[30]。
该设备专门用于通过对纤维蛋白原的亲和力来确定抗血小板治疗(阿司匹林或P2Y12抑制剂)的效果,不适用于其他用途。由于它不需要对样本进行任何处理,因此无需专业实验室的参与就能轻松完成,所以常用于急性病的检测。不过,VerifyNow对阿司匹林作用下降的敏感性可能不如LTA等其他方法[31],而且制造商的临界值也缺乏临床验证。
7. IMPACT:锥板(Let)分析仪:锥板(let)分析仪是一种用于体外评价血小板功能的即时检测仪器。它通过测量血小板在高剪切力下对血栓形成表面的粘附力来获得。血栓形成表面是一个固定了血浆蛋白的聚苯乙烯表面。将全血添加到表面,然后通过旋转锥向血小板施加高剪切力。这会刺激血小板黏附于固定板上的血浆蛋白(特别是纤维蛋白原和VWF)。随后清洗平板并用MayGrunwald染色。染色后,使用图像分析仪测量血小板聚集体以进行宏观评估,并以血小板覆盖率百分比和平均聚集大小表示结果[32]。
这种方法的显著优点是模拟了原发性止血的生理条件。此外,无需血液处理,并且完全自动化,只需要少量样本。然而,该方法高度依赖于血浆蛋白、红细胞压积和血小板计数[10, 22, 30]。
8. PlateletWorks:PlateletWorks可检测全血中的血小板聚集,主要用于快速检测抗血小板药物的效果[33]。血液直接抽入添加了激动剂的试管中,然后再抽入未添加激动剂的试管中。必须在10分钟内使用阻抗细胞计数器对两个试管中的血小板进行计数。由于阻抗血小板计数器只记录单个血小板而不记录血小板聚集体,因此与无激动剂管相比,激动剂管中的血小板计数更低。然后根据两管之间血小板计数的差异计算聚集率百分比。由于只需极少的样品处理,因此分析很容易进行,原则上可使用任何阻抗计数器进行分析。然而,要获得正确的结果,必须在10分钟内对样本进行分析[34]。PlateletWorks与其他基于聚集的方法(如LTA和阻抗聚集测定法)之间的相关性一般[34-36]。此外,该方法在很大程度上还没有经过临床验证。
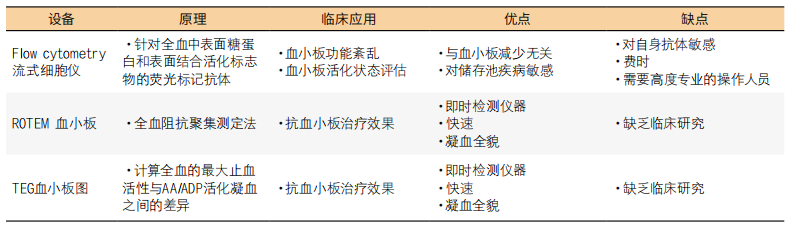
9. 流式细胞仪:有些血小板功能紊乱很难用前面介绍的方法检测出来。特别是,贮存池缺陷很难通过常规的实验室测试来识别,因此,需要更深入细致的测试。流式细胞术既可以识别表面蛋白的缺乏,也可以鉴定由颗粒缺乏或颗粒释放缺陷导致的颗粒不足[37]。该方法使用针对各种血小板表面或细胞内标志物的荧光标记抗体。血液样本与抗体孵育,血小板通过激光束,激光束会激活荧光团。检测每个血小板的荧光,结果以平均荧光强度或荧光阳性血小板百分比表示。该方法允许设计具有多个荧光基团的组合,便于同时测量多个血小板标志物。表面标志物可以在静息血小板(如用于Bernard-Soulier综合征的GPIb)上测量,也可以在各种激动剂激活后测量[38]。在分析颗粒能力时,有必要在荧光团标记前透化膜,以评估细胞内成分。对血小板聚集的流式细胞分析也有描述[39]。
流式细胞仪分析血小板功能对表面蛋白和细胞内蛋白表达减少的敏感性很高,而且可以在一个样本中检测多种活化标志物。由于血小板是单独计数的,因此该方法不像LTA或阻抗聚集测定法那样受血小板计数的影响,并且可以在低至1mL的血液中进行[40]。此外,检测组合可以单独设计,在研究和临床使用中都具有很高的自由度。其缺点是仪器成本高,操作过程耗费大量人力,而且分析工作对技术人员的要求甚至高于 LTA。此外,对结果的解释也具有挑战性。
10. 血栓弹性测定法和血栓弹力图:标准ROTEM和TEG方案均无法检测血小板功能。然而,ROTEM和TEG均可进行血小板聚集试验。聚集仪可作为ROTEM的附加设备,根据阻抗聚集测定法测量全血中的血小板聚集。通过添加花生四烯酸和ADP作为激动剂,血小板模块可以评价抗血小板药物的效果。TEG血小板图谱系统[41]也为测量抗血小板治疗的效果提供了机会[42]。首先,通过高岭土活化试验确定最大止血活性。抗血小板治疗的效果是通过在全血中加入爬虫酶、凝血因子XIIIa和花生四烯酸或ADP来评估的。然后以高岭土活化试验的结果为参照计算血小板活化抑制率。然而,在临床上应用ROTEM或TEG检测血小板功能仍需时日。
三、血小板功能检测的影响因素
1. 分析前因素:对于所有动态血小板功能检测,都应采取预防措施,避免样本中的血小板在分析前被过度活化,因为这将导致虚假的检测结果。与患者和采样相关的多种因素都会影响分析前的血小板活化,此外,血小板对操作敏感,体外稳定性较差。所有这些因素均可导致分析前误差。除此之外,其他因素如抗凝剂的选择、运输途径、缓冲液和测量时的温度等都会对结果产生影响,因此应进行标准化。所以,进行血小板功能分析的实验室应仔细考虑分析前变异的来源,并应制定涵盖这些变异来源的标准化实验室规程。本部分概述了血小板功能检测中分析前变异的最主要因素。
2. 患者相关因素:昼夜节律[43]、咖啡饮用量[44]、吸烟[45]、运动[46, 47]、食物摄入量[48]、药物(如非甾体类抗炎药,NSAIDs)[49]或膳食补充剂(如鱼油[50])都是影响血小板活化的因素。因此,理想情况下,患者应在早晨空腹时采集血样,采血当天早晨不喝咖啡、不吸烟、不运动,并在过去10至14天内暂停服用相关药物,包括非处方药和膳食补充剂。实际上,很难控制所有这些因素,而且在急诊环境中也不可能做到。然而,应收集与患者相关因素的信息,以帮助解释检查结果,对于择期患者,应暂停服用药物、非甾体抗炎药和鱼油。应始终测量血小板计数以帮助解释结果,因为某些血小板功能检测方法依赖于该参数。
3. 采血因素:在采血过程中,许多因素可以激活血小板。静脉穿刺时内皮损伤会暴露胶原和组织因子,并导致内皮释放血小板活化因子。高剪切力和振动也能激活血小板[51]。溶血导致红细胞释放Ca2+和ADP。因此,建议在最小止血带压力下,使用19~21号针头和短连接管,顺利静脉穿刺获得的血液用于血小板功能分析[52, 53]。一些指南建议丢弃前几毫升,原理是避免管道中的内皮源性激活物质,如果使用带有预抽真空的试管系统,则是为了填充连接处的死腔,并避免空气混入[53],从而影响血液与抗凝剂的比例。
4. 试管及抗凝剂的选择:应将血液抽入表面不活化的试管中,如聚丙烯试管[53]。试管中应含有抗凝剂,以避免凝血酶生成和随后的血小板活化。不同的抗凝剂可用于分析,最常用的有枸橼酸盐(一种Ca2+ 螯合剂)、水蛭素(一种直接凝血酶抑制剂)或肝素(一种间接凝血因子Xa和凝血酶抑制剂)。蛭素或肝素等相比,使用枸橼酸盐产生的总体聚集值较低[54-57]。因此,使用一种抗凝管建立的参考区间不能转移到其他类型。乙二胺四乙酸(EDTA)可能引起GPⅡb/Ⅲa复合物的构象变化,从而影响血小板表面纤维蛋白原的结合,因此应避免使用这种抗凝剂。
5. 运输和储存条件:建议直立运输样品,避免气动管道系统或其他使样本受到较高机械力的运输系统。如果由于物流原因必须使用气管系统,则必须进行彻底的本地验证,因为先前的研究表明,使用气管系统可能会影响血小板功能测试[51, 58, 59]。调查储存时间对血小板功能检测结果影响的研究发现,在采血后的前30分钟内,血小板活化程度显著增加[38, 54, 55, 57]。因此,建议血液样本在分析前至少静置30分钟。不同方法之间的稳定性不同,但一般来说,血小板功能检测样本的稳定性相对较短(通常为2-4小时)。抗凝剂的选择也会对结果产生影响,肝素化血液的稳定性比柠檬酸化血液更长[54, 56, 57]。应遵循制造商的指示,或在当地进行稳定性验证。最后,储存温度会对结果产生影响。Kaiser等发现在4℃和37℃下储存对稳定性均有负面影响;因此,建议样本在室温下保存[54]。
四、结论与展望
自LTA问世60年来,血小板功能检测已广泛开展。目前已有多种血小板功能检测方法可用于出血性疾病的诊断、急性出血患者的病情评估及抗血小板药物治疗效果的研究。它们从简单易用、即时检测到复杂的流式细胞术,在提供血小板活化表面标记物的详细分析和协助诊断罕见的血小板疾病方面具有革命性的意义。
目前,血小板功能分析主要在专业实验室进行。开发自动化程度更高或通量更高的方法,如改良的96孔板法或全自动凝血分析仪上的LTA,将有望在未来为全球更多的患者提供血小板功能检测。未来研究和发展的另一个重要问题是方法的标准化,既要尽量减少分析前的差异,又要能够进行跨实验室的比较。此外,近年来,血小板对出血和血栓以外的一系列生理和病理生理条件的贡献已被探索,例如,炎症、血管生成和肿瘤的生长和转移。在这些情况下,血小板功能检测对诊断和预后的临床价值仍有待阐明。
参考文献
Michelson AD. How platelets work: platelet function and dysfunction. J Thromb Thrombolysis 2003; 16(1–2): 7-12
Gremmel T, Frelinger AL III, Michelson AD. Platelet physiology. Semin Thromb Hemost 2016; 42(03): 191-204
Ju L, Chen Y, Zhou F, Lu H, Cruz MA, Zhu C. Von Willebrand factorA1 domain binds platelet glycoprotein Ibα in multiple states with distinctive force-dependent dissociation kinetics. Thromb Res 2015; 136(03): 606-612
Farndale RW, Sixma JJ, Barnes MJ, de Groot PG. The role of collagen in thrombosis and hemostasis. J Thromb Haemost 2004; 2(04): 561-573
Nakahata N. Thromboxane A2: physiology/pathophysiology, cellular signal transduction and pharmacology. Pharmacol Ther 2008; 118(01): 18-35
FitzGerald GA. Mechanisms of platelet activation: thromboxane A2 as an amplifying signal for other agonists. Am J Cardiol 1991; 68(07): 11B-15B
Larsen JB, Hvas AM. Thrombin: a pivotal player in hemostasis and beyond. Semin Thromb Hemost 2021; 47(07): 759–774
Born GV. Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature 1962; 194: 927–929
O’ Brien JM. Platelet aggregation: part II Some results from a new method of study. J Clin Pathol 1962; 15(05): 452–455
Harrison P, Lordkipanidzé M Testing platelet function. Hematol oncol Clin North Am 2013; 27(03): 411–441
Hvas AM, Favaloro EJ. Platelet function analyzed by light transmission aggregometry. Methods Mol Biol 2017; 1646: 321–331
Koltai K, Kesmarky G, Feher G, Tibold A, Toth K. Platelet aggregometry testing: molecular mechanisms, techniques and clinical implications. Int J Mol Sci 2017; 18(08): 1803
Le Blanc J, Mullier F, Vayne C, Lordkipanidzé M Advances in platelet function testing-light transmission aggregometry and beyond. J Clin Med 2020; 9(08): 2636
Choi JL, Li S, Han JY. Platelet function tests: a review of progresses in clinical application. BioMed Res Int 2014; 2014: 456569
Vinholt PJ, Nybo M, Nielsen CB, Hvas AM. Light transmission aggregometry using pre-coated microtiter plates and a Victor X5 plate reader. PLoS One 2017; 12(10): e0185675
Chan MV, Armstrong PC, Warner TD. 96-well plate-based aggregometry. Platelets 2018; 29(07): 650-655
Lawrie AS, Kobayashi K, Lane PJ, Mackie IJ, Machin SJ. The automation of routine light transmission platelet aggregation. Int J Lab Hematol 2014; 36(04): 431-438
Frère C, Kobayashi K, Dunois C, Amiral J, Morange PE, Alessi MC. Assessment of platelet function on the routine coagulation analyzer Sysmex CS-2000i. Platelets 2018; 29(01): 95-97
Stratmann J, Karmal L, Zwinge B, Miesbach W. Platelet aggregation testing on a routine coagulation analyzer: a method comparison study. Clin Appl Thromb Hemost 2019; 25; 1076029619885184
Bret VE, Pougault B, Guy A, et al. Assessment of light transmission aggregometry on the routine coagulation analyzer Sysmex CS2500 using CE-marked agonists from Hyphen Biomed. Platelets 2019; 30(04): 540-542
Cardinal DC, Flower RJ. The electronic aggregometer: a novel device for assessing platelet behavior in blood. J Pharmacol Methods 1980; 3(02): 135-158
Mansouritorghabeh H, de Laat B, Roest M. Current methods of measuring platelet activity: pros and cons. Blood Coagul Fibrinolysis 2020; 31(07): 426-433
Thompson NT, Scrutton MC. Inhibition by luciferin-luciferase reagents of aggregatory responses to excitatory agonists in washed platelet suspensions. Thromb Res 1985; 38(02): 109-119
Tóth O, Calatzis A, Penz S, Losonczy H, Siess W. Multiple electrode aggregometry: a new device to measure platelet aggregation in whole blood. Thromb Haemost 2006; 96(06): 781-788
Siller-Matula JM, Christ G, Lang IM, Delle-Karth G, Huber K, Jilma B. Multiple electrode aggregometry predicts stent thrombosis better than the vasodilator-stimulated phosphoprotein phosphorylation assay. J Thromb Haemost 2010; 8(02): 351-359
Rubak P, Skipper MT, Larsen OH, Hvas AM. Continuous exploration of parameters derived from multiple electrode platelet aggregometry is warranted. Thromb Res 2018; 164: 45-47
Skipper MT, Rubak P, Stentoft J, Hvas AM, Larsen OH. evaluation of platelet function in thrombocytopenia. Platelets 2018; 29(03): 270-276
Favaloro EJ. Clinical application of the PFA-100. Curr Opin Hematol 2002; 9(05): 407-415
Favaloro EJ. Clinical utility of closure times using the platelet function analyzer-100/200. Am J Hematol 2017; 92(04): 398-404
Paniccia R, Priora R, Liotta AA, Abbate R. Platelet function tests: a comparative review. Vasc Health Risk Manag 2015; 11: 133-148
Nielsen HL, Kristensen SD, Thygesen SS, et al. Aspirin response evaluated by the VerifyNow Aspirin System and light transmission aggregometry. Thromb Res 2008; 123(02): 267-273
Savion N, Varon D. Impact–the cone and plate(let) analyzer: testing platelet function and anti-platelet drug response. Pathophysiol Haemost Thromb 2006; 35(1-2): 83-88
Campbell J, Ridgway H, Carville D. Plateletworks: a novel point of care platelet function screen. Mol Diagn Ther 2008;12(04): 253-258
van Werkum JW, Kleibeuker M, Postma S, et al. A comparison between the Plateletworks-assay and light transmittance aggregometry for monitoring the inhibitory effects of clopidogrel. Int J Cardiol 2010; 140(01): 123-126
Kim J, Cho CH, Jung BK, et al. Comparative evaluation of Plateletworks, Multiplate analyzer and Platelet function analyzer-200 in cardiology patients. Clin Hemorheol Microcirc 2018; 70(03): 257-265
Polena S, Zazzali KM, Shaikh H, et al. Comparison of a point-ofcare platelet function testing to light transmission aggregometry in patients undergoing percutaneous coronary intervention pretreated with aspirin and clopidogrel. Point Care 2011; 10(01): 35-39
Ramström S, Södergren AL, Tynngård N, Lindahl TL. Platelet function determined by flow cytometry: new perspectives? Semin Thromb Hemost 2016; 42(03): 268-281
Rubak P, Nissen PH, Kristensen SD, Hvas AM. Investigation of platelet function and platelet disorders using flow cytometry. Platelets 2016; 27(01): 66-74
Vinholt PJ, Frederiksen H, Hvas AM, Sprogøe U, Nielsen C. Measurement of platelet aggregation, independently of patient platelet count: a flow-cytometric approach. J Thromb Haemost 2017; 15(06): 1191-1202
Pedersen OH, Nissen PH, Hvas AM. Platelet function investigation by flow cytometry: sample volume, needle size, and reference intervals. Platelets 2018; 29(02): 199-202
Platelet Mapping Assay TEG. (Haemonetics). (Haemonetics). Accessed June 27, 2022, at: https://teg.haemonetics.com/~/media/ sharepoint/devices/teg/marketing/brochures/teg_plateletmapping/ col-pp-000196-us_teg_plateletmapping_assay%20pdf.ashx
Agarwal S, Coakley M, Reddy K, Riddell A, Mallett S. Quantifying the effect of antiplatelet therapy: a comparison of the platelet function analyzer (PFA-100) and modified thromboelastography (mTEG) with light transmission platelet aggregometry. Anesthesiology 2006; 105(04): 676-683
Dalby MC, Davidson SJ, Burman JF, Davies SW. Diurnal variation in platelet aggregation iwth the PFA-100 platelet function analyser. Platelets 2000; 11(06): 320-324
Natella F, Nardini M, Belelli F, et al. Effect of coffee drinking on platelets: inhibition of aggregation and phenols incorporation. Br J Nutr 2008; 100(06): 1276-1282
Rival J, Riddle JM, Stein PD. Effects of chronic smoking on platelet function. Thromb Res 1987; 45(01): 75-85
Naesh O, Hindberg I, Trap-Jensen J, Lund JO. Post-exercise platelet activation–aggregation and release in relation to dynamic exercise. Clin Physiol 1990; 10(03): 221-230
Davis RB, Boyd DG, McKinney ME, Jones CC. Effects of exercise and exercise conditioning on blood platelet function. Med Sci Sports Exerc 1990; 22(01): 49-53
Ahuja KD, Adams MJ, Robertson IK, Ball MJ. Acute effect of a highcarbohydrate low-fat meal on platelet aggregation. Platelets 2009; 20(08): 606-609
Schafer AI. Effects of nonsteroidal antiinflammatory drugs on platelet function and systemic hemostasis. J Clin Pharmacol 1995; 35(03): 209-219
Begtrup KM, Krag AE, Hvas AM. No impact of fish oil supplements on bleeding risk: a systematic review. Dan Med J 2017; 64(05): A5366
Thalén S, Forsling I, Eintrei J, Söderblom L, Antovic JP. Pneumatic tube transport affects platelet function measured by multiplate electrode aggregometry. Thromb Res 2013; 132 (01): 77-80
Harrison P, Mackie I, Mumford A, et al; British Committee for Standards in Haematology. Guidelines for the laboratory investigation of heritable disorders of platelet function. Br J Haematol 2011; 155(01): 30-44
Adcock D. Collection, transport, and processing of blood specimens for testing plasmabased coagulation assays and molecular hemostasis assays; Approved guideline, 5th edn. CSLI document H21-A5-A. Wayne, PA: Clinical and Laboratory Standards Institute (CSLI); 2008
Kaiser AF, Neubauer H, Franken CC, Krüger JC, Mügge A, Meves SH. Which is the best anticoagulant for whole blood aggregometry platelet function testing? Comparison of six anticoagulants and diverse storage conditions. Platelets 2012; 23(05): 359-367
Hardy M, Lessire S, Kasikci S, et al. Effects of time-interval since blood draw and of anticoagulation on platelet testing (count, indices and impedance aggregometry): a systematic study with blood from healthy volunteers. J Clin Med 2020; 9 (08): 2515
Mani H, Hellis M, Lindhoff-Last E. Platelet function testing in hirudin and BAPA anticoagulated blood. Clin Chem Lab Med 2011; 49(03): 501-507
Nissen PH, Skipper MT, Hvas AM. Whole blood platelet aggregation determined by the ROTEM platelet equipment; reference intervals and stability. Platelets 2020; 31(02): 215-220
Glas M, Mauer D, Kassas H, Volk T, Kreuer S. Sample transport by pneumatic tube system alters results of multiple electrode aggregometry but not rotational thromboelastometry. Platelets 2013; 24(06): 454-461
Dyszkiewicz-Korpanty A, Quinton R, Yassine J, Sarode R. The effect of a pneumatic tube transport system on PFA-100 trade mark closure time and whole blood platelet aggregation. J Thromb Haemost 2004; 2(02): 354-356.




