感染相关凝血功能障碍的实验室监测与临床诊疗价值

魏启美,主管技师,临床检验诊断学硕士。武汉亚洲心脏病医院检验中心检验技师,负责临床微生物检验与临床沟通工作,主要参与重症医学科日常查房,为临床提供炎症与感染诊疗意见。
【摘要】在感染的最初阶段,凝血作为一种自然防御机制,试图限制致病的病原体,防止其扩散到全身循环中。然而,在重症感染后期,如脓毒症患者一般通过四种主要机制导致机体处于血栓前状态,包括外源性凝血途径激活、细胞因子诱导的凝血放大、抗凝途径抑制和纤溶障碍。实验室常规凝血监测的指标有凝血酶原时间、纤维蛋白原和纤维蛋白降解产物、血小板计数等。近年来,随着对感染相关凝血功能障碍病理生理学更深入的了解,发现一些能更早的反应体内凝血初期阶段、综合评估血管内皮受损情况以及纤溶酶激活状态的实验室检测项目得到了广泛的应用。本文论述了重症感染时凝血功能监测的策略和临床意义,旨在通过检测患者血液的相关凝血指标来帮助临床医生评估患者病情,从而降低病死率。
一、感染相关凝血功能障碍的病理生理特点
感染在重症监护病房中很常见,特别是进展为脓毒症而严重危害患者生命。凝血功能紊乱是导致重症感染患者死亡的主要因素,其范围从轻微的血小板减少症到脓毒症相关凝血功能障碍(SIC)[1],在更严重的阶段,可导致器官功能障碍和出血有关的弥散性血管内凝血(DIC),常常造成致命后果[2]。脓毒症早期出现炎症风暴,炎症和凝血途径之间存在多方面的联系,促炎细胞因子诱导内皮细胞和单核细胞表达,从而触发外源性凝血途径的激活。凝血功能的激活可诱发微血管血栓形成,从而导致多器官功能障碍和出血倾向[3]。其中组织因子和中性粒细胞外陷阱(NETs)被认为在SIC和DIC的发病机制中起着核心作用[4]。组织因子是一种有效的凝血启动剂,由微生物和多种炎症介质(包括细胞因子和补体)诱导内皮细胞、单核细胞和巨噬细胞产生。组织因子通过与凝血因子FVIIa形成复合物,进而激活FX和FIX刺激凝血[5]。同时它也通过激活血小板、内皮细胞、白细胞和血管平滑肌细胞上表达的模式识别受体来诱导促炎反应[2]。
另一个重要成分NETs是由中性粒细胞释放染色质纤维网络组成的。该网络含有抗菌肽和蛋白酶,能够捕获和中和细菌,并调节病毒感染[6]。然而,与先天免疫的许多成分一样,NETs在感染中起着双刃剑的作用。脓毒症期间过度的NETs可通过各种机制产生有害影响,包括诱导血管内血栓形成和多器官衰竭。主要机制包括通过活化因子XII直接激活内源性凝血途径,也通过结合组织因子激活血小板、激活外源性凝血途径,还可通过抑制抗凝血剂(如抗凝血酶III、活化蛋白C),进一步促进血栓形成[7]。并且有研究表明NETs形成的程度可以预测脓毒症患者DIC的发展和死亡率,进一步表明NETs在脓毒症相关性凝血障碍中的重要作用[8]。
内皮在平衡止血方面起着关键作用,并且有新的证据表明内皮活化和损伤是脓毒症凝血障碍的关键驱动因素[9]。感染诱发急性炎症反应后,血管内皮细胞会因一氧化氮、前列腺素生成减少和糖萼被破坏等因素而失去抗血栓的特性,其中内皮糖萼的损伤降低了血管屏障功能,并增加了循环系统中血小板和白细胞的粘附[10]。血栓调节蛋白被蛋白水解并从内皮表面释放出来,此外纤溶酶原激活物抑制剂1(PAI-1)的产生也会上调,纤溶系统受到抑制,这是脓毒症凝血功能紊乱的重要特征。受损的内皮细胞会释放血栓形成分子,包括血管性血友病因子和粘附分子,并刺激血小板粘附和聚集[11]。此外,抗凝血酶和蛋白C等生理性抗凝因子会随着血管通透性的增加而外渗[12]。这些事件促进了脓毒症期间微血栓的广泛形成。
二、凝血障碍的实验室监测
临床上大约有50%到70%的脓毒症患者存在明显的止血障碍,而这些患者中有35%发展为DIC[13]。与感染相关的凝血功能障碍包括从只能通过敏感的凝血因子活化标记物检测到的微弱凝血活化,到可通过血小板计数小幅下降和全身凝血时间亚临床延长检测到的较强凝血活化,再到以同时发生广泛的微血管血栓形成和不同部位大量出血为特征的暴发性弥散性血管内凝血[14]。因此我们寄希望于通过实验室监测了解患者感染引起凝血功能障碍的全过程,并适时进行临床干预。
1. 内皮功能检测:内皮细胞具有很强的生理学抗凝能力,其合成并释放硫酸乙酰肝素蛋白多糖,这是糖萼的一种成分,它结合并增强血浆抗凝蛋白,包括组织因子途径抑制物(TFPI)和抗凝血酶。内皮细胞表达血栓调节蛋白(TM)并与凝血酶结合,将凝血酶的底物专一性从促凝剂转化为抗凝血剂[15]。在细菌、真菌或病毒感染期间,外源性PAMPs(病原体相关分子模式)和内源性DAMPs(损伤相关分子模式)触发内皮激活,并可能损害其结构和功能[16]。脓毒症发生时,血管内环境中的抗凝能力可能会受到损害,原因是内皮细胞糖基化反应中断,TM下调,以及血浆抗凝蛋白(如TFPI和抗凝血酶)下降[12]。血浆TM在一定程度上可以反映血管内皮细胞受损的程度,TM与凝血酶结合后可将蛋白C转化为活性形式,并表现出一系列重要的生理抗炎、抗凝血和抗纤维蛋白溶解特性[17]。脓毒症患者活化的血浆蛋白C(APC)减低,主要是由于肝脏合成蛋白C减少和全身消耗蛋白增加所致,APC水平的降低与脓毒症DIC患者的不良预后具有显著相关性[18]。
2. 血小板监测:血小板是多功能的效应细胞,参与止血、炎症、白细胞功能和内皮细胞的激活。约有20%~50%的脓毒症患者在住院期间发生从轻度到重度不等的血小板减少[19]。细菌一旦进入血液循环,就会与血小板相互作用,导致血小板活化和消耗。为了应对血小板的消耗,血小板的生成量会增加,因此在脓毒症早期,血小板计数增加是很常见的现象。然而,随着血小板消耗速度超过血小板生成速度,机体的合成能力很快就会被抵消,此时开始出现血小板减少症[20]。脓毒症过程中血小板的减少通常伴随着血小板功能和聚集以及血小板-中性粒细胞聚集的受损,被证明与脓毒症患者的多器官衰竭有关,因此被纳入到序贯器官衰竭评估(SOFA)评分中,血小板减少的程度与脓毒症预后之间存在明确的关联[21, 22]。低血小板计数通常与脓毒症凝血障碍的发生有关,即凝血级联反应的系统激活失调,导致出血性并发症和微血管血栓形成[23]。Schupp等对358名脓毒症或感染性休克患者的研究发现血小板计数在脓毒症第5天达到最低点,而血小板下降(<150×109/L)的患者与30天的死亡率的风险增加有关,且与血小板计数未恢复的患者相比,血小板计数恢复的患者(定义为从第5天到第10天血小板计数增加>25%)与死亡率改善无关[24]。然而,血小板计数高于100×109/L并不意味着血小板消耗和微血栓形成的过程还没有开始,有研究发现血小板计数正常的患者也出现了明显的纤溶抑制,这可能表明血小板在接下来的几天里会下降,结果可能会恶化[25]。两个不同的小组发布了新的脓毒症患者凝血功能障碍的诊断标准,2017版脓毒症诱发凝血障碍(SIC)和2018版脓毒症相关凝血障碍(SAC),这两个标准均把血小板计数纳入计分指标(当血小板计数<150×109/L时计1分;<100×109/L时计2分)[26]。因此,在脓毒症所致的凝血障碍中,持续的血小板减少往往是识别凝血障碍的线索。
另一方面感染对血小板形态有直接作用,研究表明血小板形态学指标血小板分布宽度(PDW)和血小板平均体积(MPV)会受到感染的影响[27]。PDW是血小板异质性的一个参数,广泛用于血细胞计数,有研究建议把PDW与MPV一起作为血小板活化的标志[28]。较高的PDW值可能反映了感染引起的大量血小板激活,另外MPV和PDW水平较高可能还反映了未成熟血小板释放到循环中的比例较高[29]。Fogagnolo等[30]研究表明高PDW和MPV都可作为感染严重程度的标志,是感染期间死亡率的独立预测指标,其值与脓毒症休克患者90天死亡率有关。感染性休克患者不仅会出现血小板计数下降,而且还会出现血小板聚集功能障碍[31]。血小板聚集的体外评估被用于诊断血小板功能紊乱,光传输聚集法(LTA)被认为是检测血小板功能的金标准,该技术测量的是光透过富血小板血浆样本或缓冲液中血小板悬浮液的透射率变化,这种变化是血小板在受到刺激时改变形状和聚集时发生的,与其他可用的血小板反应性值(PR)分析仪相比,LTA受血小板计数的影响要小得多[30, 32]。
3. 常规凝血监测:在感染初期,炎症造成血管内皮细胞损伤,组织因子与凝血因子FVIIa形成复合物促进凝血酶活化,凝血酶原时间(PT)和活化部分凝血酶原时间(APTT)可处于正常值范围或轻度缩短,进而继发纤溶活化,D二聚体和纤维蛋白降解产物(FDP)水平升高。随着病情发展为脓毒症,炎性因子大量释放使血管内皮细胞损伤进一步加重,凝血酶过度活化导致凝血底物消耗过度,此时出现纤维蛋白原水平下降,PT、APTT显著延长[33]。Jackson Chornenki 等人报告说,血小板计数和国际标准化比值(PT-INR)与抗凝血酶活性相结合可识别脓毒症患者的早期 DIC[34]。
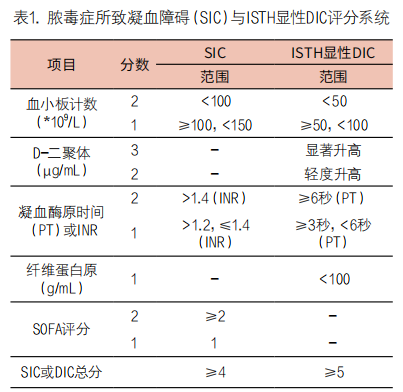
脓毒症患者凝血功能障碍的诊断标准(SIC)将PT- INR纳为评分指标,同样国际血栓与止血学会(ISTH)公布的显性DIC诊断标准纳入凝血酶原时间(PT)、纤维蛋白原和D-二聚体[35],这些监测项目均是基于血栓形成和止血的常规实验室检测(评分标准见表1)。日本血栓和止血协会(JSTH)为提高DIC诊断标准的敏感性和特异性,将包括凝血酶生成、凝血酶-抗凝血酶复合物(TAT)和凝血酶原片段等生物标志物纳入新的评分标准。如果这些值中的任何一个大于或等于各自正常上限的两倍,则向JSTH诊断评分增加一分[36]。
4. 纤溶系统监测:除了大量的凝血激活外,纤溶系统是脓毒症血栓形成的另一个重要调节因素,纤溶功能受损被认为是脓毒症相关微血栓形成和纤溶型DIC发展的关键反应,因为它通过阻止纤维蛋白的去除而导致广泛的微血管血栓形成[37]。生理上,内皮细胞通过产生组织型纤溶酶原激活剂和PAI-1来平衡止血平衡的纤溶功能,并且凝血酶激活的纤溶抑制物TAFI和中性粒细胞弹性蛋白酶也调节纤溶功能[38]。脓毒症患者体内PAI-1和TAFI水平升高与器官衰竭有显著相关性[25, 39]。Hoshino等[40]回顾性分析显示PAI-1水平升高与脓毒症死亡率及严重程度相关,且PAI-1水平高于83ng/mL的患者发生凝血功能障碍、器官衰竭和死亡的风险较高,提示PAI-1有潜力用于脓毒症风险分层和治疗监测。最近一项对90名COVID-19患者的研究发现在TAFI水平高的患者中,COVID-19疾病进展更为严重,并且高TAFI水平与患者死亡率和插管率相关[41]。
当纤维蛋白凝块开始形成时,纤溶级联被激活,以抵消微血管中不断增加的纤维蛋白沉积。然而,这种纤溶活性可能会被PAI-1、TAFI和其他血栓前介质显著削弱。因此,作为交联纤维蛋白降解产物D-二聚体,在脓毒症患者中其水平可能不能正确反映DIC期间纤维蛋白形成的程度,可能导致假阴性结果,使用D-二聚体进行脓毒症DIC的诊断和危险分层可能会误导临床[42]。这是D-二聚体从SIC标准中剔除的一个原因。此外,纤溶酶是纤溶系统中的一种关键酶,纤溶酶-α-2-纤溶酶抑制物复合物(PIC)是体内纤溶酶生成的标志物,而TAT则是反映凝血酶的生成量或凝血系统激活程度。TAT和PIC的比值可作为反映凝血和纤溶平衡的指标[43]。临床上常观察TAT/PIC用于评估凝血与纤溶激活程度、高凝状态判断及纤溶亢进程度判断,一般认为比值在5.0左右为纤溶平衡,但是缺乏随机对照试验的数据支持。
三、分析与结论
感染相关性凝血功能障碍的特点是内皮功能障碍引起的凝血酶激活和纤溶抑制,可迅速进展为DIC导致多器官衰竭和死亡。DIC是一种基于实验室的诊断,所以实验室监测对于早期发现凝血障碍和识别DIC并及时干预对改善预后是非常重要的。ISTH建议两步诊断方法,即首先评估SIC,如果SIC标准满足,则评估显性DIC。这一策略将有助于及早识别DIC,并有可能加速干预。不管是SIC评分还是DIC评分涉及到的实验室指标血小板计数、PT/INR、纤维蛋白原、D-二聚体均为常规凝血项目,临床获得相应评分结果是非常容易的。此外,我们也介绍一些内皮损伤标志物和纤溶抑制标志物,这些标志物主要价值在于患者的预后评估以及开发新的治疗方法。尽管取得了这些进展,但仍存在一些客观问题,在众多测试中,我们可以在多大程度上依赖这些测试来预测预后?同时应该注重检测的标准化问题。
参考文献
Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock [J]. Lancet (London, England), 2018, 392(10141): 75-87.
Galli M, Angiolillo D J. The evaluation and management of coagulopathies in the intensive therapy units [J]. European Heart Journal: Acute Cardiovascular Care, 2023, 12(6): 399-407.
Iba T, Levy J H. Sepsis-induced Coagulopathy and Disseminated Intravascular Coagulation [J]. Anesthesiology, 2020, 132(5): 1238-45.
Iba T, Watanabe E, Umemura Y, et al. Sepsis-associated disseminated intravascular coagulation and its differential diagnoses [J]. J Intensive Care, 2019, 7: 32.
Grover S P, Mackman N. Tissue Factor: An Essential Mediator of Hemostasis and Trigger of Thrombosis [J]. Arteriosclerosis, thrombosis, and vascular biology, 2018, 38(4): 709-25.
Li P, Li M, Lindberg M R, et al. PAD4 is essential for antibacterial innate immunity mediated by neutrophil extracellular traps [J]. The Journal of experimental medicine, 2010, 207(9): 1853-62.
Zhang H, Wang Y, Qu M, et al. Neutrophil, neutrophil extracellular traps and endothelial cell dysfunction in sepsis [J]. Clinical and Translational Medicine, 2023, 13(1).
Abrams S T, Morton B, Alhamdi Y, et al. A Novel Assay for Neutrophil Extracellular Trap Formation Independently Predicts Disseminated Intravascular Coagulation and Mortality in Critically Ill Patients [J]. American Journal of Respiratory and Critical Care Medicine, 2019, 200(7): 869-80.
Cross D, Drury R, Hill J, et al. Epigenetics in Sepsis: Understanding Its Role in Endothelial Dysfunction, Immunosuppression, and Potential Therapeutics [J]. Frontiers in immunology, 2019, 10: 1363.
Huang X, Hu H, Sun T, et al. Plasma Endothelial Glycocalyx Components as a Potential Biomarker for Predicting the Development of Disseminated Intravascular Coagulation in Patients With Sepsis [J]. Journal of intensive care medicine, 2021, 36(11): 1286-95.
Joffre J, Hellman J, Ince C, et al. Endothelial Responses in Sepsis [J]. Am J Respir Crit Care Med, 2020, 202(3): 361-70.
Ito T, Kakuuchi M, Maruyama I. Endotheliopathy in septic conditions: mechanistic insight into intravascular coagulation [J]. Critical Care, 2021, 25(1).
Iba T, Connors J M, Nagaoka I, et al. Recent in the research and management of sepsis-associated DIC [J]. Int J Hematol, 2021, 113(1): 24-33.
Giustozzi M, Ehrlinder H, Bongiovanni D, et al. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment [J]. Blood Reviews, 2021, 50.
Ito T, Maruyama I. Thrombomodulin: protectorate God of the vasculature in thrombosis and inflammation [J]. Journal of thrombosis and haemostasis : JTH, 2011, 9 Suppl 1: 168-73.
Ait-Oufella H, Maury E, Lehoux S, et al. The endothelium: physiological functions and role in microcirculatory failure during severe sepsis [J]. Intensive Care Med, 2010, 36(8): 1286-98.
Iba T, Ito T, Maruyama I, et al. Potential diagnostic markers for disseminated intravascular coagulation of sepsis [J]. Blood Rev, 2016, 30(2): 149-55.
Papageorgiou C, Jourdi G, Adjambri E, et al. Disseminated Intravascular Coagulation: An Update on Pathogenesis, Diagnosis, and Therapeutic Strategies [J]. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis, 2018, 24(9_suppl): 8s-28s.
Claushuis T A, van Vught L A, Scicluna B P, et al. Thrombocytopenia is associated with a dysregulated host response in critically ill sepsis patients [J]. Blood, 2016, 127(24): 3062-72.
Cox D. Sepsis - it is all about the platelets [J]. Frontiers in immunology, 2023, 14: 1210219.
Campo G, Contoli M, Fogagnolo A, et al. Over time relationship between platelet reactivity, myocardial injury and mortality in patients with SARS-CoV-2-associated respiratory failure [J]. Platelets, 2021, 32(4): 560-7.
Matono T, Yoshida M, Koga H, et al. Diagnostic accuracy of quick SOFA score and inflammatory biomarkers for predicting community-onset bacteremia [J]. Scientific reports, 2022, 12(1): 11121.
Venkata C, Kashyap R, Farmer J C, et al. Thrombocytopenia in adult patients with sepsis: incidence, risk factors, and its association with clinical outcome [J]. J Intensive Care, 2013, 1(1): 9.
Schupp T, Weidner K, Rusnak J, et al. Diagnostic and prognostic role of platelets in patients with sepsis and septic shock [J]. Platelets, 2023, 34(1): 2131753.
Semeraro F, Colucci M, Caironi P, et al. Platelet Drop and Fibrinolytic Shutdown in Patients With Sepsis [J]. Critical Care Medicine, 2018, 46(3): e221-e8.
Yamakawa K, Yoshimura J, Ito T, et al. External Validation of the Two Newly Proposed Criteria for Assessing Coagulopathy in Sepsis [J]. Thrombosis and haemostasis, 2019, 119(2): 203-12.
Fogagnolo A, Taccone F S, Benetto G, et al. Platelet morphological indices on Intensive Care Unit admission predict mortality in septic but not in non-septic patients [J]. Minerva anestesiologica, 2021, 87(2): 184-92.
Zampieri F G, Ranzani O T, Sabatoski V, et al. An increase in mean platelet volume after admission is associated with higher mortality in critically ill patients [J]. Annals of intensive care, 2014, 4: 20.
Ouyang Y, Wang Y, Liu B, et al. Effects of antiplatelet therapy on the mortality rate of patients with sepsis: A meta-analysis [J]. Journal of critical care, 2019, 50: 162-8.
Fogagnolo A, Taccone F S, Campo G, et al. Impaired platelet reactivity in patients with septic shock: a proof-of-concept study [J]. Platelets, 2020, 31(5): 652-60.
Adamzik M, Görlinger K, Peters J, et al. Whole blood impedance aggregometry as a biomarker for the diagnosis and prognosis of severe sepsis [J]. Critical care (London, England), 2012, 16(5): R204.
Lassila R. Platelet Function Tests in Bleeding Disorders [J]. Seminars in thrombosis and hemostasis, 2016, 42(3): 185-90.
Iba T, Levy J H, Warkentin T E, et al. Diagnosis and management of sepsis‐induced coagulopathy and disseminated intravascular coagulation [J]. Journal of Thrombosis and Haemostasis, 2019, 17(11): 1989-94.
Jackson Chornenki N L, Dwivedi D J, Kwong A C, et al. Identification of hemostatic markers that define the pre‐DIC state: A multi‐center observational study [J]. Journal of Thrombosis and Haemostasis, 2020, 18(10): 2524-31.
Iba T, Levi M, Thachil J, et al. Communication from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis on sepsis-induced coagulopathy in the management of sepsis [J]. Journal of thrombosis and haemostasis : JTH, 2023, 21(1): 145-53.
Suzuki K, Wada H, Imai H, et al. A re-evaluation of the D-dimer cut-off value for making a diagnosis according to the ISTH overt-DIC diagnostic criteria: communication from the SSC of the ISTH [J]. Journal of thrombosis and haemostasis : JTH, 2018, 16(7): 1442-4.
Levi M, van der Poll T. Coagulation and sepsis [J]. Thrombosis research, 2017, 149: 38-44.
Iba T, Umemura Y, Wada H, et al. Roles of Coagulation Abnormalities and Microthrombosis in Sepsis: Pathophysiology, Diagnosis, and Treatment [J]. Arch Med Res, 2021, 52(8): 788-97.
Semeraro F, Colucci M, Caironi P, et al. Platelet Drop and Fibrinolytic Shutdown in Patients With Sepsis [J]. Crit Care Med, 2018, 46(3): e221-e8.
Hoshino K, Nakashio M, Maruyama J, et al. Validating plasminogen activator inhibitor-1 as a poor prognostic factor in sepsis [J]. Acute medicine & surgery, 2020, 7(1): e581.
Aksakal A, Kiliç A F, Afşin D E, et al. evaluation of the relationship between TAFI level and prognosis in COVID-19 patients [J]. European review for medical and pharmacological sciences, 2023, 27(10): 4764-71.
Semeraro F, Ammollo C T, Caironi P, et al. Low D-dimer levels in sepsis: Good or bad? [J]. Thrombosis research, 2019, 174: 13-5.
Hasuike Y, Kakita N, Aichi M, et al. Imbalance of coagulation and fibrinolysis can predict vascular access failure in patients on hemodialysis after vascular access intervention [J]. Journal of vascular surgery, 2019, 69(1): 174-80.e2.




