D-二聚体实验室检测与临床应用中国专家共
【摘要】D-二聚体(D-dimer)是交联纤维蛋白的降解产物,是凝血和纤溶系统激活的重要标志物之一,已在多种疾病的诊断及治疗中得到广泛应用。近年来,随着对D-二聚体研究的不断深入以及检测技术的发展,D-二聚体实验室检测和临床应用方面的问题日渐凸显,报告形式亦缺乏规范性,给实验室检测和临床应用均造成诸多困惑。因此,中国研究型医院学会血栓与止血专业委员会组织国内血栓与止血领域的相关专家商讨并制定了《D-二聚体实验室检测与临床应用中国专家共识》。本共识从实验室检测方法、质量要求与性能评价、样本处理与分析影响因素、结果报告,以及在不同疾病诊疗中的应用问题分别进行了阐述,以期解决D-二聚体在实验室检测中面临的关键问题,为D-二聚体在临床中的合理应用与正确解读提供参考。
【关键词】实验室;检测;临床应用;D-二聚体
D-二聚体(D-dimer)是交联纤维蛋白的降解产 物,是体内凝血和纤溶系统活化的重要标志物[1, 2],在涉及凝血紊乱相关疾病的诊疗中得到广泛应用[3-5]。近年来,随着对D-二聚体研究的不断深入以及检测技术的发展,D-二聚体实验室检测和临床应用方面的问题日渐凸显,给实验室检测和临床应用均造成诸多困惑[3, 6-9]。国内D-二聚体检测系统多样,不同检测系统结果存在较大偏差,可能导致临床对检测结果产生误解。鉴于此,中国研究型医院学会血栓与止血专业委员会组织国内血栓与止血领域相关专家,针对实验室及临床的关键问题,起草制定《D-二聚体实验室检测与临床应用中国专家共识》,以期解决D-二聚体在实验室检测中面临的关键问题,为D-二聚体在临床中的合理应用与正确解读提供参考。
一、制定过程及推荐意见分级
1. 制定过程:本共识由来自全国检验与临床等相关领域的多学科专家历经7个月、5轮共同讨论制定。专家委员会讨论了共识题目、需要解决的问题、证据检索以及推荐意见分级等,并对有争议的问题进行讨论改进、逐一调整和反馈。
2. 证据检索与推荐意见分级:在制定推荐意见 时,专家委员会使用了基于所有可用数据的循证方 法。分别在PubMed、中国期刊全文数据库(CNKI)、中文科技期刊数据库(维普)、万方全文数据库中检索了相关文献,检索的文献类型包括病理生理和机制研究、随机对照试验、荟萃分析、描述性研究、队列研究和综述等。专家委员会对推荐意见进行了以下分级:(1)强推荐;(2)推荐;(3)弱推荐。
二、D-二聚体病理生理学
D-二聚体是交联纤维蛋白的降解产物。纤维蛋白原在凝血酶的作用下,形成纤维蛋白单体(fibrin monomer,FM),FM以半交错、重叠的方式自发地聚合,形成不稳定的可溶性纤维蛋白多聚体,进而在FXIIIa催化下共价交联,形成交联纤维蛋白多聚体[10, 11],即不可溶的纤维蛋白。交联纤维蛋白多聚体在纤溶酶的作用下降解生成大量复杂的长片段X-寡聚体(X-oligomer),这些长片段继续分解 生成含有由两个共价结合的D-结构域(D=D,相当于D-二聚体)的大小不一的片段组合,其最终末产物为D=D/E[3, 9, 1 2]。
纤溶酶作用于纤维蛋白原或者未交联的纤维蛋白不会产生D-二聚体,所以无交联纤维蛋白形成情况下发生的原发性纤溶亢进也不会产生D-二聚体。由于D-二聚体只在交联纤维蛋白降解时产生,因此D-二聚体可作为机体凝血活化和继发纤溶激活的标志物[13, 14]。纤维蛋白(原)降解产物(FDPs)是纤维蛋白原和(或)纤维蛋白被纤溶酶降解后大小不等片段产物的混合物,D-二聚体是否包含在内,取决于是否有交联纤维蛋白形成和被降解(图1)。
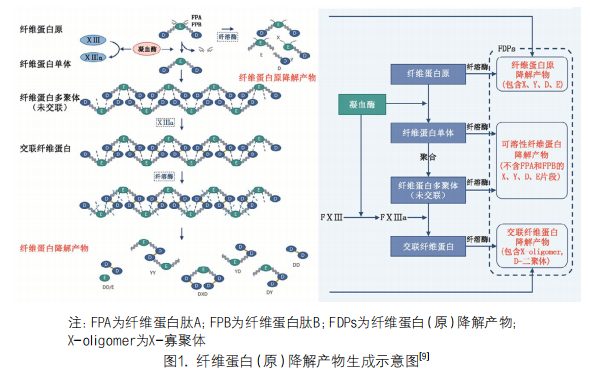
免疫法测定D-二聚体时,检测到的抗原不一定是单一D=D或D=D/E结构复合物,而是含有D-二聚体结构(D=D)的不同片段的混合物(相对分子质量为190,000~10,000,000)[11, 15]。另外,在正常生理状态下,约2%~3%的血浆纤维蛋白原转化为纤维蛋白,纤维蛋白的降解可产生少量的D-二聚体[9, 16]。D-二聚体在体内的半衰期约为8h,主要通过肾脏和网状内皮系统从循环中清除[13, 17]。
三、实验室检测
(一)检测方法
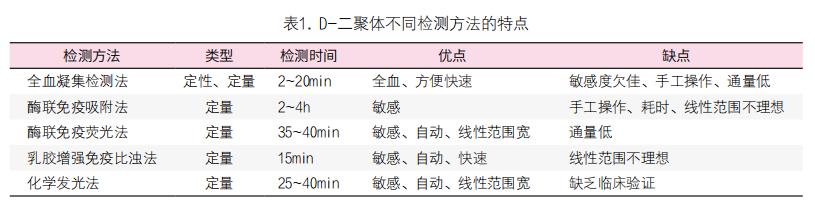
用单克隆抗体识别全血或血浆中的D-二聚体表位是D-二聚体检测的基本原理[9, 13]。目前临床 常用的商品化D-二聚体检测方法主要包括以下4种:全血凝集检测法、酶联免疫吸附法或酶联免疫荧光法、乳胶增强免疫比浊法及化学发光法[13-14, 18-20](表1)。根据试剂和检测系统对静脉血栓栓塞症(venous thromboembolism,VTE)的诊断效能,可分为高敏感 度(≥95%)和中等敏感度(80%~94%)两类[10]。
截至2023年5月,我国注册上市的D-二聚体检测试剂盒及校准品多达500余种(国家药品监督管理局网站查询)。不同检测系统间的D-二聚体结果缺乏可比性,即使是基于相同检测原理的不同试剂盒,检测结果也有差异[14]。这是由于:(1)D-二聚体尚未建立标准化溯源体系。尽管国际血栓与止血协会(International Society on Thrombosis and Haemostasis,ISTH)科学与标准化委员会(Scientific and Standardization Committee,SSC)一直致力于国际标准品的研制,但目前尚未实现[3, 21];(2)不同试剂盒选择的单克隆抗体对混合片段中D-二聚体的 亲合性不一致,校准品体系无法溯源[10];(3)报告单 位、正常参考区间(normal reference interval,NRI)及cut-off值的选择存在差异[2, 14]。因此,检验部门需与临床医师沟通,使其了解D-二聚体检测的性能特征及方法的局限性。
推荐意见1:(1)同一医疗机构应采用同一种D-二聚体检测方法(强推荐);(2)不同检测系统间D-二聚体检测结果难以相互比较,连续检测建议使用同一检测系统(强推荐);(3)检验工作者应熟悉 本实验室D-二聚体检测的方法、检测敏感度和阴性预测值等(强推荐)。
(二)质量要求与性能评价
1. 精密度:D-二聚体检测的不精密度以变异系数(CV)衡量。美国临床实验室和标准协会(Clinical Laboratory and Standards Institute,CLSI)发布的《用于VTE排除的D-二聚体定量批准指南》[22]和中国发布的《D-二聚体定量检测》行业标准[23]均推荐:D-二聚体检测的批内精密度要求:正常质控品或血浆标本的CV≤15%,异常质控品或血浆标本CV≤10%;D-二聚体检测的日间精密度CV≤15%,当D-二聚体用于VTE排除诊断时,cut-off值检测结果的日间精密度CV应≤7.5%。
2. 线性范围:因D-二聚体在不同疾病情况中的 升高幅度不同[3],D-二聚体线性范围应尽量宽广, 检测上限应尽量覆盖疾病所需浓度范围。
3. 敏感度及阴性预测值:根据D-二聚体检测结果排除VTE时,D-二聚体在cut-off值浓度水平处的敏感度应≥97%,阴性预测值应≥98%(可信区间的下限≥95%)[22, 23]。如果检测方法不够敏感,不能可靠地排除VTE时,实验室和临床均应知晓该测试不适用于此临床用途。
4. 交叉反应:D-二聚体检测试剂应不与其他FDPs 存在可变交叉反应[9]。
5. 生物变异度与样本保存:D-二聚体在离体后的血液样本中至少可以稳定24h,血浆存于-24℃~-74℃,可以至少稳定24个月[22]。使用冻存的血浆样本时,需要在37℃水浴中快速复融后再进行检测。
6. cut-off值:实验室应使用经临床验证的cut-off值,因为该诊断阈值在临床决策中起着至关重要的作用[9, 15]。
推荐意见2:(1)D-二聚体检测的批内精密度:正常质控品或血浆标本CV应≤15%,异常质控品或血浆标本CV应≤10%;日间精密度CV应≤15%,当D-二聚体用于VTE排除诊断时,应设置质控靶值水平在cut-off 值附近的室内质控,且cut-off值检测结果的日间精密度CV应≤7.5%(强推荐);(2)D-二聚体在cut-off值浓度水平处的敏感度应≥97%,阴性预测值应≥98%(可信区间的下限≥95%)(强推荐)。
(三)样本处理与分析影响因素
D-二聚体检测受众多因素影响,遇到可疑或与患者临床表现不相符的结果时,应综合考虑检验前、中、后的潜在影响因素。
1. 样本采集:可使用血浆或全血样本进行D-二聚体检测。单独的D-二聚体检测可选择柠檬酸盐、肝素或乙二胺四乙酸(EDTA)抗凝样本,但肝素和EDTA会影响凝血酶原时间、活化部分凝血活酶时间、凝血因子V、凝血因子VIII等的检测,而其常与D-二聚体共同送检。因此,目前CLSI和WHO推荐采用含3.2%(105~109 mmol/L)柠檬酸钠的抗凝血浆进行D-二聚体检测,血液与抗凝剂比例为9:1[24, 25]。
依照WS/T359-2011的要求采集血浆样本[26]。采样量偏低可能导致D-二聚体结果偏低,样本中有血凝块则可导致D-二聚体结果偏高。实验室在分析前及审核显著异常结果时应检查样本质量,以确保结果的准确性[27]。
2. 样本运送和处理:样本应在室温环境(15~22℃)下、尽可能短的时间内(通常<1h)转运至实 验室,样本测试前可于室温或4℃保存24h。对于 标本类型要求为血浆的检测系统,推荐以1500×g离心 15min获取乏血小板血浆[25]。提高离心力可缩短离心时间,有助于改善急诊样本周转时间,但实验室需验证所用离心条件的可靠性[28]。
3. 分析干扰物质:现有研究多数未发现一般程度的脂血、黄疸对D-二聚体检测有明显影响,但这些研究多基于某个特定的检测系统,不能代表所有检测系统[29-31]。严重的脂血可通过将血浆高速离心(例如室温下10,000×g离心10min)后吸取下层血浆的方法减少影响。不同原因造成的标本溶血对D-二聚体检测结果的影响各异,干扰程度也与检测方法学相关。尽管CLSI建议拒收所有溶血标本[25],但临床上大部分溶血标本的溶血程度不严重,实验室也缺乏手段来快速判断标本是否为体外溶血,因此标本中较低浓度的游离血红蛋白(Hb<3.0g/L)对D-二聚体检测的干扰一般是可接受的[32, 33]。对于此类标本的拒收原则建议结合制造商声明和实验室自己的质量规则或标准操作程序来确定。
类风湿因子可与检测试剂中的D-二聚体单克隆抗体结合,导致D-二聚体假性升高。风疹、带状疱疹等病毒感染后可引起机体产生嗜异性抗体,嗜异性抗体的存在可使基于免疫法检测所得的D-二聚体结果假性升高。当出现无法解释的D-二聚体升高时应怀疑嗜异性抗体干扰[34, 35]。嗜异性抗体阻断剂可消除该干扰,但不同品牌D-二聚体检测试剂中阻断剂的效力各异,实验室应了解所用试剂的抗嗜异性抗体干扰能力[36]。另外,与其他D-二聚体检测方法比较或同时检测FDPs 也有助于发现这类干扰[37]。
副蛋白血症(如多发性骨髓瘤、意义未明单克 隆免疫球蛋白血症)可能导致D-二聚体假阳性,但副蛋白对D-二聚体检测的影响存在个体化差异,某些患者体内的副蛋白对特定制造商使用的抗体具有特异性干扰[38, 39]。
此外,多种生理状态及药物的使用均可出现D-二聚体升高[13]。生理因素包括高龄、妊娠、剧烈运动后,药物因素包括应用血凝酶类药、降纤药、溶栓药、粒细胞集落刺激因子等,干扰因素包括样本体外凝血激活(血凝块形成)、类风湿因子、嗜异性抗体、副蛋白等。
推荐意见3:(1)实验室应根据所用D-二聚体检测系统的方法学、制造商声明和自己的验证结果来确定标本的拒收原则(强推荐);(2)解读D-二聚体检测结果时,应始终考虑样本因素、生理状态及药物的影响(强推荐)。
(四)结果报告
1. 报告方式:D-二聚体定量检测有两种报告单位,即纤维蛋白原等价单位(fibrinogen equivalent unit,FEU)和D-二聚体单位(D-dimer unit,DDU)。纤维蛋白原相对分子质量为340,000,D-二聚体相对分子质量为195,000,FEU和DDU之间存在约2倍的关系,例如500μg/L FEU≈250μg/L DDU,但该系数缺乏广泛验证,且会引入额外不确定因素,不推荐二者之间进行换算[22]。生产厂家通常在配套试剂说明书中会说明本试剂盒的报告方式。实验室在报告D-二聚体结果时,应选择厂家推荐的方式进行报告,并在报告单上明确标注。
2. 正常参考区间和cut-off值:正常参考区间数 据来源于正常健康人群,可由厂商试剂说明书提供或实验室自建,如选择使用来源于厂商提供的正常参考区间时,在使用前应进行验证。特定健康人群的D-二聚体结果偏高(如老年人、妊娠期女性),如有需要可建立特定人群的参考区间。D-二聚体cut-off值一般特指用于VTE排除诊断的最佳截断值,来自D-二聚体对疑似VTE患者诊断价值的前瞻性队列研究,其数值多与正常参考区间上限不同,例如某试剂参考区间为 0~420μg/L,但cut-off值为500μg/L,实验室和临床进行D-二聚体报告解读和应用时应注意区分。由于临床进行D-二聚体检测的目的多样,因此建议在D-二聚体报告时使 用正常参考区间,同时推荐在报告中注明当前试剂用于VTE排除诊断的相应cut-off值,例如:本室D-二聚体检测用于VTE排除的cut-off值是500μg/L FEU。
3. 计量单位:一项国内关于实验室D-二聚体报告的调查显示,目前有多种D-二聚体测量单位或其等价单位应用于临床[40],例如μg/L(等效ng/ml)或mg/L(等效μg/ml),不同量级间的差异常给临床带来困扰。基于应用现状及规范化趋势,推荐使用μg/L或mg/L作为D-二聚体的计量单位,如500μg/L FEU相当于0.5mg/L FEU。若 D-二聚体与FDPs同时报告,两者单位应尽量统一。
推荐意见4:(1)实验室应使用来源明确且经本地验证的正常参考区间,同时标注当前检测系统用于VTE排除诊断的cut-off值(强推荐);(2)使用μg/L或mg/L作为D-二聚体的测量单位,FDPs测量单位应与 D-二聚体统一(推荐);(3)D-二聚体报告应提供的要素包括:正常参考区间、VTE排除诊断cut-off值(如已验证)、报告方式(FEU或DDU)和计量单位(μg/L、mg/L)(推荐)。
四、临床应用
(一)D-二聚体在VTE中的应用
1. VTE通用定义:VTE包括深静脉血栓(deep venous thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)。DVT是血液在深静脉内不正常凝结引起的静脉回流障碍性疾病,常发生于下肢,导致腿部肿胀和疼痛。PE多是由于DVT血栓脱落(通常来自下肢深静脉系统)阻塞肺动脉或其分支引起[41]。PE和DVT具有相同易患因素,是VTE在不同阶段、不同部位的两种临床表现形式。
2. D-二聚体用于下肢DV的排除诊断:发生下肢DVT时,血液中D-二聚体的浓度升高。患者近期有手术、严重外伤、骨折或肢体制动、长期卧床、肿瘤等病史,出现下肢肿胀、疼痛、小腿后方和(或)大腿内侧有压痛时,下肢DVT的可能性较大;但当患者无明显血栓发生的诱因,仅表现为下肢肿胀或症状不典型时,易出现漏诊、误诊[42, 43]。根据临床DVT的可能性进行验前概率评分(多采用Wells评分),Wells评分将患有DVT的临床可能性分为高度、中度、低度[44](表2)。对于Wells评分低度可能性的患者[45],先行D-二聚体检测,阴性(低于cut-off值)则排除DVT,阳性者进一步行血管超声检查;Wells评分中度、高度临床可能性的患者,首选血管超声检查。下肢DVT的诊断流程见图2[46]。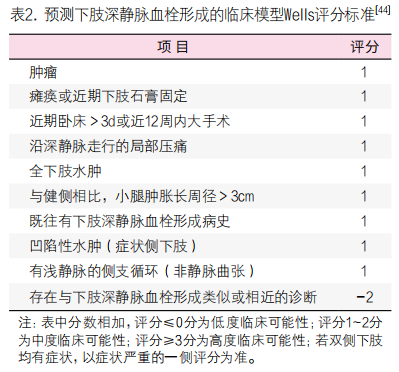

推荐意见5:(1)对于无明显血栓发生诱因、临床症状和体征不典型、Wells评分为低度临床可能的患者,高敏感度D-二聚体定量检测阴性的结果可排除DVT,阳性者推荐进一步行血管超声检查;对于血栓发病因素明显、症状体征典型、Wells评分为中、高度可能的患者,首选血管超声检查(强推荐);(2)D-二聚体应满足推荐意见2中的要求(强推荐)。
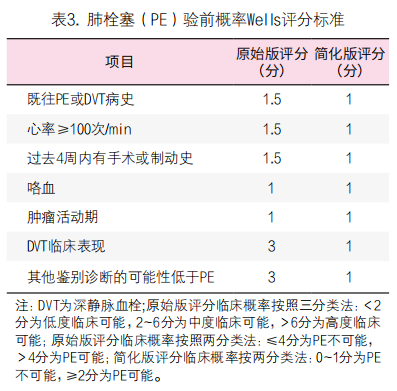
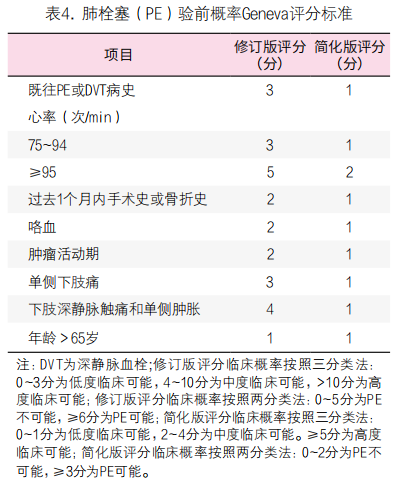
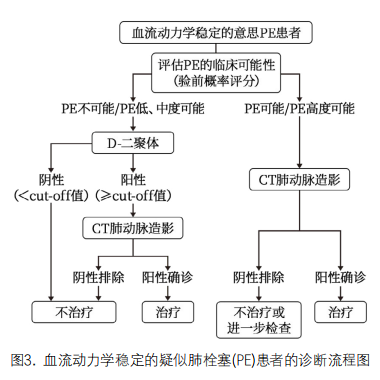
3. D-二聚体用于PE的排除诊断[47-49]:D-二聚体对血流动力学稳定、疑似PE患者的诊断非常关键。首先应用Wells评分(原始版或简化版)或校正的Geneva评分(修订版或简化版)对血流动力学稳定的患者进行PE的临床可能性评估(表3, 4)。基于PE 验前概率评分,推荐中、低度临床可能性的患者进行高敏感度D-二聚体检测,阴性(低于cut-off值)者可排除PE,阳性者进一步行CT肺动脉造影(CTPA)检查,明确PE的诊断。对临床可能(两分类法)或高度可能(三分类法)疑似PE的患者,推荐直接行CTPA检查,以明确PE的诊断(图3)。对于血流动力学不稳定的疑似PE患者,D-二聚体可不作为初始诊断的必要检查。
推荐意见6:(1)应基于临床经验或临床可能性(Wells评分或校正的Geneva评分)联合D-二聚体检测进行急性PE的筛查。临床评估中、低度可能的患者,高敏感度D-二聚体定量检测结果阴性可除外PE,如D-二聚体阳性,建议进一步行确诊检查,如CTPA(强推荐);(2)D-二聚体应满足推荐意见2中的要求(强推荐)。
4. D-二聚体用于VTE诊断年龄校正的cut-off值:D-二聚体排除VTE的阴性预测值很高,故其cut-off值的确定至关重要。血浆D-二聚体水平随年龄增加而逐渐增高,多项研究表明,与固定的cut-off值相比,年龄校正的cut-off值可显著提高50岁以上VTE患者的阴性排除效率[50-54]。2019年欧洲心脏病学会(European Society of Cardiology,ESC)肺栓塞指南建议50岁以上中、低度临床可能性患者,应采用年龄校正的cut-off值(年龄×10μg/L FEU)[49]。例如年龄72岁,适用的cut-off值为720μg/L FEU。
推荐意见7:对于年龄50岁以上的低度VTE临床可能性患者,应采用年龄校正的cut-off值(年龄×10μg/L FEU),低于cut-off值者为阴性(推荐)。
(二)D-二聚体在急性主动脉夹层(acute aortic dissection。AAD)中的应用
AAD是指人体大动脉(主动脉)的内层形成溃疡或裂口,血液从裂口涌入,导致主动脉内层和中层分离形成夹层的一类急性疾病[55]。AAD患者的血液可在夹层中凝固形成假腔内血栓,引起D-二聚体升高。AAD发病急,死亡率高,临床表现多种多样,易与急性冠状动脉综合征(acute coronary syndromes,ACS)、PE等严重疾病混淆,因此早期快速诊断或排除诊断对挽救AAD 患者的生命极为重要。
1. D-二聚体阴性用于低度临床可能AAD的排除诊断:一项纳入1850例患者的多中心研究显示,D-二聚体阴性结合AAD验前概率评分为低度临床可能性,对AAD的阴性预测值可达到99.7%[56]。一项纳入437例疑似AAD患者前瞻性队列研究的 系统综述显示,D-二聚体结果<100μg/L FEU可100%排除AAD[57]。一项关于中国人群的研究显示,在纳入的260例疑似AAD患者中,D-二聚体阴性对AAD的阴性预测值可达到99.2%[58]。因此,与在VTE中的应用类似,结合验前概率评分,临床评估为低度可能性,结合D-二聚体的阴性结果可以用于AAD的排除诊断[55]。
2. D-二聚体用于胸痛患者的快速判断:基于AAD的发病机制,假腔内血栓的形成可使D-二聚体显著升高。有研究发现在急诊胸痛的患者中,D-二聚体>1600μg/L对AAD诊断有一定的提示价值,尽管D-二聚体水平升高不能区分AAD和PE,但可以帮助快速判断是否需要行紧急胸部CT扫描,以确认或排除这两种疾病[59]。
AAD患者容易误诊为ACS。对有胸痛表现的患者,心电图+肌钙蛋白+D-二聚体有助于进行快速鉴别,并判断是否需要进一步的影像学检查。例如,有报告显示对伴有主动脉夹层征象的胸痛患者,正常心电图+正常肌钙蛋白+D-二聚体水平升高的组合,高度提示为 AAD,而不太可能是ACS[60]。
此外,临床低度可能性患者D-二聚体阴性可以排除AAD;而临床高度可能性患者,即便D-二聚体测试结果阴性,仍然不能排除AAD,应直接进行CT血管造影[55, 61]。
推荐意见8:(1)临床低度可能性患者D-二聚 体阴性可以排除AAD;而临床高度可能性患者,应直接进行CT血管造影,D-二聚体结果阴性不能排除AAD(推荐);(2)D-二聚体升高可用于AAD的辅助诊断,与其他检查联合用于胸痛患者的鉴别诊断和指导下一步诊疗(弱推荐)。
(三)D-二聚体在弥散性血管内凝血 (disseminated intravascular coagulation,DIC)中的应用
1. DIC:是在许多疾病基础上,致病因素损伤微血管体系,导致凝血激活,全身微血管血栓形成、凝血因子大量消耗并继发纤溶亢进,引起以出血及微循环衰竭为特征的临床综合征[62-65]。DIC发病凶险,死亡率高[1, 66],及时诊断DIC对此类患者具有重要意义。
2. D-二聚体在DIC诊断中的应用:多种病理生理因素均可导致D-二聚体升高,单独D-二聚体检测并不适宜用于DIC的诊断,但正常的D-二聚体可以排除 DIC[67]。整体的凝血实验对于DIC的诊断是有意义的,包括凝血时间、血小板计数、纤维蛋白相关标志物(fibrin-related markers,FRMs)等。ISTH推荐强调实验室标志物的显性DIC标准,增加了D-二聚体作为除FDPs之外的另一种FRMs,同时将是否患有相关的潜在疾病作为诊断的前提[62, 68];D-二聚体或纤维蛋白降解产物:中度增加为2分,显著增加为3分;结合潜在疾病的风险评估及血小板计数、凝血酶原时间、纤维蛋白原积分,总分≥5分判定为显性DIC。但在临床应用中,如何判断D-二聚体的增加幅度给临床带来困惑,在Suzuki等[69]的研究中,将ISTH显性DIC诊断标准中D-二聚体>3.0μg/ml计为2分,D-二聚体>7.0μg/ml计为3分,并将DIC评分的cut-off值降低至4分,以获得判定DIC的高敏感度和高特异度。2017年中国弥散性血管内凝血诊断积分系统(Chinese Disseminated Intravascular Coagulation Scoring System,CDSS)强调在基础疾病和临床表现基础上,结合实验室指标(血小板计数、凝血酶原时间及活化部分凝血活酶时间、D-二聚体、纤维蛋白原)进行CDSS积分,根据 评分结果诊断DIC;非恶性血液病:每日计分1次,≥7分时可诊断为DIC,其中D-二聚体<5mg/L计为0分、5~<9mg/L计为2分、≥9mg/L计为3分[65]。在一项多中心前瞻性的研究中,CDSS对于DIC的诊断和预测28d全因死亡在不同组中的受试者工作特征(ROC)曲线下面积(AUC)均>0.8,并显示出较高敏感度和特异度[70]。如前所述,目前D-二聚体的检测难以标准化,不同检测系统的结果间存在较大差异,因此每个检测系统应评估其相应的诊断DIC的cut-off值。此外,对DIC患者进行D-二聚体的连续监测也可为疾病进行性变化提供临床证据,从而指导临床评估和调整治疗策略。
推荐意见9:(1)不建议D-二聚体单独用于DIC的诊断,应结合其他凝血指标和血小板计数联合评估(推荐);(2)建议实验室评估或验证其所用D-二聚体检测系统相应的诊断DIC的cut-off值(推荐);(3)连续动态监测DIC患者的D-二聚体水平可为临 床管理提供依据(推荐)。
(四)D-二聚体在新型冠状病毒感染(COVID-19)中的应用
COVID-19患者因内皮损伤、凝血系统激活以及纤溶抑制,可表现为以高凝为主的凝血紊乱,纤维蛋白过度生成(血栓形成)可致循环微血管和(或)大血管堵塞,继而导致多器官功能障碍[71]。荟萃分析结果表明,COVID-19住院患者VTE发生率可达21.6%~35.4%;与未发生VTE患者相比,发生VTE的COVID-19患者死亡风险升高2倍以上[72]。
D-二聚体水平升高是COVID-19相关凝血病最常见的特征[73]。D-二聚体预测COVID-19患者VTE风险的价值已被大量临床研究证实,例如法国的一项多中心研究显示,D-二聚体升高(>3000μg/L)和白细胞计数升高(≥12.0×109/L)并存时与PE显著相关[74]。在众多临床实验室指标中,D-二聚体具有最高的 VTE 预测价值[75]。除了感染急性期,有研究显示D-二聚体峰值水平较高(>3000μg/L)的COVID-19患者,治愈出院后发生VTE的风险也要升高约4倍[76]。
除预测VTE之外,多项研究表明COVID-19患者入院时D-二聚体水平与病情进展密切相关,高水平D-二聚体往往提示较差的预后,甚至死亡[77]。作为应对策略,多个随机对照研究表明,在D-二聚体升高的非危重症COVID-19住院患者中,与预防剂量相比,给予治疗剂量肝素抗凝能够增加患者存活率[78-80];而在D-二聚体升高的出院患者中,应用预防剂量直接口服抗凝药(direct oral anticoagulants,DOAC)或称为非维生素K拮抗剂口服抗凝药(non-vitamin K Antagonist oral anticoagulants,NOAC)30d,可降低致死性和非致死性VTE发生率,而不增加出血风险[81]。据此,ISTH指南推荐在D-二聚体升高、出血风险低的非危重COVID-19 患者中,应用治疗剂量低分子肝素或普通肝素;而在 COVID-9患者出院后,仍有D-二聚体升高者,可考虑应用30d预防剂量的NOAC[82]。
此外,一些研究证实D-二聚体水平升高是 COVID-19疫苗接种后疫苗诱导的血小板减少和血栓形成的重要预测因子[83]。总之,D-二聚体检测在COVID-19中有预后评估、VTE 风险评估、抗凝治疗指导等多方面的应用价值,但其针对各种应用的合适cut-off值和成本效益尚需明确。
推荐意见10:(1)建议将D-二聚体作为COVID-19 患者入院常规筛查项目之一,入院时的D-二聚体水平有助于评估疾病严重程度和预后(强推荐);(2)建议定期监测住院COVID-19患者D-二聚体水平,显著升高的D-二聚体(如>3000μg/L)提示VTE风险增加,需考虑排查VTE及给予血栓预防措施(推荐);(3)对于D-二聚体升高、出血风险低的非危重型COVID-19住院患者,应用治疗剂量低分子肝素或普通肝素优于预防剂量(推荐);(4)COVID-19住院患者出院后,仍有D-二聚体升高者应用30d预防剂量DOAC(如利伐沙班)优于不给予抗凝药物(推荐)。
(五)D-二聚体在抗凝治疗中的应用
1. 预测口服抗凝治疗患者的不良预后:抗凝治疗可降低D-二聚体水平,VTE患者急性期后抗凝期间若D-二聚体阳性,其后续血栓复发风险是D-二聚体阴性患者的2~3倍。对于房颤患者,D-二聚体可以预测口服抗凝药治疗过程中的心血管事件。一项对269例房颤患者随访2年左右的前瞻性研究显示,口服华法林治疗期间,国际标准化比值(international normalized ratio,INR)达标患者中约23%表现出D-二聚体水平异常,二出现D-二聚体水平异常的患者发生血栓事件和合并心血管事件的风险分别是D-二聚体水平正常患者的15.8倍和7.64倍[84]。两项大型国际多中心、双盲、随机对照研究发现,无论是接受维生素K拮抗剂(VKA),还是NOAC抗凝的房颤患者,D-二聚体水平与抗凝过程中的不良事件风险呈正相关[85, 86]。一项入选618例机械瓣膜置换术患者的长期随访研究显示,机械瓣膜置换术后华法林抗凝期间D-二聚体水平异常者发生不良事件的风险约是正常者的5倍,多因素回归分析证实D-二聚体水平是抗凝期间血栓或心血管事件的独立预测因子[87]。因此,D-二聚体可以预测口服抗凝药治疗过程中的不良事件。
2. 指导VTE患者口服抗凝药的停药与延长治疗:一项纳入528例受试者的前瞻性研究显示,VTE患者在接受3个月抗凝治疗后,D-二聚体水平正常患者的血栓复发风险低,可以安全停药;水平异常患者则建议继续抗凝治疗[88]。这一结论也得到了后续一项包含410例受试者的多中心队列研究的验证[89]。
VTE患者抗凝治疗的最佳时限目前尚无定论,相关指南建议抗凝治疗3个月后根据血栓和出血风险高低,决定是否延长抗凝,而D-二聚体检测可以为此提供更加个体化的信息。一项纳入7项研究、共计1818例受试者的荟萃分析显示,D-二聚体异常是VTE患者血栓复发的主要预测因子之一[90]。D-二聚体目前已被列入多个VTE复发风险预测模型,如HERDOO2、DASH、Vienna模型等。
也有研究发现D-二聚体指导下的抗凝治疗获益存在一定的性别差异,在女性人群中的获益显著高于男性,男性无获益[89]。
3. 指导VTE患者停药后是否需要恢复抗凝治疗:一项纳入619例受试者的多中心、前瞻性随机对照临床研究(PROLONG研究)发现,在VTE患者停止抗凝后1个月检测D-二聚体水平,其中227例(36.7%)患者D-二聚体表现为阳性,将此227例患者随机分为恢复抗凝组和不恢复抗凝组,结果显示相较于不恢复抗凝组患者,恢复抗凝组患者VTE复发风险显著降低[91]。因此该研究建议VTE患者停药后1个月检测D-二聚体,若结果阳性,建议恢复抗凝。后续完成的PROLONG II研究进一步发现,VTE患者停药1个月检测D-二聚体,阴性患者此后应每2个月检测1次D-二聚体;如果D-二聚体结果 异常,血栓复发风险依然高于持续阴性的停药患者,建议恢复抗凝[92]。
推荐意见11:(1)D-二聚体可用于评估口服抗凝药治疗患者的预后(推荐);(2)D-二聚体可用于判断VTE患者是否需要延长抗凝及是否需要恢复抗凝(推荐)。
(六)D-二聚体在肿瘤中的应用
1. D-二聚体与肿瘤患者VTE风险评估:肿瘤患者血栓形成风险增加,VTE是肿瘤患者第二大死因[93]。基于常规cut-off值的D-二聚体水平对VTE诊断的特异性较差[94, 95]。D-二聚体可用于中到低临床可能性患者VTE的排除,然而在肿瘤患者中,尽管有研究表明设定D-二聚体年龄相关cut-off值有助于将肿瘤VTE排除比例提高1倍[96],但迄今的研究和指南仍不提倡将D-二聚体用于肿瘤VTE的排除[94, 97]。
一些研究表明,D-二聚体与肿瘤患者VTE风险相关[98, 99]。既往有一种经验证的风险评估模型(Khorana评分),包括肿瘤部位、血小板计数、白细胞计数、化疗前血红蛋白水平、促红细胞生成素的使用和体质指数,已用于评估肿瘤患者VTE的风险[100]。而有研究证实在该评分系统中增加D-二聚体水平的测定可以进一步提高VTE风险预测能力[101]。
2. D-二聚体与肿瘤筛查及预后判断:肿瘤引起的凝血激活与肿瘤的生长密切相关。在没有血栓形成的乳腺癌、前列腺癌、肺癌及妇科肿瘤患者中即可能存在D-二聚体水平升高[102]。组织因子是激活外源性途径的关键因子,在肿瘤转移和进展中起着至关重要的作用。因此,D-二聚体水平升高可能是组织因子异常活跃的结果,这提示一般人群中出现不明原因的D-二聚体升高时,要考虑对肿瘤的排查。
远处转移是肿瘤患者预后不良的主要原因[103],凝血与纤溶激活伴随肿瘤生长、转移、血栓形成和血管生成全过程[104]。荟萃分析表明不同类型实体肿瘤患者治疗前血浆D-二聚体升高与不良生存率相关[105],因此,血浆D-二聚体水平可能有助于评估肿瘤患者的预后。
除了肿瘤,D-二聚体升高可见于多种临床状况,仍需更多研究数据以明确D-二聚体在不同类型肿瘤筛查、预后判断中的敏感度与特异度,以及D-二聚体是否可以整合到一些肿瘤分期系统中。
推荐意见12:(1)由于排除效率较低,不提倡将 D-二聚体常规用于肿瘤患者VTE的排除(推荐);(2)D-二聚体与其他临床因素结合,可用于肿瘤患者VTE风险的评估(推荐);(3)肿瘤治疗前,D-二聚体结果有助于实体肿瘤患者的预后评估(弱推荐)。
(七)D-二聚体在妊娠期中的应用
妊娠期受激素水平等影响,血液中纤维蛋白原、FVII等凝血因子水平增加,抗凝蛋白活性降低,使机体呈现出高凝倾向以减少母体分娩时的出血[106],因此,妊娠期健康女性D-二聚体可生理性增 高,且水平随孕周的增加而逐渐上升[107]。妊娠期D-二聚体的正常参考区间不同于正常人群,有部分 研究建立了针对不同妊娠周期的D-二聚体参考区间[107, 108],但受采血时机不同、人群选择偏倚、检测平台差异等多种因素影响,目前尚无广泛接受的妊娠期D-二聚体正常参考区间。
研究显示,妊娠期间VTE风险增加4~5倍[109]。由于妊娠期正常的生理性D-二聚体增高与VTE导致的病理性增高重叠,妊娠期间VTE的临床诊断仍然具有挑战性。多项研究应用YEARS算法(临床评估是否存在DVT的临床表现、咯血和高度疑似PE)结合D-二聚体的检测来排除妊娠期PE,若YEARS算法中各项均不符合,D-二聚体<1000ng/ml可排除PE,即使YEARS算法临床评估1项及1项以上符合,但D-二聚体<500ng/ml也可排除PE,使用YEARS算法结合D-二聚体可以减少影像学检查和辐射暴露[110-113]。但目前由于D-二聚体水平在不同检测系统中存在较大的差异,在临床应用过程中应谨慎。
五、结语
因D-二聚体尚未实现标准化,在临床应用过程中,检验部门需与临床医师紧密沟通,使其了解所使用D-二聚体试剂和检测方法的性能及局限性,并在特定临床背景下对检测结果进行解释。D-二聚体除在上述疾病中具有重要的检测价值之外,在其他疾病和临床情况下如溶栓治疗、重症、ACS等的风险评估中也具有重要意义,但需要未来更多的循证医学证据支持。
共识制定专家组
组长:周洲(中国医学科学院阜外医院实验诊断中心)
执笔者(按姓氏汉语拼音排序):华潞(中国医学科学院阜外医院呼吸和肺血管病中心);唐宁(华中科技大学同济医学院附属同济医院检验科);许俊堂(北京大学人民医院心内科);张李涛(武汉亚洲心脏病医院检验中心);张洋(中国医学科学院阜外医院实验诊断中心);张真路(武汉亚洲心脏病医院检验中心);周静(四川大学华西医院检验科);周洲(中国医学科学院阜外医院实验诊断中心)
专家组成员(按姓氏汉语拼音排序):戴菁(上海交通大学医学院附属瑞金医院检验科);翟振国(中日友好医院呼吸 与危重症医学科);江虹(四川大学华西医院检验科);李传保(北京医院检验科);李登举(华中科技大学附属同济医院血液科);梁岩(中国医学科学院阜外医院重症医学科);陆林(上海交通大学医学院附属瑞金医院心内科);梅恒(华中科技大学同济医学院附属协和医院血液科);乔蕊(北京大学第三医院检验科);屈晨雪(北京大学第一医院检验科);宋鉴清(中国医科大学附属第一医院检验科);孙艺红(中日友好医院心脏科);宋景春(解放军联勤保障部队第908医院重症医学科);王学锋(上海交通大学医学院附属瑞金医院检验科);吴俊(北京积水潭医院检验科);易群(四川大学华西医院呼吸与危重症医学科);袁慧(首都医科大学附属北京安贞医院检验科);张大庆(中国医科大学附属盛京医院心内科);张磊(西安交通大学第二附属医院检验科)
利益冲突:所有作者声明不存在利益冲突
本文是《D-二聚体实验室检测与临床应用中国专家共识》文章的二次发表(全文)
参考文献
[1]Wada H, Matsumoto T, Hatada T. Diagnostic criteria and laboratory tests for disseminated intravascular coagulation[J]. Expert Rev Hematol, 2012, 5(6): 643-652. DOI: 10.1586/ehm.12.57.
Lippi G, Tripodi A, Simundic AM, etal. International survey on D-dimer test reporting: a call for standardization[J]. Semin Thromb Hemost, 2015, 41(3): 287-293. DOI: 10.1055/s-0035-1549092.
Olson JD. D‐dimer: an overview of hemostasis and fibrinolysis, assays, and clinical applications[J]. Adv Clin Chem, 2015, 69: 1-46. DOI: 10.1016/bs.acc.2014.12.001.
Shah K, Quaas J, Rolston D, et al. Magnitude of D‐dimer matters for diagnosing pulmonary embolus[J]. Am J Emerg Med, 2013, 31(6): 942-945. DOI: 10.1016/j. ajem.2013.03.009.
Stang LJ. D-dimer and fibrinogen/fibrin degradation products[J]. Methods Mol Biol, 2013, 992:415-427. DOI: 10.1007/978-1-62703-339-8_34.
Favaloro EJ, Dean E. Variability in D-dimer reporting revisited[J]. Pathology, 2021, 53(4): 538-540. DOI: 10.1016/j.pathol.2020.08.010.
Favaloro EJ, Thachil J. Reporting of D-dimer data in COVID-19: some confusion and potential for misinformation[J]. Clin Chem Lab Med, 2020, 58(8):1191-1199. DOI: 10.1515/cclm-2020-0573.
Olson JD, Cunningham MT, Higgins RA, etal. D-dimer: simple test, tough problems[J]. Arch Pathol Lab Med, 2013, 137(8): 1030-1038. DOI: 10.5858/arpa. 2012-0296-CP.
Thachil J, Lippi G, Favaloro EJ. D-dimer testing: laboratory aspects and current issues[J]. Methods Mol Biol, 2017, 1646:91-104. DOI: 10.1007/978-1-4939-7196-1_7.
Weitz JI, Fredenburgh JC, Eikelboom JW. A test in context: D-dimer[J]. J Am Coll Cardiol, 2017, 70(19): 2411-2420. DOI: 10.1016/j.jacc.2017.09.024.
Adam SS, Key NS, Greenberg CS. D-dimer antigen: current concepts and future prospects[J]. Blood, 2009, 113(13): 2878-2887. DOI: 10.1182/blood-2008-06-165845.
Sidelmann JJ, Gram J, Jespersen J, etal. Fibrin clot formation and lysis: basic mechanisms[J]. Semin Thromb Hemost, 2000, 26(6): 605-618. DOI: 10.1055/s-2000-13216.
Favresse J, Lippi G, Roy PM, et al. D-dimer: preanalytical, analytical, postanalytical variables, and clinical applications[J]. Crit Rev Clin Lab Sci, 2018, 55(8): 548-577. DOI: 10.1080/10408363.2018.1529734.
Riley RS, Gilbert AR, Dalton JB, et al. Widely used types and clinical applications of D-dimer assay[J]. Lab Med, 2016, 47(2): 90-102. DOI: 10.1093/labmed/lmw001.
Reber G, Moerloose PD. Standardization of D-dimer testing[M]. Chichester: John Wiley & Sons, Ltd, 2009.
Graeff H, Hafter R. Detection and relevance of crosslinked fibrin derivatives in blood[J]. Semin Thromb Hemost, 1982, 8(1): 57-68. DOI: 10.1055/s-2007-1005042.
Hager K, Platt D. Fibrin degeneration product concentrations (D-dimers) in the course of ageing[J]. Gerontology, 1995, 41(3): 159-165. DOI: 10.1159/ 000213677.
linkins LA, Takach Lapner S. Review of D-dimer testing: good, bad, and ugly[J]. Int J Lab Hematol, 2017, 39 Suppl 1: 98-103. DOI: 10.1111/ijlh.12665.
Mountain D, Jacobs I, Haig A. The VIDAS D-dimer test for venous thromboembolism: a prospective surveillance study shows maintenance of sensitivity and specificity when used in normal clinical practice[J]. Am J Emerg Med, 2007, 25(4): 464-471. DOI: 10.1016/j.ajem.2006.09.004.
Lippi G, Ippolito L, Russello T, etal. Analytical performance of the new ACL AcuStar HemosIL D-dimer [J]. Blood Coagul Fibrinolysis, 2012, 23(2): 164-167. DOI: 10.1097/MBC.0b013e32834ee1a6.
Bevan S, Longstaff C. Is it possible to make a common reference standard for D-dimer measurements? Communication from the ISTH SSC Subcommittee on Fibrinolysis[J]. J Thromb Haemost, 2022, 20(2): 498-507. DOI: 10.1111/jth.15555.
Clinical and Laboratory Standards Institute. Quantitative D-dimer for the exclusion of venous thromboembolic disease:approved guideline[S]. Wayne, PA: CLSI, 2011.
中华人民共和国国家卫生和计划生育委员会. WS/T 477-2015 D-二聚体定量检测[S]. 北京: 中国标准出版社, 2015.
Funk DA. Sample integrity and preanalytical variables[M]. Chichester: John Wiley & Sons, Ltd, 2013.
Clinical and Laboratory Standards Institute. Collection, transport, and processing of bloodspecimens for testingplasma-based coagulationassays and molecular hemostasis assays[S]. Wayne, PA: CLSI, 2008.
中华人民共和国卫生部. WS/T 359-2011血浆凝固实验血液标本的采集及处理指南[S]. 北京:中国标准出版社, 2011.
Magnette A, Chatelain M, Chatelain B, et al. Pre-analytical issues in the haemostasis laboratory: guidance for the clinical laboratories[J]. Thromb J, 2016, 14: 49. DOI: 10.1186/s12959-016-0123-z.
Boudaoud L, Divaret G, Marie P, et al. Rapid centrifugation for routine coagulation testing[J]. Ann Biol Clin (Paris), 2006, 64(4):315-317.
Pittet JL, de Moerloose P, Reber G, et al. VIDAS D-dimer: fast quantitative ELISA for measuring D-dimer in plasma [J]. Clin Chem, 1996, 42(3):410-415.
La′ulu SL, Dominguez CM, Roberts WL. Performance characteristics of the AxSYM D-dimer assay[J]. Clin Chim Acta, 2008, 390(1-2): 148-151. DOI: 10.1016/j. cca. 2008.01.019.
Park SJ, Chi HS, Chun SH, et al. evaluation of performance including influence by interfering substances of the Innovance D-dimer assay on the Sysmex coagulation analyzer[J]. Ann Clin Lab Sci, 2011, 41(1):20-24.
Lippi G, Avanzini P, Zobbi V, et al. Influence of mechanical hemolysis of blood on two D-dimer immunoassays[J]. Blood Coagul Fibrinolysis, 2012, 23(5): 461-463. DOI: 10.1097/MBC.0b013e3283549696.
Lippi G, Blanckaert N, Bonini P, etal. Haemolysis: an overview of the leading cause of unsuitable specimens in clinical laboratories[J]. Clin Chem Lab Med, 2008, 46(6): 764-772. DOI: 10.1515/CCLM.2008.170.
Gardiner C, Pennaneac′h C, Mackie IJ, etal. Falsely elevated D-dimer results in a healthy patient on account of heterophiletul antibodies[J]. Br J Haematol, 2003, 122(5): 871-873. DOI: 10.1046/j. 1365-2141.2003.04515. x.
Rouvière JA, Devignes J, de Maistre E, et al. Discrepancy between two methods of D-dimers measurement: one case of human anti-mouse antibody interference[J]. Ann Biol Clin (Paris), 2008, 66(4): 441-446. DOI: 10.1684/ abc.2008.0247.
Uys F, O′Neill M, Farina Z, et al. Case report[J]. S Afr Med J, 2023, 113(2): 57-60. DOI: 10.7196/SAMJ. 2023. v113i2. 16832.
Favresse J, Burlacu MC, Maiter D, et al. Interferences with thyroid function immunoassays: clinical implications and detection algorithm[J]. Endocr Rev, 2018, 39(5):830-850. DOI: 10.1210/er.2018-00119.
Huang H, Li H, Li D. Effect of serum monoclonal protein concentration on haemostasis in patients with multiple myeloma[J]. Blood Coagul Fibrinolysis, 2015, 26(5): 555-559. DOI: 10.1097/MBC.0000000000000296.
Roller RE, Lahousen T, Lipp RW, et al. Elevated D-dimer results in a healthy patient[J]. Blood Coagul Fibrinolysis, 2001, 12(6): 501-502. DOI: 10.1097/00001721-200109000-00012.
彭明婷, 周文宾, 李臣宾, 等. D-二聚体实验室检测现状与 规范化[J]. 中华医学杂志, 2015, 95(34): 2740-2743. DOI: 10.3760/cma.j.issn.0376-2491.2015.34.002.
Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis[J]. Lancet, 2012, 379(9828): 1835-1846. DOI: 10.1016/S0140-6736(11)61904-1.
Kyrle PA, Eichinger S. Deep vein thrombosis[J]. Lancet, 2005, 365(9465): 1163-1174. DOI: 10.1016/S0140- 6736(05)71880-8.
Di Nisio M, van Es N, Büller HR. Deep vein thrombosis and pulmonary embolism[J]. Lancet, 2016, 388(10063): 3060-3073. DOI: 10.1016/S0140-6736(16)30514-1.
Wells PS, Anderson DR, Rodger M, et al. evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis[J]. N Engl J Med, 2003, 349(13):1227-1235. DOI: 10.1056/NEJMoa023153.
Geersing GJ, Zuithoff NP, Kearon C, et al. Exclusion of deep vein thrombosis using the Wells rule in clinically important subgroups: individual patient data meta-analysis[J]. BMJ, 2014, 348: g1340. DOI: 10.1136/ bmj.g1340.
中华医学会外科学分会血管外科学组. 深静脉血栓形成的 诊断和治疗指南(第三版)[J]. 中华普通外科杂志, 2017, 32(9): 807-812. DOI: 10.3760/cma.j.issn.1007-631X. 2017.09.032.
中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. DOI: 10.3760/cma.j.issn.0376-2491. 2018.14.007.
《中国血栓性疾病防治指南》专家委员会. 中国血栓性疾病 防治指南[J]. 中华医学杂志, 2018, 98(36): 2861-2888. DOI: 10.3760/cma.j.issn.0376-2491.2018.36.002.
Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) [J]. Eur Heart J, 2020, 41(4): 543-603. DOI: 10.1093/eurheartj/ehz405.
Douma RA, Tan M, Schutgens RE, etal. Using an age-dependent D-dimer cut-off value increases the number of older patients in whom deep vein thrombosis can be safely excluded[J]. Haematologica, 2012, 97(10): 1507-1513. DOI: 10.3324/haematol.2011.060657.
Nybo M, Hvas AM. Age-adjusted D-dimer cut-off in the diagnostic strategy for deep vein thrombosis: a systematic review[J]. Scand J Clin Lab Invest, 2017, 77(8): 568-573. DOI: 10.1080/00365513.2017.1390783.
Arnautovic JZ, Yamasaki H, Rosman HS. Multiple embolic strokes as a result of libman-sacks endocarditis associated with lupus and secondary antiphospholipid antibody syndrome: a case report[J]. Eur Heart J Case Rep, 2018, 2(3): yty094. DOI: 10.1093/ehjcr/yty094.
De Pooter N, Brionne-François M, Smahi M, etal. Age-adjusted D-dimer cut-off levels to rule out venous thromboembolism in patients with non-high pre‐test probability: clinical performance and cost-effectiveness analysis[J]. J Thromb Haemost, 2021, 19(5): 1271-1282. DOI: 10.1111/jth.15278.
Han C, Zhao Y, Cheng W, etal. The performance of age‐adjusted D-dimer cut-off in Chinese outpatients with suspected venous thromboembolism[J]. Thromb Res, 2015, 136(4): 739-743. DOI: 10.1016/j. thromres. 2015. 07.024.
Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on clinical practice guidelines[J]. Circulation, 2022, 146(24): e334-e482. DOI: 10.1161/CIR. 0000000000001106.
Nazerian P, Mueller C, Soeiro AM, etal. Diagnostic accuracy of the aortic dissection detection risk score plus D-dimer for acute aortic syndromes: the ADvISED prospective multicenter study[J]. Circulation, 2018, 137(3): 250-258. DOI: 10.1161/CIRCULATIONAHA. 117. 029457.
Sodeck G, Domanovits H, Schillinger M, et al. D-dimer in ruling out acute aortic dissection: a systematic review and prospective cohort study[J]. Eur Heart J, 2007, 28(24):3067-3075. DOI: 10.1093/eurheartj/ehm484.
Fan QK, Wang WW, Zhang ZL, et al. evaluation of D-dimer in the diagnosis of suspected aortic dissection[J]. Clin Chem Lab Med, 2010, 48(12):1733-1737. DOI: 10.1515/ CCLM.2010.337.
Suzuki T, Distante A, Zizza A, et al. Diagnosis of acute aortic dissection by D-dimer: the international registry of acute aortic dissection substudy on biomarkers (IRAD-Bio) experience[J]. Circulation, 2009, 119(20): 2702-2707. DOI: 10.1161/CIRCULATIONAHA. 108. 833004.
Vilacosta I, San Román JA, di Bartolomeo R, et al. Acute aortic syndrome revisited: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2021, 78(21): 2106-2125. DOI: 10.1016/ j.jacc.2021.09.022.
Erbel R, Aboyans V, Boileau C, et al. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases[J]. Kardiol Pol, 2014, 72(12): 1169-1252. DOI: 10.5603/ KP.2014.0225.
Taylor FB Jr, Toh CH, Hoots WK, et al. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation[J]. Thromb Haemost, 2001, 86(5):1327-1330.
Wada H, Thachil J, Di Nisio M, et al. Guidance for diagnosis and treatment of DIC from harmonization of the recommendations from three guidelines[J]. J Thromb Haemost, 2013. DOI: 10.1111/jth.12155.
“D-二聚体检测”急诊临床应用专家共识组“. D-二聚体检 测”急诊临床应用专家共识[J]. 中华急诊医学杂志, 2013, 22(8):827-836. DOI: 10.3760/cma.j.issn.1671-0282.2013. 08.003.
中华医学会血液学分会血栓与止血学组. 弥散性血管内凝 血诊断中国专家共识(2017年版) [J]. 中华血液学杂志, 2017, 38(5):361-363. DOI: 10.3760/cma.j.issn.0253-2727. 2017.05.001.
Papageorgiou C, Jourdi G, Adjambri E, et al. Disseminated intravascular coagulation: an update on pathogenesis, diagnosis, and therapeutic strategies[J]. Clin Appl Thromb Hemost, 2018, 24(9_suppl): 8S-28S. DOI: 10.1177/ 1076029618806424.
Zheng X, Chen S, Zhang F, et al. Use of fibrin monomer and D-Dimer in assessing overt and nonovert disseminated intravascular coagulation[J]. Blood Coagul Fibrinolysis, 2021, 32(4): 248-252. DOI: 10.1097/MBC. 0000000000001025.
Iba T, Levy JH, Wada H, et al. Differential diagnoses for sepsis-induced disseminated intravascular coagulation: communication from the SSC of the ISTH[J]. J Thromb Haemost, 2019, 17(2): 415-419. DOI: 10.1111/jth.14354.
Suzuki K, Wada H, Imai H, et al. A re-evaluation of the D-dimer cut-off value for making a diagnosis according to the ISTH overt-DIC diagnostic criteria: communication from the SSC of the ISTH[J]. J Thromb Haemost, 2018, 16(7): 1442-1444. DOI: 10.1111/jth.14134.
Wu Y, Luo L, Niu T, et al. evaluation of the new Chinese disseminated intravascular coagulation scoring system in critically ill patients: a multicenter prospective study[J]. Sci Rep, 2017, 7(1): 9057. DOI: 10.1038/s41598-017-09190-5.
费阳, 唐宁. 凝血检验在新型冠状病毒肺炎凝血病中的应用 [J]. 中华医学杂志, 2021, 101(25): 2008-2012. DOI: 10.3760/cma.j.cn112137-20210222-00460.
Lippi G, Mullier F, Favaloro EJ. D-dimer: old dogmas, new (COVID-19) tricks[J]. Clin Chem Lab Med, 2023, 61(5): 841-850. DOI: 10.1515/cclm-2022-0633.
Tang N, Li D, Wang X, etal. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia[J]. J Thromb Haemost, 2020, 18(4): 844-847. DOI: 10.1111/jth.14768.
Galland J, Thoreau B, Delrue M, et al. White blood count, D-dimers, and ferritin levels as predictive factors of pulmonary embolism suspected upon admission in noncritically ill COVID-19 patients: the French multicenter CLOTVID retrospective study[J]. Eur J Haematol, 2021, 107(2):190-201. DOI: 10.1111/ejh. 13638.
Riyahi S, Hectors SJ, Prince MR, et al. Predictors of acute deep venous thrombosis in patients hospitalized for COVID-19[J]. Medicine (Baltimore), 2021, 100(38): e27216. DOI: 10.1097/MD.0000000000027216.
Li P, Zhao W, Kaatz S, et al. Factors associated with risk of postdischarge thrombosis in patients with COVID-19[J]. JAMA Netw Open, 2021, 4(11):e2135397. DOI: 10.1001/ jamanetworkopen.2021.35397.
Varikasuvu SR, Varshney S, Dutt N, et al. D-dimer, disease severity, and deaths (3D-study) in patients with COVID-19: a systematic review and meta-analysis of 100 studies[J]. Sci Rep, 2021, 11(1):21888. DOI: 10.1038/ s41598-021-01462‐5.
Spyropoulos AC, Goldin M, Giannis D, et al. Efficacy and safety of therapeutic-dose heparin vs standard prophylactic or intermediate-dose heparins for thromboprophylaxis in high-risk hospitalized patients with COVID-19: the HEP-COVID randomized clinical trial [J]. JAMA Intern Med, 2021, 181(12): 1612-1620. DOI: 10.1001/jamainternmed.2021.6203.
Lawler PR, Goligher EC, Berger JS, etal. Therapeutic anticoagulation with heparin in noncritically ill patients with COVID-19[J]. N Engl J Med, 2021, 385(9): 790-802. DOI: 10.1056/NEJMoa2105911.
Sholzberg M, Tang GH, Rahhal H, et al. Effectiveness of therapeutic heparin versus prophylactic heparin on death, mechanical ventilation, or intensive care unit admission in moderately ill patients with COVID-19 admitted to hospital: RAPID randomised clinical trial[J]. BMJ, 2021, 375:n2400. DOI: 10.1136/bmj.n2400.
Giannis D, Allen SL, Tsang J, etal. Postdischarge thromboembolic outcomes and mortality of hospitalized patients with COVID-19: the CORE‐19 registry[J]. Blood, 2021, 137(20): 2838-2847. DOI: 10.1182/blood. 2020010529.
Schulman S, Sholzberg M, Spyropoulos AC, etal. ISTH guidelines for antithrombotic treatment in COVID-19[J]. J Thromb Haemost, 2022, 20(10): 2214-2225. DOI: 10. 1111/jth.15808.
Lippi G, Favaloro EJ. Cerebral venous thrombosis developing after COVID-19 vaccination: VITT, VATT, TTS, and more[J]. Semin Thromb Hemost, 2022, 48(1): 8-14. DOI: 10.1055/s-0041-1736168.
Sadanaga T, Sadanaga M, Ogawa S. Evidence that D-dimer levels predict subsequent thromboembolic and cardiovascular events in patients with atrial fibrillation during oral anticoagulant therapy[J]. J Am Coll Cardiol, 2010, 55(20): 2225-2231. DOI: 10.1016/j. jacc. 2009. 12.049.
Siegbahn A, Oldgren J, Andersson U, et al. D-dimer and factor VII a in atrial fibrillation-prognostic values for cardiovascular events and effects of anticoagulation therapy. A RE-LY substudy[J]. Thromb Haemost, 2016, 115(5):921-930. DOI: 10.1160/TH15-07-0529.
Christersson C, Wallentin L, Andersson U, et al. D-dimer and risk of thromboembolic and bleeding events in patients with atrial fibrillation-observations from the ARISTOTLE trial[J]. J Thromb Haemost, 2014, 12(9): 1401-1412. DOI: 10.1111/jth.12638.
张李涛, 龙艳丽, 杨军, 等. D-二聚体水平与机械心脏瓣膜置换术后患者抗凝治疗中发生临床事件的关系[J]. 中华心血管病杂志, 2017, 45(10): 852-856. DOI: 10.3760/cma. j. issn.0253-3758.2017.10.008.
Palareti G, Cosmi B, Legnani C, et al. D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study[J]. Blood, 2014, 124(2):196-203. DOI: 10.1182/blood-2014-01-548065.
Kearon C, Spencer FA, O′Keeffe D, et al. D-dimer testing to select patients with a first unprovoked venous thromboembolism who can stop anticoagulant therapy: a cohort study[J]. Ann Intern Med, 2015, 162(1): 27-34. DOI: 10.7326/M14-1275.
Tosetto A, Iorio A, Marcucci M, et al. Predicting disease recurrence in patients with previous unprovoked venous thromboembolism: a proposed prediction score (DASH) [J]. J Thromb Haemost, 2012, 10(6): 1019-1025. DOI: 10.1111/j.1538-7836.2012.04735.x.
Palareti G, Cosmi B, Legnani C, et al. D-dimer testing to determine the duration of anticoagulation therapy[J]. N Engl J Med, 2006, 355(17): 1780-1789. DOI: 10.1056/ NEJMoa054444.
Cosmi B, Legnani C, Tosetto A, etal. Usefulness of repeated D‐dimer testing after stopping anticoagulation for a first episode of unprovoked venous thromboembolism: the PROLONG II prospective study[J]. Blood, 2010, 115(3): 481-488. DOI: 10.1182/blood-2009- 08-237354.
Prandoni P, Lensing AW, Piccioli A, et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis[J]. Blood, 2002, 100(10): 3484-3488. DOI: 10.1182/blood-2002-01-0108.
Carrier M, Lee AY, Bates SM, etal. Accuracy and usefulness of a clinical prediction rule and D-dimer testing in excluding deep vein thrombosis in cancer patients[J]. Thromb Res, 2008, 123(1): 177-183. DOI: 10.1016/j.thromres.2008.05.002.
Merminod T, Pellicciotta S, Bounameaux H. Limited usefulness of D-dimer in suspected deep vein thrombosis of the upper extremities[J]. Blood Coagul Fibrinolysis, 2006, 17(3):225-226. DOI: 10.1097/01.mbc.0000220248. 04789.79.
Wilts IT, Le Gal G, Den Exter PL, et al. Performance of the age-adjusted cut-off for D-dimer in patients with cancer and suspected pulmonary embolism[J]. Thromb Res, 2017, 152:49-51. DOI: 10.1016/j.thromres.2017.02.007.
Zwicker JI, Connolly G, Carrier M, etal. Catheter-associated deep vein thrombosis of the upper extremity in cancer patients: guidance from the SSC of the ISTH[J]. J Thromb Haemost, 2014, 12(5): 796-800. DOI: 10.1111/jth.12527.
Kodama J, Seki N, Masahiro S, et al. D-dimer level as a risk factor for postoperative venous thromboembolism in Japanese women with gynecologic cancer[J]. Ann Oncol, 2010, 21(8):1651-1656. DOI: 10.1093/annonc/mdq012.
Ferroni P, Martini F, Portarena I, et al. Novel high-sensitive D-dimer determination predicts chemotherapy-associated venous thromboembolism in intermediate risk lung cancer patients[J]. Clin Lung Cancer, 2012, 13(6): 482-487. DOI: 10.1016/j.cllc.2012. 03.005.
Khorana AA, Kuderer NM, Culakova E, et al. Development and validation of a predictive model for chemotherapy-associated thrombosis[J]. Blood, 2008, 111(10): 4902-4907. DOI: 10.1182/blood-2007-10-116327.
Ay C, Dunkler D, Marosi C, et al. Prediction of venous thromboembolism in cancer patients[J]. Blood, 2010, 116(24): 5377-5382. DOI: 10.1182/blood‐2010-02-270116.
Hanna DL, White RH, Wun T. Biomolecular markers of cancer‐associated thromboembolism[J]. Crit Rev oncol Hematol, 2013, 88(1): 19-29. DOI: 10.1016/j. critrevonc. 2013.02.008.
Thaler J, Ay C, Mackman N, et al. Microparticle-associated tissue factor activity, venous thromboembolism and mortality in pancreatic, gastric, colorectal and brain cancer patients[J]. J Thromb Haemost, 2012, 10(7): 1363-1370. DOI: 10.1111/j.1538-7836.2012.04754.x.
Sakurai M, Satoh T, Matsumoto K, et al. High pretreatment plasma D-dimer levels are associated with poor prognosis in patients with ovarian cancer independently of venous thromboembolism and tumor extension[J]. Int J Gynecol Cancer, 2015, 25(4): 593-598. DOI: 10.1097/IGC. 0000000000000415.
Li W, Tang Y, Song Y, et al. Prognostic role of pretreatment plasma D-dimer in patients with solid tumors: a systematic review and meta-analysis[J]. Cell Physiol Biochem, 2018, 45(4): 1663-1676. DOI: 10.1159/ 000487734.
Othman M, Pradhan A. Laboratory testing of hemostasis in pregnancy: a brief overview[J]. Methods Mol Biol, 2023, 2663:111-125. DOI: 10.1007/978-1-0716-3175-1_7.
Szecsi PB, Jørgensen M, Klajnbard A, et al. Haemostatic reference intervals in pregnancy[J]. Thromb Haemost, 2010, 103(4):718-727. DOI: 10.1160/TH09-10-0704.
Xu Q, Dai L, Chen HQ, et al. Specific changes and clinical significance of plasma D-dimer during pregnancy and puerperium: a prospective study[J]. BMC Pregnancy Childbirth, 2023, 23(1): 248. DOI: 10.1186/s12884-023-05561-1.
Speed V, Roberts LN, Patel JP, etal. Venous thromboembolism and women′s health[J]. Br J Haematol, 2018, 183(3): 346-363. DOI: 10.1111/bjh.15608.
van der Hulle T, Cheung WY, Kooij S, etal. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study[J]. Lancet, 2017, 390(10091): 289-297. DOI:10.1016/S0140-6736(17)30885-1.
van der Pol LM, Tromeur C, Bistervels IM, etal. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism[J]. N Engl J Med, 2019, 380(12):1139-1149. DOI: 10.1056/NEJMoa1813865. Langlois E, Cusson-Dufour C, Moumneh T, et al. Could the YEARS algorithm be used to exclude pulmonary embolism during pregnancy? Data from the CT-PE-pregnancy study[J]. J Thromb Haemost, 2019, 17(8):1329-1334. DOI: 10.1111/jth.14483.Goodacre S, Nelson-Piercy C, Hunt BJ, et al. Accuracy of PE rule-out strategies in pregnancy: secondary analysis of the DiPEP study prospective cohort[J]. Emerg Med J, 2020, 37(7): 423-428. DOI: 10.1136/emermed-2019-209213.




