血栓与止血临床诊疗问题

杨军,主任技师,副教授。现任武汉亚洲心脏病医院/武汉亚心总医院血栓止血实验室副主任,武汉亚洲心脏病医院/武汉亚心总医院查房检验医师;武汉江汉大学卫生技术学院副教授。学术兼职:中国检验医师学会心血管分会专家委员,中国医学装备学会检验医学分会血栓与出血性疾病检验学组委员,中国研究型医院学会血栓止血分会专家委员,中国医药教育协会血栓与止血危重病专业委员会常委,武汉市非公立医疗机构协会武汉检验专业委员会委员。从事临床检验33年。在国内外发表署名论文30余篇。现研究方向:心血管疾病的抗栓(凝)治疗及监测。
一、血小板减低的原因?
答:血小板减低通常是指PLT<100×109/L。其原因很复杂,大致可以分为:1)骨髓/脏器功能异常导致的血小板生成/破坏性减少(血液系统疾病、肝脏疾病、脾功能亢进等);2)血栓形成导致的血小板消耗性减少(APS、AMI、DIC、DVT、PE、严重感染等);3)血管内植入装置导致机械性破坏增加性血小板减少(ECMO、IABP、CRRT、左心室辅助装置等);4)药物导致的血小板自身抗体形成性血小板减少(肝素、替罗非班、利奈唑胺、疫苗等);5)微血管血栓形成性血小板减少(ITP、TTP、HUS等)。
在分析血小板减少原因之前首先要明确3个问题:(1)血小板减低是真实的吗?是否排除了假性血小板减低(EDTA诱导的血小板聚集、血小板卫星现象、冷凝集、采血不顺利等原因);(2)血小板减低是最近新发的还是既往一直都是减少的?新发的血小板减少代表着病情发生变化或与治疗方式相关,是我们要重点关注的(也是本文重点讨论的)。既往一直都是低的,可能与脏器功能或营养状况相关;(3)是否还存在其他共病(APS、妊娠等)?
血小板减低的原因分析到目前为止还没有最优化的流程。但我们可以遵循“先考虑常见疾病,后考虑少见疾病;先做常规检测,后做困难检测”的思路进行分析。首先可以通过病史采集(包括既往史)与体格检查(必要时进行骨髓穿刺或影像学检查),确定或排除肿瘤(包括白血病)或放化疗治疗与脾大对血小板计数的影响。其次观察有无侵入性的操作(外科手术、ECMO等)来判断对血小板计数的影响。但要注意,外科术后的3-5天血小板有反应性下降。第三,通过实验室连续监测FDP、DD、TAT等指标判断有无血栓形成。必要时检测APS指标(LA、CA、b2-GPI),判断获得性易栓症。第四,通过患者体温变化、影像学图像、感染性指标(PCT、IL-6、CRP等)判断患者是否存在重度感染导致的血小板减少。第五,如果考虑药物诱导的血小板减少,要关注药物的暴露时间及血小板减少的特点来判断。HIT是在肝素暴露的5-10天后,血小板缓慢下降,但一般不会降到极低(PLT>20×109/L)。替罗非班或利奈唑胺是在暴露后的24-48小时内血小板开始下降,并且呈断崖式下降,血小板可以降到极低(PLT<10×109/L)。HIT可以检测PF4抗体筛查。其他药物导致的可以通过停药或换药,5-7天后血小板可以恢复。最后,考虑微血管血栓形成(ITP、TTP等),可以通过检测ADAMTS-13、F-HB、LDH、血小板抗体及观察红细胞碎片等指标判断。但在临床实践中,往往是两个或多个影响因素交织在一起(如:ECMO合并HIT合并重度感染),增加了判断难度,所以必须仔细观察,勤于监测,及时对症处理,才能保证患者安全。
二、重症患者未用华法林的,为何PT/INR不断增高?
答:PT/INR是衡量FII、FVII、FIX、FX因子的活性,而这些因子全部在肝脏合成且依赖Vitamin K的参与。体内的Vitamin K主要由2个来源:外源性(饮食)和内源性(胃肠道正常菌群产生)。重症患者由于治疗需要(插管、气管切开等),往往不能自主进食,依赖胃肠饲养或静脉营养,这些营养液中基本不含Vitamin K,导致外源性Vitamin K缺乏。其次重症患者合并不同程度的感染,使用抗生素(以舒普深为代表)破坏肠道正常菌群,使内源性的Vitamin K也不能产生。三是重症患者的脏器功能受损(特别是肝脏功能不良),导致这些因子合成能力下降。以上3个因素导致重症患者的PT/INR在没有使用华法林的情况下增高。处理对策是适时静脉补充Vitamin K和护肝治疗。
三、患者入院后D-Dimer一直很稳定(低水平),但突然明显增高,
影像学检查未见血栓,也未表现血栓形成后的症状,原因有哪些?
答:D-Dimer是纤溶活化的产物,也是止血/血栓形成的继发性产物。当患者入院后D-Dimer一直很稳定(低水平),但突然明显增高,首先要确认有无出血表现(腹腔、胸腔、心包、胃肠道等部位)。如果有出血(血红蛋白有下降),机体有止血反应,D-Dimer也会增高,此时抗凝应慎重。其次要判断是否有纤溶活化,可检测TAT/PIC或其他纤溶指标。如果存在纤溶活化,酌情给予氨甲环酸进行抗纤溶即可。
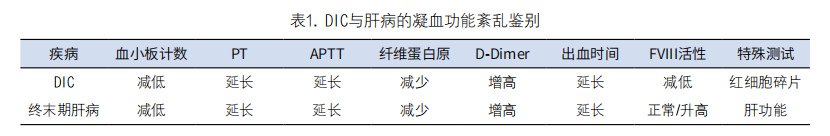
四、DIC与肝病凝血功能紊乱之间如何鉴别?
答:DIC与肝病凝血功能紊乱之间存在高度的相似性,使临床鉴别存在困难(见表),但可以从临床表现与实验室指标中进行鉴别。首先是DIC的凝血功能紊乱是用原发性疾病无法解释的。而肝病的病因是直接的—肝肿瘤、肝硬化、病毒性肝炎、门脉高压等。其次,DIC是凝血因子全系列的消耗性降低。而肝病只是肝脏合成的凝血因子减低,肝外产生的凝血因子水平正常或升高(FVIII为代表),通过检测FVIII活性可以进行鉴别。第三,DIC往往伴随不同程度的出血表现,患者的出血风险极高,需要迅速干预治疗。而肝病的凝血功能紊乱与出血风险无关(形成了脆弱的凝血平衡),患者无出血表现或极轻微,宜采取观察策略。
五、肝素抗凝效果不佳为哪般?
答:肝素进入体内,通过激活血液中的抗凝血酶(AT)活性(约调高2000倍)来达到抗凝作用。肝素抗凝效果不佳时,首先需要检测AT活性。如果AT活性<50%,肝素的作用下降一半。如果AT活性<30%,肝素则完全不能发挥作用。临床处理对策是:补充新鲜冰冻血浆(FFP),提升AT活性(但要注意循环容量的压力)。或者是更换抗凝药物,使用不依赖AT的抗凝药物(如:阿加曲班、比伐卢定等)。
其次是急性时相反应蛋白(FVIII、CRP、Fib、HBP等)增高时,肝素的作用会被抑制。特别是肝素结合蛋白(HBP),它由中性粒细胞产生,能特异性的与肝素结合,使肝素不能与AT结合而失去抗凝作用。在感染性疾病的发作期,增高的中性粒细胞能产生大量的HBP,使肝素无法发挥作用。同时HBP还能破坏血管内皮细胞的糖萼层,使肌体发生严重的炎性渗出、水肿等炎性反应。临床处理对策是:更换抗凝药物,使用不依赖AT的抗凝药物(如:阿加曲班、比伐卢定等)。同时强化抗感染治疗。第三,临床上确实存在无法解释的肝素无效现象,约占肝素无效事件的15%左右,具体的机制目前还不清楚。临床处理对策是:更换抗凝药物。




