免疫介导溶血患者血栓发生机制与促血栓危险因素中血栓发生
【摘要】自身免疫性溶血性贫血是一种罕见的异质性疾病,其特征是溶血,这是公认的血栓形成的危险因素。最常见的免疫介导性贫血表现为自身免疫性溶血性贫血和阵发性睡眠性血红蛋白尿,两者都与血栓形成率高有关。血栓形成的多种病理生理机制已被提出,包括溶血本身和免疫系统的额外作用。尽管人们越来越意识到这些情况下有血栓形成的风险,但依然缺乏血栓事件预防和管理的循证指导。我们在此报告了免疫介导的溶血中血栓形成和易栓症形成的现有流行病学数据,以及可能的潜在病理生理机制。此外,我们总结了目前治疗免疫介导的溶血性血栓形成的建议。特别是,我们提出通过一种治疗算法来解决血栓性并发症的治疗和预防问题,重点关注脾切除术和妊娠等特定情况。
【关键词】溶血性贫血;阵发性夜间血红蛋白尿;血栓形成;抗凝血剂;易血栓形成。
溶血是动静脉血栓形成的公认风险因素,无论其发病的根本原因是什么。血栓形成风险的增加与各种红细胞溶血性疾病有关,如血红蛋白病、红细胞膜障碍和免疫介导的溶血性贫血。多种病理生理机制已经被提出,包括全身性炎症、一氧化氮清除、血管性血友病因子改变,所有这些都继发于血浆游离血红蛋白、血红素和铁水平的升高,以及红细胞源性的凝血酶原微泡的释放。免疫介导的溶血,即自身免疫性溶血性贫血(AIHA)和阵发性睡眠性血红蛋白尿(PNH),这与上述其他红细胞溶血性疾病相比,其血栓形成率更高,这是免疫系统额外作用的结果。尽管人们越来越认识到免疫介导的溶血形成的血栓风险,但缺乏在血栓事件预防和管理上的循证指导。在本文论述中,将介绍免疫介导的溶血和促血栓危险因素中血栓发生率的流行病学数据,以及可能导致血栓形成的病理生理机制。此外,将审查当前的临床管理,并提出诊断和治疗方法,特别关注了特定情况,如脾切除术和妊娠。
一、免疫介导的溶血中静脉或动脉血栓形成的发生率和危险因素
AIHA是一组罕见的异质性疾病(每10万人/年1-3例),其特征是存在对抗红细胞自身抗原的自身抗体,并可能导致包括血栓形成在内的各种危及生命的并发症。在20世纪60年代首次有证据表明11%的AIHA患者发生肺栓塞后,这些患者出现高凝状态,越来越多的报告将血栓表现作为AIHA的标志,因为10-20%的患者经历了动脉或静脉血栓事件(表1)。此外,据报道,21例接受低分子肝素抗血栓预防的AIHA患者中有一例发生致命肺栓塞。一项关于AIHA患者血栓并发症的文献综述显示,474例患者(12.7%)发生了60次血栓形成(44次静脉血栓和16次动脉血栓,包括深静脉血栓形成、肺栓塞、急性心肌梗死、卒中和短暂性脑缺血发作)。两项单中心回顾性研究显示,40例(20%)和48例(23%)AIHA患者中分别有8例和11例发生静脉血栓栓塞事件。在最近对378例AIHA患者的回顾性分析中,58例患者(15%)发生静脉血栓形成,死亡率没有增加。最近的一项文献综述证实了这些数据,该文献显示AIHA患者的静脉血栓栓塞率在0%-27%之间。冷凝集素病(CAD)是AIHA的一种特殊形式,其中致病性自身抗体以冷凝集素为代表,通过经典的补体途径激活引发溶血。关于CAD患者血栓形成风险及其对死亡率影响的流行病学数据有限,但最近一项基于人群和为期10年的回顾性队列研究报告称,与非CAD患者相比,血栓形成事件的风险增加了约两倍,随访时间更短,提示血栓性事件患者的潜在死亡风险增加。在一项II期研究中显示,尽管随访期太短(不到一年),无法得出重要结论,但依库珠单抗治疗与无血栓栓塞事件有关。在PNH中,补体途径不受控制的激活会导致慢性血管内溶血,导致危及生命的并发症,尤其是血栓形成,这是最常见的死亡原因,占死亡人数的67%。据报道,无论溶血状态如何,血栓形成的发生率都很高,大约5-10%的PNH患者会出现血栓形成。静脉血栓形成比动脉血栓形成更频繁,主要发生在内脏或脑静脉等不寻常部位。国际PNH注册中心(NCT01374360)的最新报告显示,4134例患者中有544例(13.2%)有血栓事件史,这是目前进行的最大的PNH多中心研究。PNH患者发生VTE的风险仍然很高,接受抗血栓预防的患者也是如此。相比之下,在195例PNH患者的队列中,采用依库珠单抗作为PNH的首选治疗方法,血栓事件的相对风险降低了85%(治疗组为1.07例/100患者/年,而非治疗组为7.37例/100患者/年)。在56%的患者中,这一比率增加到94%(0.62vs10.61例/100患者/年)。尽管血栓患者在接受依库珠单抗治疗后总生存率降低(HR4.48),但血栓形成的死亡率也相应降低。
在可能的情况下,还报告了血栓形成的部位和抗血栓预防的使用(见表1)。
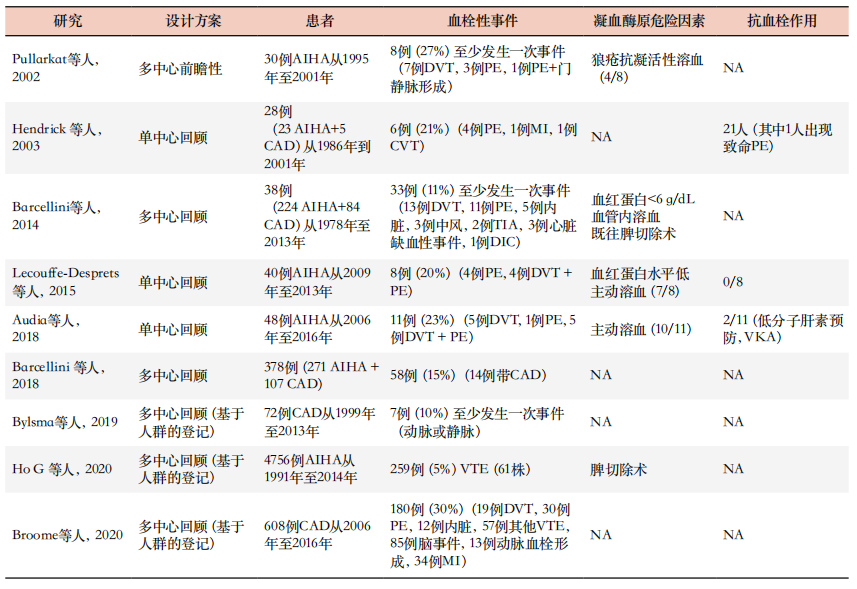
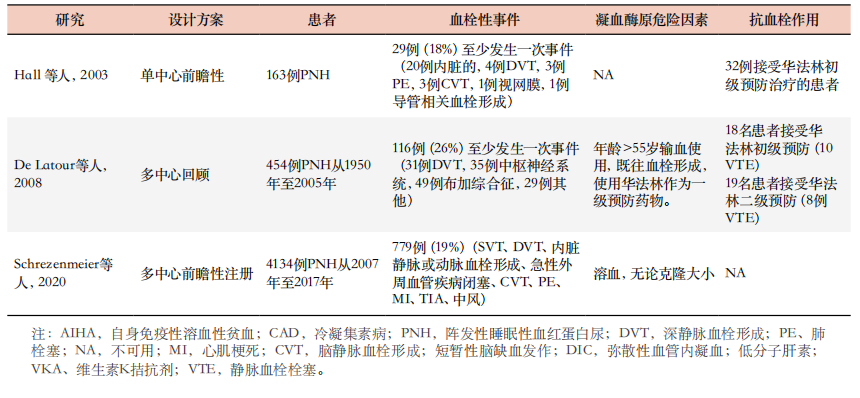
表1. AIHA、CAD和PNH血栓形成风险的大多数相关研究
血栓形成的危险因素似乎与溶血本身特别相关,因为大多数血栓形成事件都是在活动期被报道的。事实上,严重贫血(Hb<8.5g/dL)和高乳酸脱氢酶水平(众所周知的溶血标志物)与血栓形成风险增加有关。在这些患者中,需要考虑是否存在未确诊的恶性肿瘤(可能与AIHA有关)或其他常见的获得性血栓形成风险因素。抗磷脂抗体(APA)也被认为是血栓形成的可能风险因素,但结果不确定。脾切除术是静脉血栓形成的另一个重要危险因素,无论是术后立即还是术后90天,其风险比分别为2.66(95%CI 1.36-5.23)和3.29(95%CI 2.10-5.16),这是迄今为止进行的最大规模的基于人群的研究所报告。
二、免疫介导的溶血中血栓形成的病理生理学
免疫介导的溶血性贫血和血栓形成之间的联系是多因素的,其机制远远超出了免疫系统的激活范围。众所周知,溶血本身,无论其病因如何,都可能导致内皮功能障碍和血小板活化,从而引发凝血级联反应。另一方面,免疫病因的特殊机制在免疫介导的溶血性贫血(如PNH)中是激活血栓形成的关键。
1. 溶血性贫血血栓形成的非免疫相关机制:尽管Virchow三要素(血管壁异常、血流停滞和高凝状态)指的是静脉血栓形成,但目前的知识也支持将其转化为动脉血栓形成。在溶血性贫血中,主要由于非免疫机制,Virchow三要素的所有成分都会被触发。值得一提的是磷脂酰丝氨酸暴露于红细胞(RBC)表面,受损红细胞释放游离血红蛋白和血红素,以及红细胞来源的微泡脱落(见图1)。将溶血与血栓形成联系起来的主要病理生理机制如图所示,红细胞表面的磷脂酰丝氨酸暴露;受损红细胞释放的游离血红蛋白和血红素;红细胞衍生的微泡脱落。
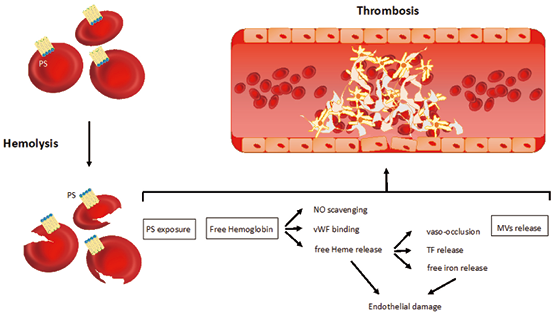
图1. 溶血性贫血血栓形成的非免疫相关机制
注:PS,磷脂酰丝氨酸;NO,一氧化氮;vWF,血管性血友病因子;TF,组织因子;MVs,微泡。
(1)磷脂酰丝氨酸暴露凝血级联的激活需要足够的凝血酶原表面来正确组装凝血酶原复合物。传统上认为,该表面主要由活化血小板膜上带负电荷的磷脂酰丝氨酸提供。然而,最近的研究表明,红细胞在提供触发凝血所需的磷脂酰丝氨酸方面也发挥了作用。事实上,被溶血损伤的红细胞可能会失去其膜不对称性,暴露出通常位于质膜内层的磷脂酰丝氨酸,从而激活凋亡信号以去除受损细胞。尽管这种机制在先天性溶血性贫血(如β地中海贫血和镰状细胞贫血)中得到更深入的描述,但在AIHA患者中也显示出可能的作用。
(2)游离血红蛋白和血红素释放在溶血性贫血中,血红蛋白和血红素作为血管内溶血的产物释放,并以不同的方式导致内皮细胞的活化。特别是,细胞外血红蛋白作为一种强一氧化氮(NO)清除剂,将其从循环中隔离出来。正常情况下,NO从完整的内皮表面释放,并作为生理性内源性血小板抑制剂。溶血性贫血的血浆NO耗竭也可以通过与游离血红蛋白无关的其他机制来解释。特别是精氨酸酶,受损红细胞释放的酶之一,切割L-精氨酸,降低其作为NO合成所需底物的生物利用度。血红蛋白还通过间接机制降低NO的生物利用度,通过cGMP依赖性信号阻止NO介导的血小板活化抑制,从而增强血小板活化。此外,血浆NO水平的降低决定了一些抗血栓功能的丧失,如血管舒张、随后维持血管稳态和抑制细胞因子诱导的组织因子表达。
游离血红蛋白也可能通过与血管性血友病因子(vWF)的相互作用而增加血栓形成的风险。首先,血红蛋白可以直接与vWF结合,增加vWF A1结构域对血小板表面糖蛋白Ib受体的亲和力,从而引发血小板聚集。其次,血红蛋白与vWF A2结构域结合,使vWF不易被ADAMTS13蛋白水解,从而形成具有高凝血酶原潜力的超大vWF多聚体。
急性溶血,通过游离血红蛋白,可能导致内脏循环中的微血管停滞,从而增加凝血激活的风险。然而,根据一项在小鼠体内的研究,血红蛋白通过释放其氧结合域血红素,间接激活了这一过程。后者可能通过toll样受体4诱导储存在内皮细胞Weibel-Palade体内的凝血酶原P-选择素和vWF的释放。这些数据证明血红素失活后,通过与高亲和力血红素结合蛋白结合抑制血管闭塞和内皮损伤。此外,游离血红素可以通过组织因子在内皮细胞表面的表达,通过核因子κB转录因子的激活,诱导凝血酶的产生。血红素也被认为是低密度脂蛋白氧化的可能介质,促进内皮细胞损伤和动脉粥样硬化形成,从而增加动脉血栓形成的风险。血红素在动脉血栓形成中的作用也得到了临床前研究的证实,其中血红素氧化酶1诱导剂血红素通过激活血红素降解,对微血管和颈动脉闭塞具有保护作用。源自受损红细胞的血红蛋白、血红素,尤其是游离铁,也可能通过诱导活性氧(ROS)产生导致粘附分子(VCAM-1和ICAM-1)的异常表达,粘附分子通过红细胞、白细胞和血小板与内皮的粘附来决定血管闭塞。一氧化氮与超氧化物反应会加重ROS引起的血管损伤,形成过氧亚硝酸盐,这是一种对内皮高度有害的分子。由此产生的炎症和缺氧进一步增加了组织因子的表达和随后的凝血级联反应的激活。由游离血红素引起的这种炎症激活的主要后果之一是中性粒细胞胞外陷阱(NETs)的释放,这是由中性粒细胞释放的染色质纤维的网状结构,通过作为血小板和凝血因子激活的支架而有利于凝血。NETs也参与了其他溶血性贫血(如镰状细胞病)血栓形成的发病机制。
(3)微泡脱落据报道,溶血性贫血中循环红细胞衍生的微泡数量增加。已知微泡参与广泛的生物过程,包括血栓形成和炎症。由于NO清除作用,富含血红蛋白的红细胞衍生的微泡的释放可能是溶血性贫血凝血酶原状态增强的原因。此外,表达磷脂酰丝氨酸的微泡可能通过激活因子IX或因子X与凝血酶原复合物的结合来触发凝血酶的产生,而微泡直接释放组织因子仍存在争议。一项针对镰状细胞病患者的研究表明,红细胞衍生的微泡的循环水平与血浆中凝血酶生成生物标志物如D-二聚体、凝血酶原片段1+2等的水平密切相关,支持红细胞衍生微泡与血栓形成之间的关联。
2. 溶血性贫血血栓形成的免疫介导机制:自身免疫性疾病与静脉和动脉血栓形成风险增加有关,因为它们的特征是炎症活性增强,这通过多种机制导致血栓形成前状态,如细胞因子诱导的组织因子表达、内皮功能障碍、,蛋白C系统和纤维蛋白溶解的抑制(通过增加血浆纤溶酶原激活物抑制剂1的水平)、血小板活化、微泡释放、NET生成、接触系统活化以及纤维蛋白原、vWF和因子VIII水平的升高。
(1)自身免疫性溶血性贫血AIHA中血栓形成的特殊机制,除了已经提到的,尚不完全清楚。然而,人们普遍认为,AIHA血栓形成的主要机制是自身抗体诱导的红细胞膜改变,从而导致溶血。此外,根据自身免疫性疾病和APA之间的共同关联,高达60%的AIHA患者发展为APA,其阳性是众所周知的动脉和静脉血栓形成的风险因素。因此,人们可以预期,在急性溶血过程中,APA的存在会进一步破坏止血平衡。然而,关于这一主题的数据存在争议,几项研究未能证明APA阳性与AIHA血栓形成之间的关联。绝大多数血栓栓塞事件发生在活动性溶血发作期间,这一观察结果表明,溶血本身可能代表了AIHA血栓前状态的最重要病理生理机制,而不是疾病特异性免疫介导的机制。
另一方面,在观察到大多数AHIA患者的活动性溶血与补体激活有关之后,与PNH的建议类似,补体也可能在AIHA患者的血栓事件发展中发挥作用。事实上,补体系统和凝血级联之间存在密集的串扰。补体系统通过不同的途径被激活(即经典途径、旁路途径和凝集素途径),所有这些途径都导致转化酶的形成,从而导致补体成分(C3a/C3b和C5a/C5b)的活性形式的发展。C5a和C5b启动补体末端通路,导致膜攻击复合物(MAC)的形成。几种机制可以解释补体介导的凝血激活。特别是C5a和C5b可以激活血小板,诱导组织因子表达,刺激vWF和P-选择素释放,并诱导内皮细胞上凝血酶原组装位点的暴露。此外,凝集素途径的关键酶MASP-2能够通过凝血酶原裂解直接激活凝血酶的产生。此外,C5a通过上调纤溶酶原激活物抑制剂-1(PAI-1),诱导嗜碱性粒细胞和肥大细胞从促凝血活性向促血栓形成活性的转变。虽然在温性自身免疫性溶血性贫血中,补体系统几乎不是溶血所必需的,但后者可能被认为主要是补体介导的冷凝集素疾病。与红细胞表面抗原结合的IgM冷凝集素直接与C1q相互作用,触发经典补体途径的激活,在C5裂解为C5a和C5b之前引起C5激活,形成MAC并最终导致血管内溶血。
(2)阵发性睡眠性血红蛋白尿(PNH)与血栓形成之间的关系尚不完全清楚,据称涉及溶血和非溶血机制的结合。在后者中,血小板、补体系统和凝血之间的相互作用可能解释PNH的血栓负担及其相关死亡率。据报道,血小板通过启动血栓形成,在PNH患者的血栓形成中发挥关键作用。尽管细胞表面调节蛋白CD55和CD59的缺乏使血小板易受补体攻击,可能导致其从循环中被清除并导致血小板减少,但PNH血小板的寿命是正常的。PNH中观察到的补体激活不是破坏血小板,而是通过在血小板表面形成膜攻击复合物(C5b-9),启动一个触发血小板形状变化的过程,最终导致血小板激活。活化的血小板分泌α-颗粒的含量,通过膜去极化,α-颗粒可能与血小板膜融合,使发泡的膜攻击复合物能够胞吐,并释放凝血酶原血小板衍生的微泡。暴露在微泡表面的磷脂酰丝氨酸充当凝血酶原复合物和因子X的结合位点,触发凝血酶的产生。活化的血小板也可能与中性粒细胞相互作用,通过释放中性粒细胞丝氨酸蛋白酶和核小体(NETosis)促进血栓形成,并激活因子X。几项研究探讨了纤维蛋白溶解在PNH血栓形成中的作用。纤维蛋白溶解的损害似乎与PNH白细胞和血小板中GPI-锚定的尿激酶纤溶酶原激活物(u-PA)受体(u-PAR或CD87)的缺乏有关。在缺乏GPI锚的情况下,u-PAR不能与细胞膜结合,在血浆中释放,与膜结合的u-PAR竞争u-PA的结合。这一过程导致u-PA的可用性降低,导致纤溶酶原转化为纤溶酶的减少,从而导致纤维蛋白溶解的减少。最近的一项研究表明,PNH合并无症状溶血患者的血栓形成风险也增加了。血栓形成风险较高的患者是PNH白细胞水平最高的患者,这意味着白细胞在PNH血栓形成的发展中发挥作用,可能是因为它们在NET生成中发挥作用。
三、免疫介导的溶血中的血栓形成倾向
术语血栓形成倾向是指与静脉血栓形成风险增加相关的遗传性或获得性凝血异常。作为是静脉血栓栓塞症独立风险因素,遗传性血栓形成的异常表现为凝血因子V(G1691A,因子V Leiden,FVL)和II(凝血酶原G20210A)的常见功能获得性突变,以及天然抗凝血蛋白抗凝血酶(AT)、蛋白C(PC)和蛋白S(PS)的罕见功能缺失。最常见的获得性血栓形成的异常表现为APA的存在,其定义为狼疮抗凝血剂(LAC)基于血栓的检测(部分凝血活酶时间、稀释罗素毒蛇毒液时间、二氧化硅凝结时间),IgG、IgM、抗心磷脂(ACA)以及抗β2糖蛋白1抗体的基于酶联免疫吸附测定(ELISA)的检测中至少一项检测呈阳性。
没有关于AIHA中遗传性血栓性异常患病率的数据,而APA的作用已经在几项研究中进行了调查,结果存在争议。第一份报告显示,在41名与系统性红斑狼疮相关的AIHA患者中,VTE的风险增加了约四倍。一项针对30名AIHA患者的前瞻性研究进一步支持了这种关联,该研究显示,LAC患者的APA(LAC和ACA)患病率为63%,VTE风险增加了7.5倍,而ACA阳性与此没有显著关联。然而,其他研究并没有证实这种关联。特别是,在28例出现血栓的AIHA患者中,有6例患者没有检测到APA。最大的回顾性研究报告称,308例AIHA患者的APA(ACA或LAC)患病率为13%,但33例VTE患者中没有一人呈阳性。在一项对40例AIHA患者的单中心回顾性研究中,4例患者中检测到APA,但在8例VTE患者中均未检测到APA。另外两项类似的研究未能在23例发生静脉血栓栓塞的21例AIHA患者中发现LAC或ACA或抗β-2糖蛋白1。
鉴于上述因素,考虑到与PNH相关的VTE的高风险,血栓形成异常的共存可能会进一步增加这种风险。第一项研究调查了56名PNH患者的FVL,显示出与健康志愿者相似的患病率(分别为1.8%和2.8%)。另一项研究描述了16例PNH患者,其中4例出现血栓形成的患者中有2例具有遗传性血栓形成倾向性(杂合性FVL),而其余12例没有VTE的患者中只有1例(杂合型凝血酶原基因突变)。在13例PNH患者和100例健康对照中评估了遗传性(AT、PC、PS、FVL、凝血酶原G20210A突变)和获得性(LAC和ACA)血栓形成倾向的存在,除APA患者病例多于对照组外,显示出相似的患病率。最近发表的研究显示,PNH患者的PC和PS水平没有差异,无论是否有VTE。
总的来说,血栓形成倾向性测试在治疗决策中的临床效用仍存在争议,迄今为止还没有发表任何指南。然而,在没有明确的抗血栓预防指征的特殊临床环境中,血栓形成倾向性测试可以为血栓风险的全球评估增加有用的信息,并有助于抗血栓预防的决策。
四、免疫介导的溶血中血栓形成的诊断治疗方法:来自三级转诊中心的专家意见
尽管在临床实践中VTE仍然是一种未被充分重视的并发症,但越来越多的证据表明AIHA中血栓形成的发生率很高。急性溶血引起的严重贫血患者的临床表现与心脏缺血或肺动脉高压引起的肺栓塞患者相似,即胸痛和呼吸困难。因此,应特别注意提示VTE的体征和症状,以便及时诊断和适当治疗。
1. VTE的治疗:由于VTE更可能发生在溶血期间,其发病通常与严重贫血有关。这可能是以治疗剂量开始抗凝治疗的禁忌症。事实上,贫血本身是一个众所周知的出血风险因素,同时,它被认为与血栓形成有关,而与确定的原因无关。此外,考虑到贫血是由溶血而非失血引起的,除非存在伴随的出血危险因素,否则抗凝治疗预计不会加重贫血的程度。因此,如果VTE发作并伴有急性溶血,无论贫血程度如何,都应立即开始抗凝治疗。
在患有VTE的AIHA患者中,抗凝治疗应持续至少3个月或直至血管完全再通。即使达到完全再通,VTE的二级预防也应考虑长期抗凝治疗。为了做出这一决定,应该对VTE的持续风险因素进行广泛分析。特别是,慢性溶血以及VTE的其他风险因素,如类固醇的使用和血栓形成异常(特别是APA的存在),应提示考虑长期抗凝,可能减少剂量(图2,a组)。考虑到补体在AIHA特定亚型(即CAD)中的作用,根据一项II期研究的结果,应考虑使用依库珠单抗治疗,该研究显示使用依库单抗治疗的患者没有血栓栓塞事件。
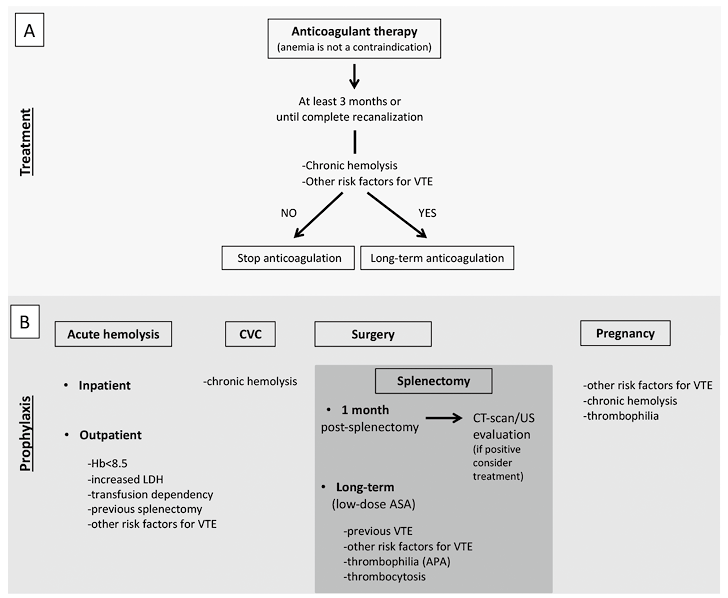
图2. AIHA患者VTE治疗(A)和预防(B)的建议
注:(A).无论贫血程度如何,都应立即开始抗凝治疗,并持续至少3个月或直至完全再通。即使达到完全再通,也应考虑长期抗凝进行VTE的二级预防,以评估VTE持续危险因素的存在。(B).建议急性溶血的住院患者使用低分子肝素进行抗血栓预防,并应考虑与严重贫血相关的急性溶血的门诊患者,尤其是脾切除术患者或同时存在VTE风险因素的患者。在接受中心静脉导管定位的急性溶血患者中,应开始进行抗血栓预防。我们建议对所有慢性免疫介导的溶血患者进行抗血栓预防。在接受脾切除术的患者中,除非有禁忌症,否则应开始使用低分子肝素进行术后抗血栓预防,并持续至少一个月,此时应在停药前进行客观评估。既往有VTE或伴有VTE危险因素的患者应考虑长期抗凝或低剂量阿司匹林。对于患有慢性溶血的孕妇,应开始进行抗血栓预防,尤其是在存在VTE或血栓形成异常的其他风险因素的情况下。VTE,静脉血栓栓塞;AIHA自身免疫性溶血性贫血;CVC,中心静脉导管;CT扫描、计算机断层扫描;超声;ASA,乙酰水杨酸;APA,抗磷脂抗体。
对于PNH患者,除抗凝治疗外,应立即开始使用依库珠单抗,以减少由激活的补体系统代表的凝血酶原状态的主要驱动因素。在PNH患者中,继发于骨髓衰竭的血小板减少症(PNH三联征的特征之一以及溶血和血栓栓塞症)的存在使抗凝治疗特别具有挑战性。有VTE病史的PNH患者应长期继续抗凝治疗,独立于依库珠单抗的联合治疗,除非存在禁忌症,如出血或严重血小板减少症。只有少数病例报告可用于在使用依库珠单抗达到疾病控制后停止抗凝治疗。然而,有证据表明,服用依库珠单抗的患者血栓事件的相对风险降低了85%,这使得有其他血栓形成风险因素的患者可以选择保留长期抗凝治疗(图3,A组)。
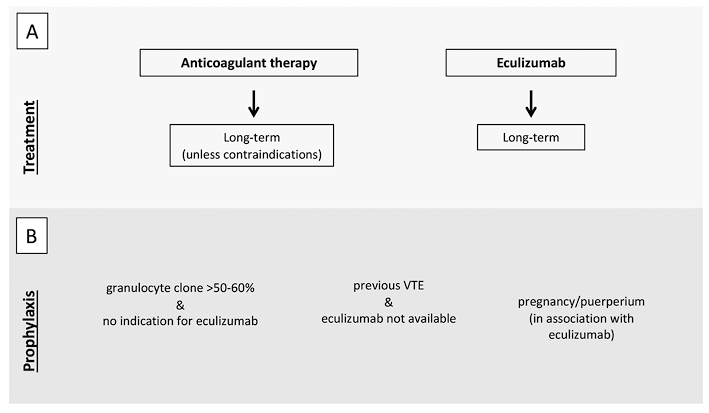
图3. PNH患者VTE治疗(A)和预防(B)的建议
注:(A)在VTE的情况下,应立即开始抗凝治疗和依库珠单抗。除非存在禁忌症,如出血或严重血小板减少症,否则应长期持续抗凝治疗,独立于依库珠单抗的联合治疗。(B)粒细胞克隆>50-60%不符合依库珠单抗治疗适应症的患者、在无法获得依库珠珠单抗的地理区域内既往发生VTE的患者以及妊娠和产褥期应考虑抗凝预防。VTE,静脉血栓栓塞;PNH阵发性睡眠性血红蛋白尿。
2. 抗血栓预防:初级抗血栓预防是一个具有挑战性的问题。VTE在急性溶血期间更为常见,发病率约为20%,尤其是与严重贫血(血红蛋白低于8.5g/dL)、高乳酸脱氢酶水平和其他溶血参数、输血依赖性和既往脾切除术相关的情况。根据2017年BJH指南和2020年AIHA国际共识会议,建议急性溶血住院患者使用低分子肝素进行抗血栓预防(分别为1C级和99%一致性),并应考虑与严重贫血(Hb<8.5g/dL)相关的急性溶血门诊患者(分别为2C级和97%一致性),特别是在存在VTE的伴随风险因素的情况下,如既往事件、活动能力下降、血栓形成异常、年龄、活动性癌症。另一种特殊情况是中心静脉导管定位,这代表了静脉血栓形成的局部风险因素,但它本身并不是一种初级预防的指征。我们的建议是,在进行中心静脉导管放置的活动性溶血患者中开始抗血栓预防治疗(图2,B组)。据报道,与未经预防的患者(5/15,33.3%)相比,在溶血性发作期间进行预防的患者中,VTE的发生率较低(1/21,4.8%)。对于长期一级抗血栓预防的候选患者,建议使用低剂量阿司匹林,而不是低分子量肝素。
在50-60%粒细胞克隆不符合依库珠单抗治疗适应症的PNH患者中,应考虑初级抗血栓预防,根据依库珠单抗前时代的研究显示,较大克隆的VTE风险较高(35-54%vs6-17%)。应考虑对在没有依库珠单抗的地理区域内既往有VTE的PNH患者进行初级抗血栓预防,而对开始使用依库珠单抗治疗的既往无VTE的患者则不适用。服用依库珠单抗的患者血栓事件的相对风险降低了85%,这促使我们在没有其他血栓形成风险因素的情况下避免对这些患者进行抗血栓预防(图3,B组)。
动脉血栓形成事件的发生率低于静脉血栓形成事件。在两项针对AIHA患者的大型研究中,共发生了8例(2%)动脉血栓形成(3例中风、2例短暂性脑缺血发作、3例心脏缺血事件)。对既往有动脉疾病的患者使用抗血小板药物进行二次预防似乎是谨慎的。
(1)另一种需要考虑抗血栓预防的情况是手术。由于VTE的高风险与手术本身和活动能力降低相关,因此我们建议对所有慢性免疫介导的溶血患者进行抗血栓预防,而不考虑VTE的其他伴随风险因素。脾切除是一种特定情况,这是免疫介导溶血患者血栓形成的独立风险因素,主要影响脾脏,也影响门静脉。大约2%的因不同原因接受脾切除术的患者在手术后90天内出现VTE,其中免疫介导的溶血患者的风险最高(一个系列的患病率高达8%)。脾切除术后,全身和局部因素都可能导致血栓形成。全身因素表现为手术诱导的高凝状态和脾脏切除后继发的反应性血小板增多,而局部因素表现为结扎残余脾静脉,形成以瘀血和湍流为特征的静脉残端,导致局部凝血能力增加。根据这一证据,脾切除后内脏静脉血栓形成的任何提示性体征或症状,如腹痛、发烧或肠梗阻,都应及时进行客观诊断。此外应开始用低分子肝素进行适当的术后抗血栓预防,除非有禁忌症(2017年BJH指南中建议1C的级别),并且对于风险特别高的患者,应考虑延长出院后的时间尽管延长,虽然抗血栓预防的益处尚不确定,但我们建议在脾切除术后至少持续一个月,并在停药前进行客观检测。由于脾切除后由于局部或全身性原因,VTE的长期风险增加,如脾静脉闭合或反应性血小板增多等,特别是在免疫介导的溶血患者中,应考虑长期抗凝或低剂量阿司匹林预防,特别是在既往有VTE或伴发危险因素如血栓形成倾向性异常(主要是APA)的患者(图2,B组)。尽管目前不建议对所有免疫介导性溶血患者进行系统的血栓性检测,但在脾切除术前应评估APA是否存在。
(2)由于生理性促凝剂改变了止血平衡,妊娠本身就是静脉血栓栓塞的高危情况。在免疫介导的溶血的情况下,可以考虑进行抗血栓预防。考虑到其极为罕见,目前还没有证据表明如何治疗免疫介导的溶血孕妇。然而,2017年BJH指南建议,如果其他风险因素共存,则考虑产前和产后6周的预防(建议1C级)(图2,A组)。在这种情况下,血栓形成倾向性筛查可能有助于制定抗血栓预防处方。对于PNH,即具有最严重凝血酶原状态的免疫介导的溶血性贫血,在没有禁忌症的情况下,应在妊娠和产褥期使用低分子肝素进行抗血栓预防。加拿大PNH网络的2019年共识声明建议在妊娠期使用依库珠单抗,并进行密切随访,尤其是在妊娠早期,因为超过50%的患者在分娩前需要增加剂量和/或频率,直到分娩。在依库珠单抗之前的时代,产妇死亡率约为8-21%,主要是由于VTE,胎儿死亡率为4-9%,而在一项关于依库珠单抗在妊娠期使用的真实研究中,没有产妇死亡报告,胎儿死亡率的报告为4%。在这项研究中,88%的患者也进行了抗凝治疗,妊娠期间没有发生VTE,但有2例(3%,一例深静脉血栓形成和一例内脏静脉血栓形成)发生在产后,另外2例发生在依库珠单抗停药后(图3,B组)。对于使用与血栓形成风险增加相关的口服避孕药的女性,也可以进行类似的考虑。尽管不建议在开具处方前对普通人群进行血栓形成倾向性筛查,但在这些患者中,这可以优化他们的使用,并导致开具与低血栓形成风险相关的化合物的处方,或在选定的病例中开出伴随的抗凝血治疗处方。
五、小结
VTE是免疫介导的溶血性贫血患者发病率和死亡率的重要原因,需要及时诊断和适当治疗。尽管近年来对急性溶血患者的管理策略有了更好的定义,但在其他情况下,如慢性溶血、侵入性手术、脾切除术和妊娠,仍缺乏最佳使用抗血栓预防的证据。在这些情况下,对VTE的个体风险状况进行仔细和彻底的评估将有助于识别风险增加的患者,这些患者可能受益于抗血栓预防。到目前为止,关于免疫介导的溶血患者的血栓形成异常的数据很少,而APA的数据也不一致。然而,由于他们的血栓形成风险高,建议至少对所有患者进行APA检测。在上述特定情况下,可以考虑进行广泛的血栓形成倾向性筛查,以优化初级抗血栓预防的决策。
编译自《J Clin Med》2021 Apr;10(8)




